
导读:
线粒体转移是在各种病理条件下恢复受损细胞的自发过程。在给药之前将线粒体转移到细胞治疗产品中可以提高治疗效果。然而,先前报道的方法效率较低,限制了其临床应用。为此,香港城市大学孙东教授团队开发了一种基于液滴微流控的线粒体转移技术,该技术利用了液滴微流控高通量、区域化的特点,并结合了共培养线粒体转移方法对细胞无物理损伤的优点,在单细胞水平上实现了高效、高通量的定量线粒体转移。相关研究以“High-efficiency quantitative control of mitochondrial transfer based on droplet microfluidics and its application on muscle regeneration”为题目,发表在期刊《Science Advances》上。
本文要点:
1、本研究提出了一种基于液滴微流控的线粒体转移技术,该技术结合了液滴微流控和共培养线粒体转移方法的优点,可在单细胞水平上实现高效、高通量的定量线粒体转移。
2、由于线粒体对肌肉至关重要,利用成肌细胞和肌肉损伤模型作为概念验证模型,对所提出的技术进行评估。
3、体外和体内实验表明,与转入0、8和14个线粒体的C2C12细胞相比,转入31个线粒体的C2C12细胞在细胞功能方面有明显改善,对肌肉再生也有更好的治疗效果。
4、该技术可大大促进线粒体转移的临床应用,通过优化细胞功能,为与线粒体相关的疾病提供了新的细胞治疗策略。
全文总结/概括:
先前报道的线粒体转移方法具有以下局限性:
1.共培养法:
- 效率低,最高转移效率仅为28%。
- 即使分离的线粒体数量相同,转移的线粒体数量也不均匀(每个受体细胞1至60个线粒体)。
- 受体细胞的细胞代谢恢复率不理想(约为0.2%)。
- 成功与否取决于许多不可控因素。
2.基于光学镊子(OT)的操纵系统:
- 通量低,阻碍了其临床应用。
3.微注射法:
- 由于细胞膜打开,会对受体细胞造成损伤。
- MitoPunch技术(一种改进的微注射技术)虽然提高了注射速度,但仍会造成细胞膜开裂,不利于细胞存活。
总之,以往的方法要么效率低、异质性强,要么会对受体细胞造成损伤,要么通量低,限制了其临床应用。基于液滴微流控技术的新方法旨在克服这些局限性。
具体而言,这种基于液滴微流控的线粒体转移技术主要通过以下方式克服了传统方法的局限性:
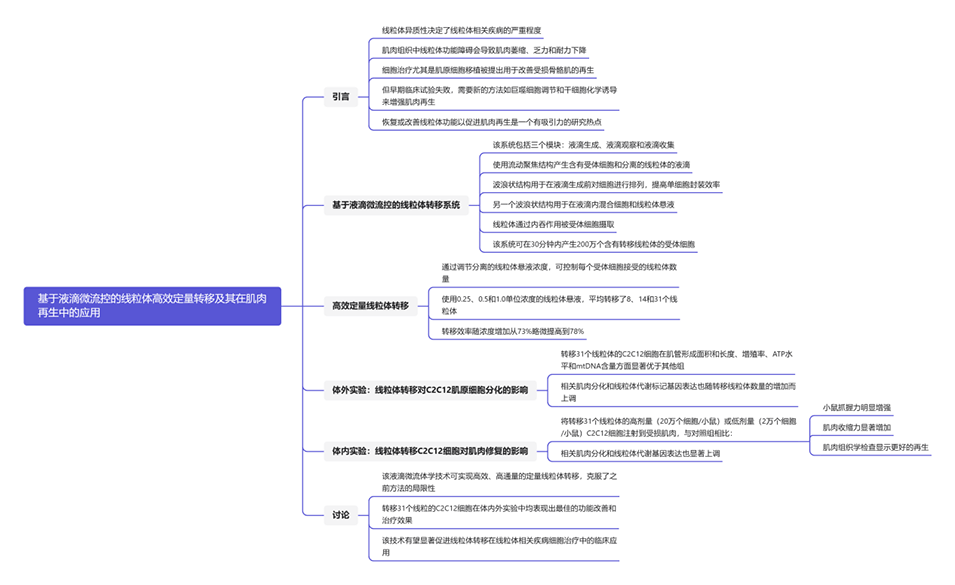
1、高转移效率:封闭的液滴环境增加了分离线粒体接触和被受体细胞吸收的概率,提高了转移效率,最高达到75-78%。
2、定量控制:通过调整分离线粒体悬液的浓度,可以精确控制每个受体细胞接收到的线粒体数量。
3、高通量:该微流控芯片可以在2.5小时内生成200万个线粒体转移细胞,大大提高了吞吐量。
4、细胞存活率高:该方法不需要打开细胞膜,可以保持受体细胞的高存活率。
这种基于液滴微流控的线粒体转移技术在肌肉再生方面的潜在应用包括:
1、促进肌肉细胞再生:通过高效、定量线粒体转移,该技术可以增强受损肌肉细胞的功能,促进肌肉细胞的再生和修复。
2.治疗肌肉疾病:该技术可用于治疗与线粒体功能障碍相关的肌肉疾病,如肌肉萎缩,通过恢复线粒体功能来改善肌肉健康。
3、优化肌肉再生疗法:结合其他肌肉再生疗法,如肌母细胞移植,该技术可以增强治疗效果,加速肌肉再生和康复。
4、研究肌肉再生机制:通过使用该技术,研究人员可以深入探讨线粒体在肌肉再生过程中的作用,为开发更有效的肌肉再生疗法提供理论支持。
5、开发个性化治疗方案:通过根据个体患者需求定量控制线粒体转移,可以制定个性化的肌肉再生治疗方案,提高治疗效果。
总的来说,这种基于液滴微流控的线粒体转移技术为肌肉再生领域提供了创新的治疗方法和研究工具,有望在未来的肌肉再生疗法中发挥重要作用。

图1.系统设置示意图、基于液滴微流控的线粒体转移技术的工作流程和实验评估。

图2.基于液滴微流控的线粒体转移系统示意图。
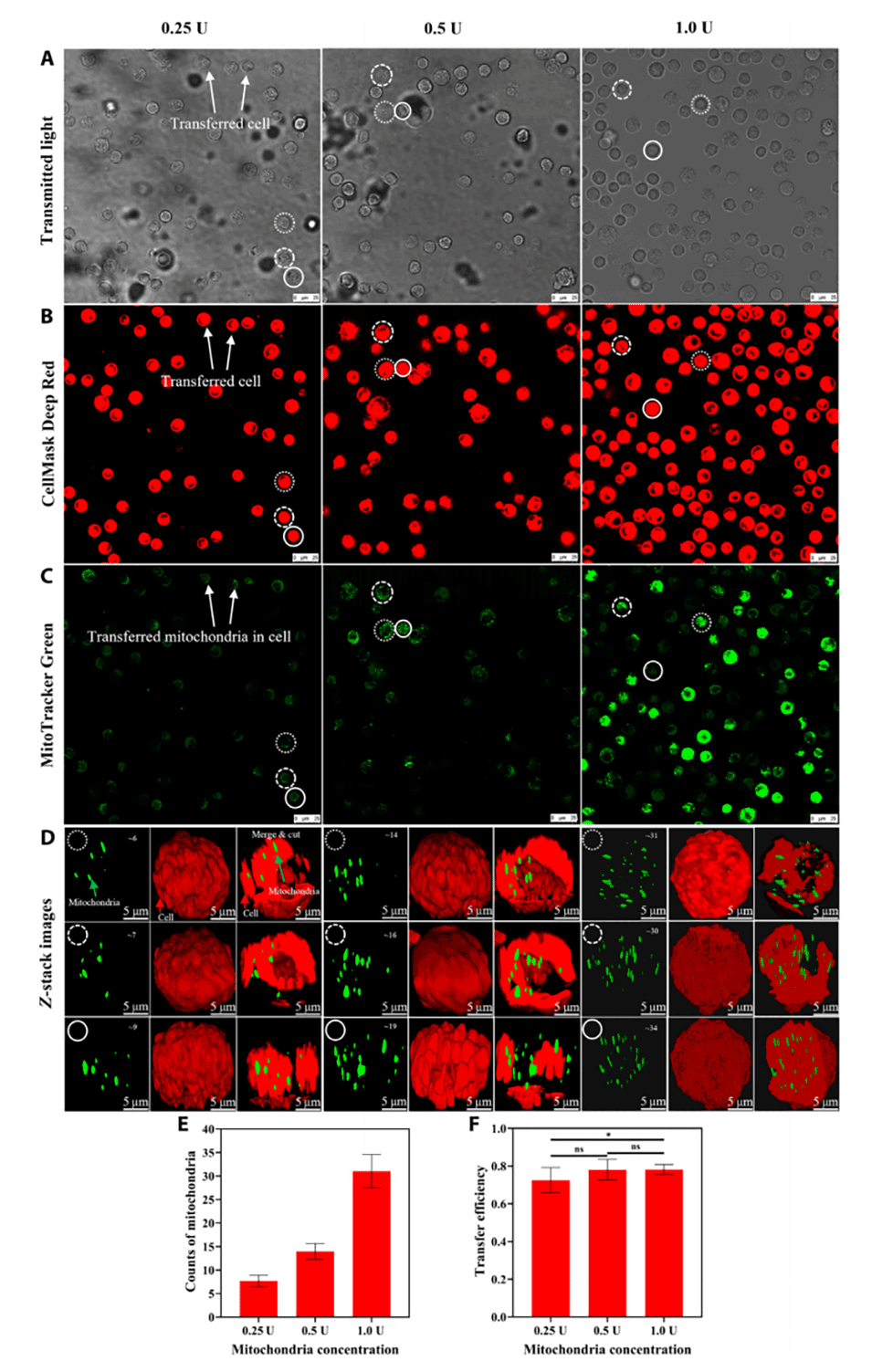
图3.基于液滴的线粒体转移方法的定量控制。

图4.线粒体转移对C2C12肌母细胞成肌分化影响的体外研究。
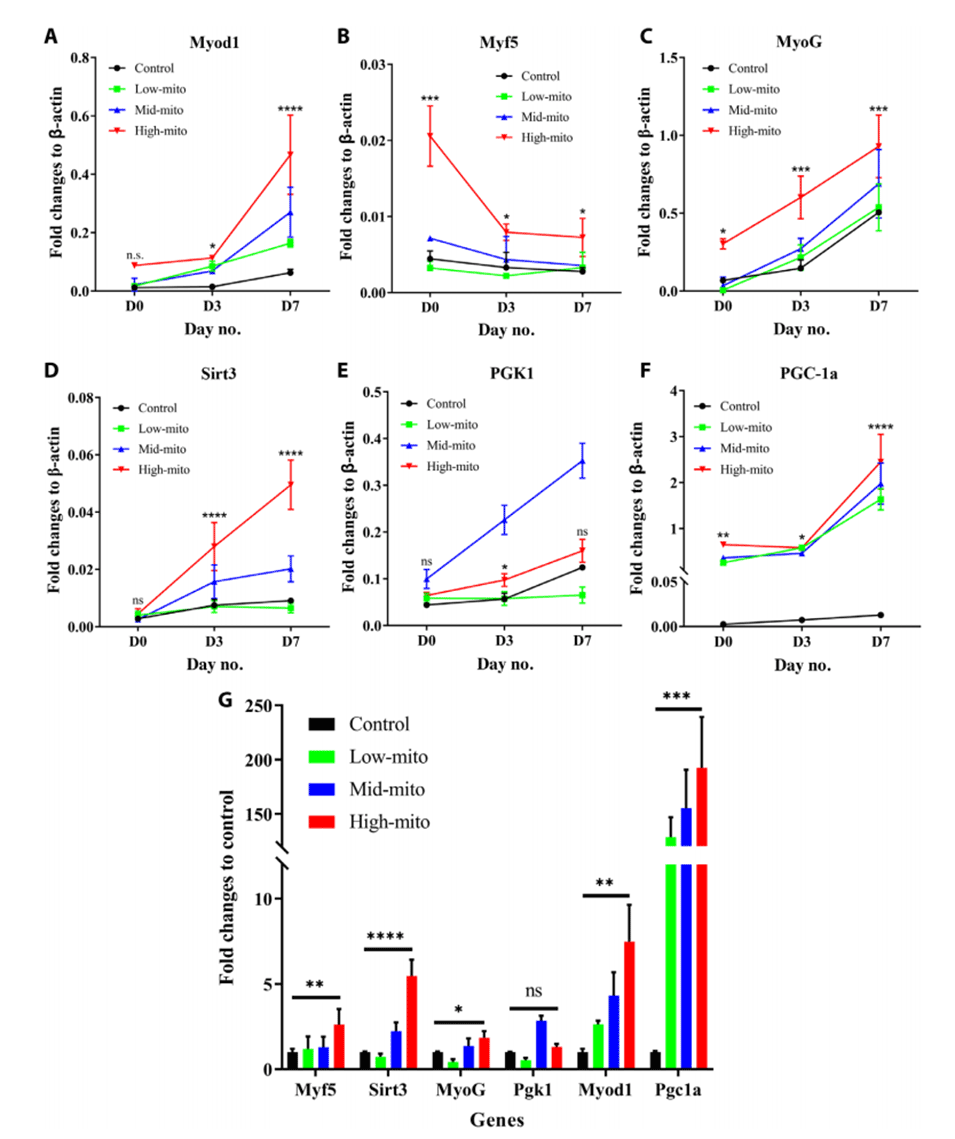
图5.线粒体转移后C2C12细胞成肌分化过程中肌源性因子和线粒体相关基因的表达。
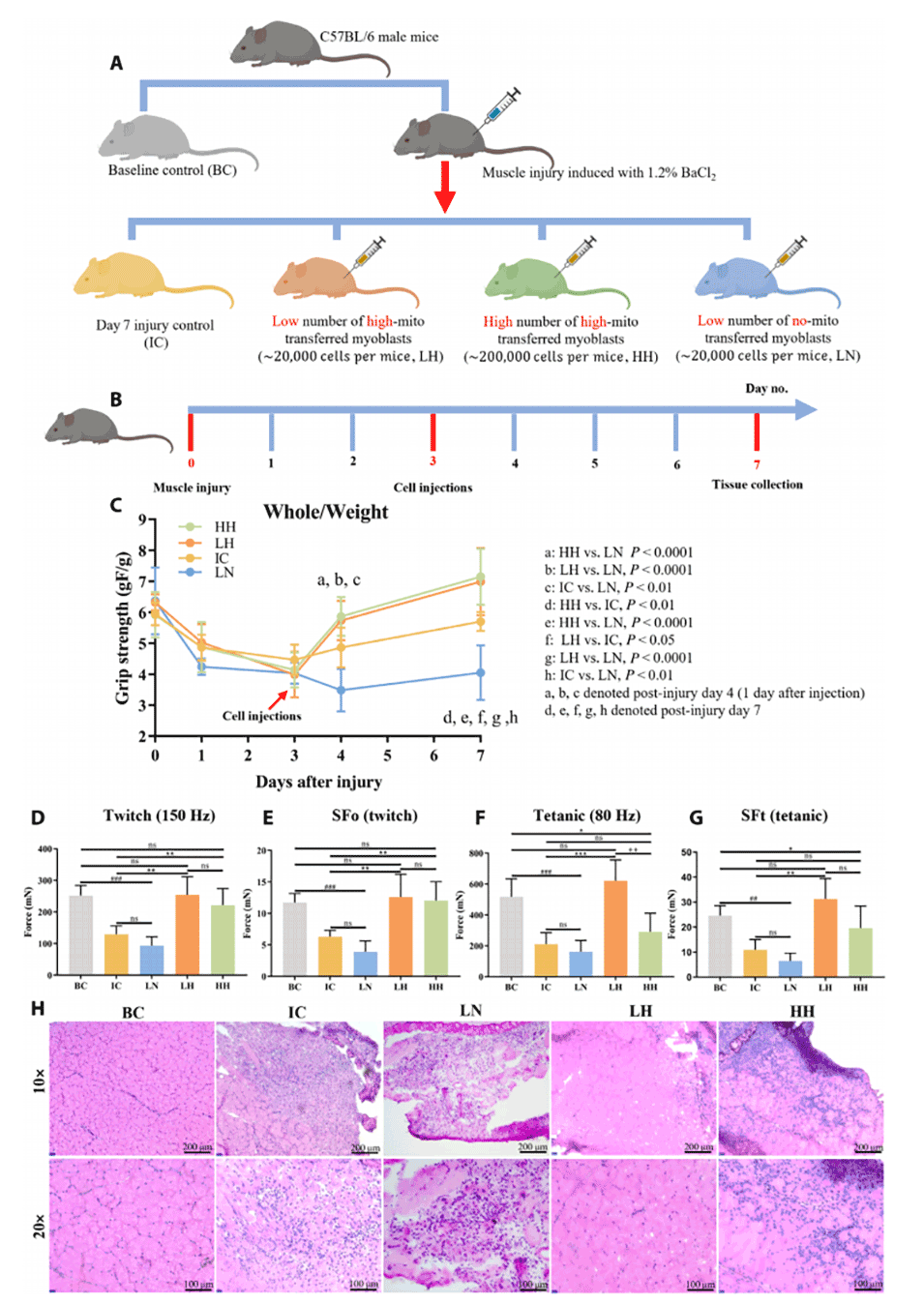
图6.线粒体转移的C2C12注射对肌肉再生影响的体内研究。
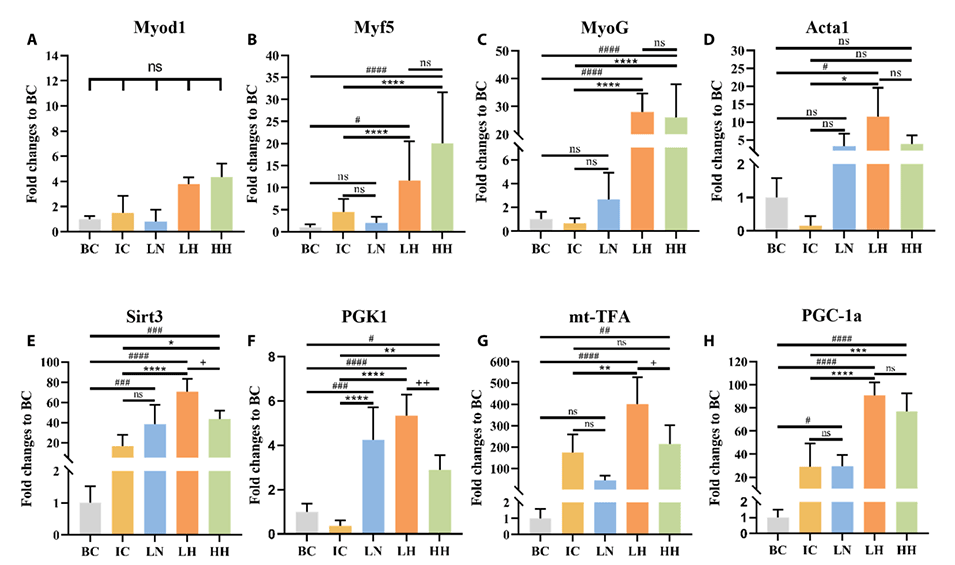
图7.注射C2C12细胞后肌肉组织损伤小鼠的肌源性因子和线粒体代谢基因表达水平。
原文链接:
https://www.science.org/doi/10.1126/sciadv.abp9245














