
循环肿瘤细胞(CTC)是肿瘤转移的关键驱动因素,触发了癌症进展的不可逆过程。深入理解血流动力学中的剪切应力如何影响CTC对揭示其在肿瘤转移中的作用至关重要。近期,香港城市大学杨梦甦教授团队开发了一种微流控循环系统来模拟CTC微环境,并研究了肝癌细胞对不同水平的流体剪切应力(FSS)的反应。相关研究以“Distinguishing high-metastasis-potential circulating tumor cells through fluidic shear stress in a bloodstream-like microfluidic circulatory system”为题目,发表在期刊《Oncogene》上。
本文要点:
1、本研究使用微流控循环系统模拟CTC微环境,以研究典型肝癌细胞对不同流体剪切力水平的反应。
2、在FSS下存活的HepG2细胞表现出TLR4和TPPP3基因的显著过表达,这与HepG2的集落形成、迁移和抗凋亡能力相关。
3、此外,在小鼠模型中,过表达这两种基因的SK-Hep-1细胞通过尾静脉注射显示出对肝脏和肺部的增强转移潜能。
4、TLR4和TPPP3的上调可能通过p53-Bax信号通路增加FSS介导的细胞存活和转移。
5、这些基因的高表达与肝癌患者较差的总体生存率相关,为早期癌症诊断和靶向治疗新策略的开发提供了可能。
全文总结/概括:

微流控循环系统如何帮助研究CTC对流体剪切应力的反应?
1、模拟生理环境:微流控系统可用于模拟体内血液循环的生理条件,包括血流速度和压力,为CTC提供一个接近真实的流体环境。
2、精确控制剪切应力:通过调节微流控系统中的流体速度,可以精确控制CTC受到的流体剪切应力的大小,从而研究不同应力水平对CTC的影响。
3、实时监测:借助微流控循环系统,研究人员可实时监测CTC在流体剪切应力作用下的行为变化,如细胞形态、迁移和聚集等。
4、细胞活性和功能分析:利用微流控系统,可以对经过流体剪切应力处理的CTC进行活性测定和功能分析,比如通过Live/Dead染色和细胞迁移实验。
5、基因和蛋白表达分析:通过RNA测序和Western blotting等技术,研究CTC在流体剪切应力作用后的基因和蛋白表达变化,识别关键的生物标志物。
6、机制探究:微流控循环系统提供了一个平台来探究CTC对流体剪切应力的响应机制,包括细胞信号传导途径的激活和细胞生存能力的调节。
7、临床相关性研究:通过与临床样本的比较分析,微流控循环系统有助于研究CTC的流体剪切应力反应与癌症患者预后之间的关系。
这些方法和技术的综合使用,使得微流控循环系统成为研究CTC对流体剪切应力反应的重要工具。
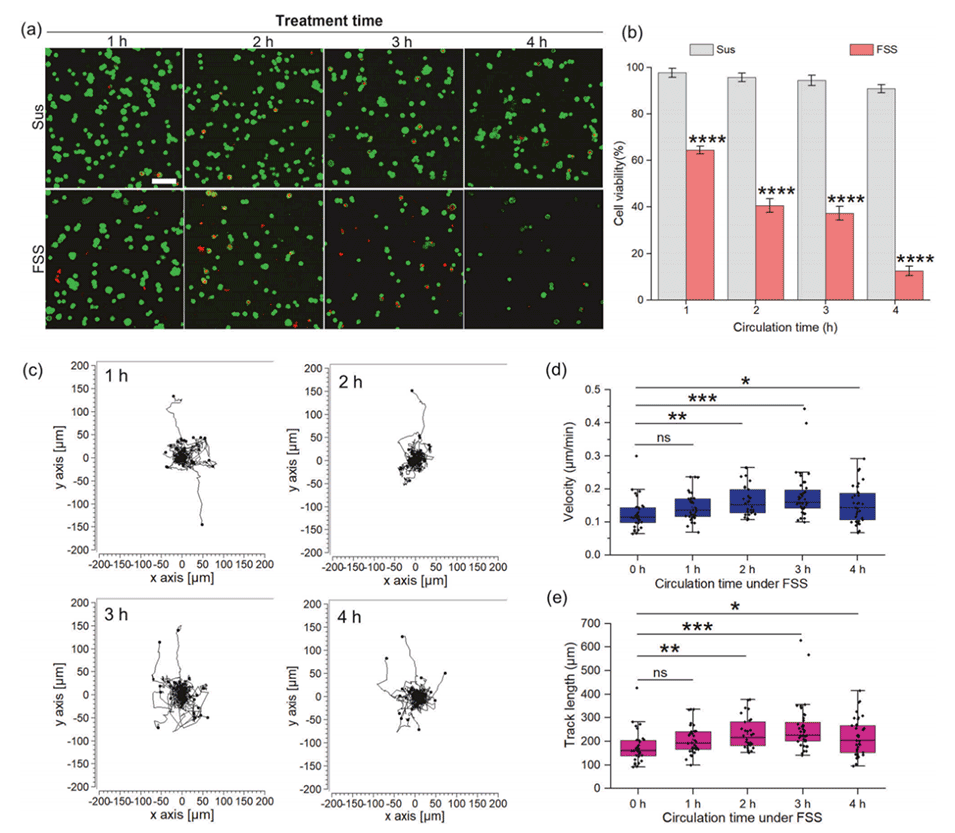
图1.HepG2细胞对FSS的反应。
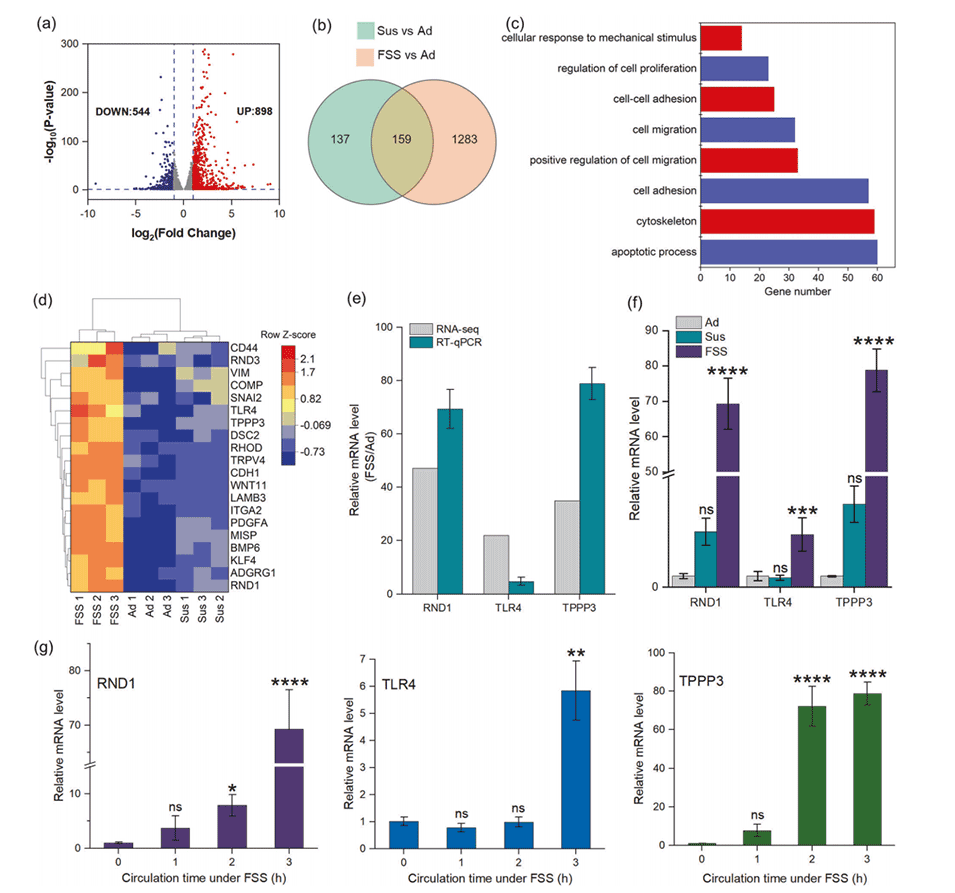
图2.通过RNA-seq和RT-qPCR对经FSS处理的HepG2细胞中差异表达基因的研究。
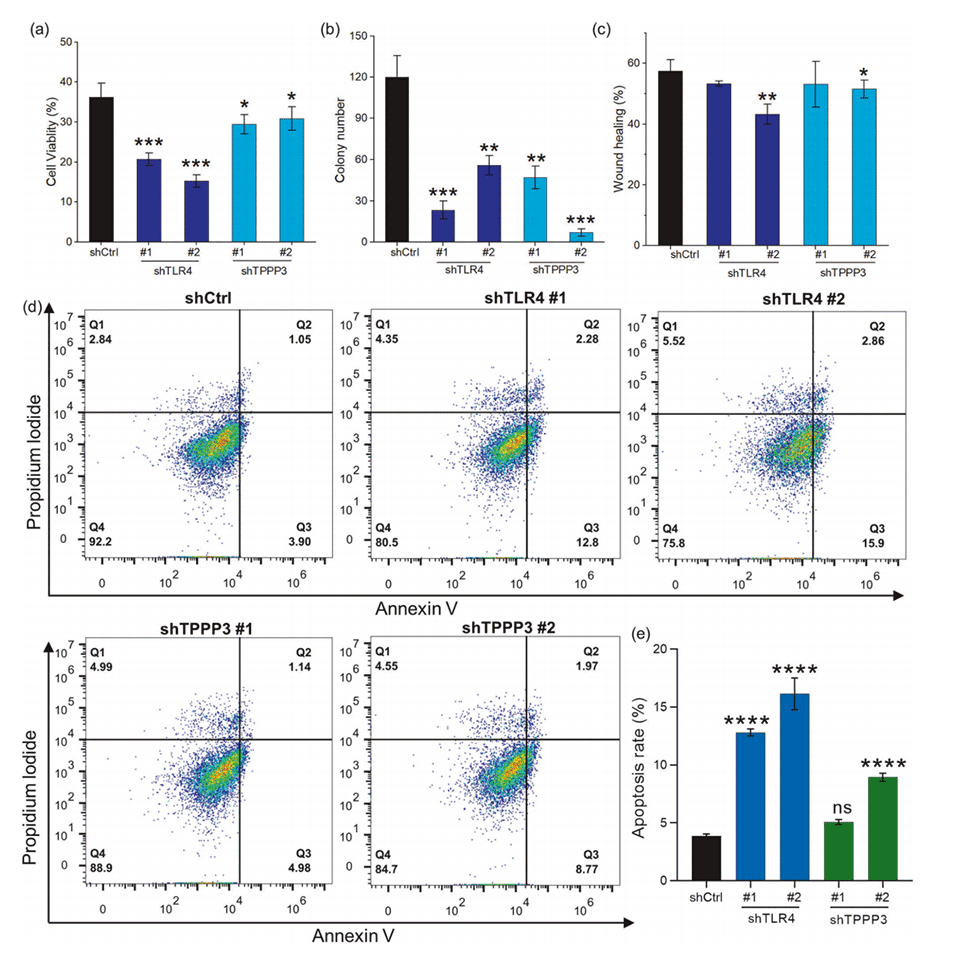
图3.下调TLR4或TPPP3对HepG2细胞的循环存活、集落形成、迁移和抗失巢凋亡的影响。
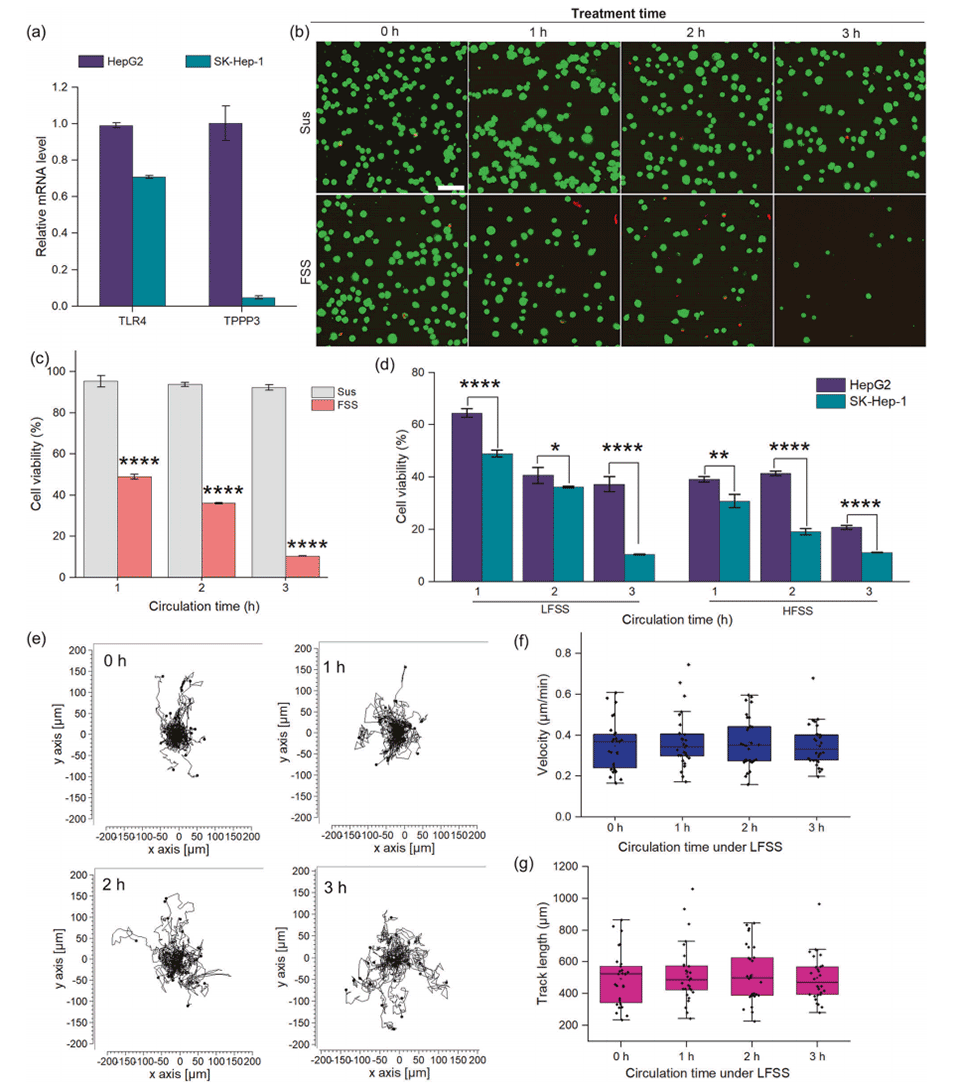
图4.SK-Hep-1细胞对FSS的反应。
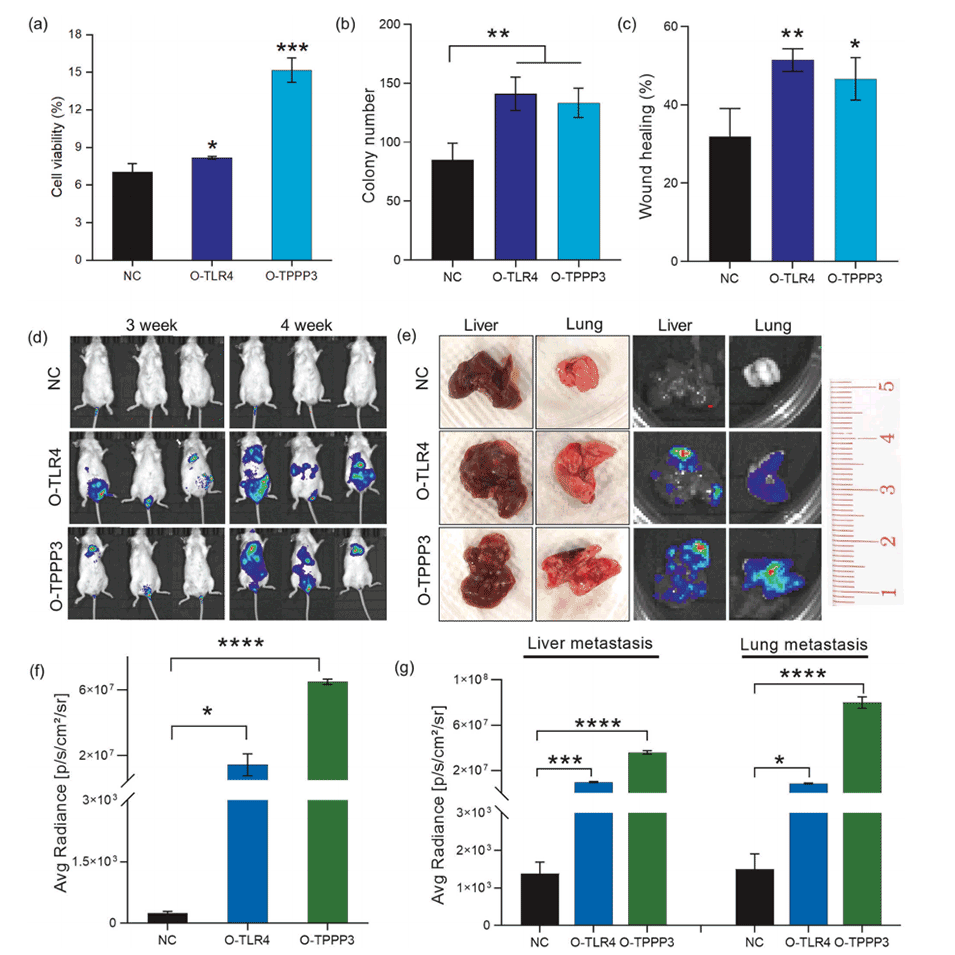
图5.TLR4或TPPP3过表达的SK-Hep-1细胞在体外和体内的反应。
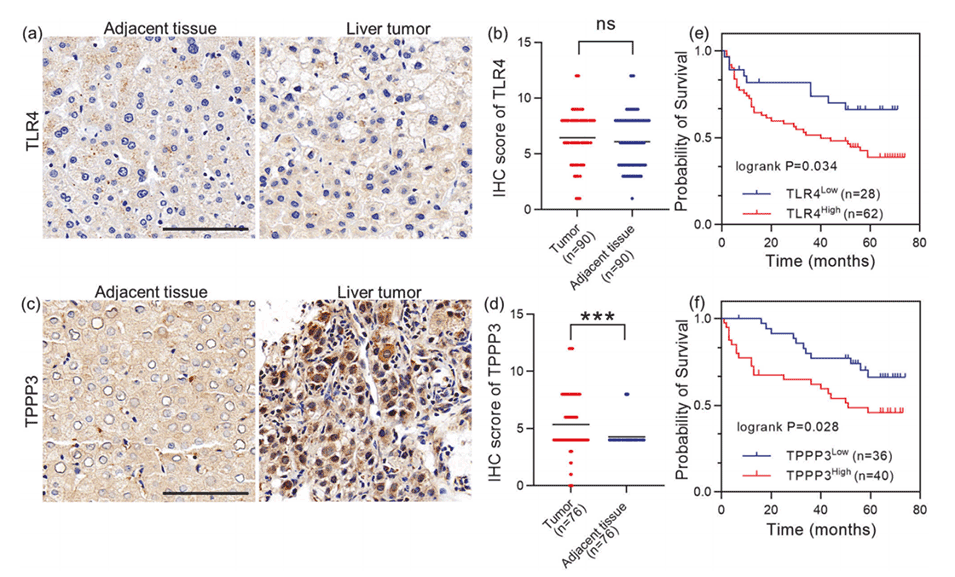
图6.TPPP3和TLR4在肝癌中的临床意义。
原文链接:https://doi.org/10.1038/s41388-024-03075-4














