研究背景:
癌症是全球主要死因之一,每年约有1000万人死于癌症。早期发现癌症并给予及时治疗是提高治愈率的关键,但现有成像技术分辨率的限制使得早期诊断具有挑战性。因此,生物医学领域正越来越多地关注于癌症生物标志物的检测,尤其是循环肿瘤细胞(CTCs)的检测,以实现癌症的早期诊断。
CTCs是指从原发肿瘤病灶脱落并进入外周血液循环的各类肿瘤细胞,它们在癌症转移中起着重要作用,且在癌症早期阶段即可被检测到。CTCs的检测不仅可以帮助追踪肿瘤的进展,评估治疗效果,还能实现个性化治疗,并且相较于组织活检,对患者更为温和。
目前,CTCs的检测方法包括免疫荧光成像、流式细胞术、荧光光谱、表面增强拉曼光谱(SERS)、电化学检测和电感耦合等离子体质谱(ICP-MS)等。ICP-MS作为一种元素特异性检测技术,具有低检出限、宽线性范围、高灵敏度和多元素同时检测的优势,使其在CTC计数和表面蛋白分析领域显示出巨大潜力。然而,由于在早期肿瘤患者每毫升全血中CTCs的数量极少,大约只有1-10个,占总血细胞数的十亿分之一,因此迫切需要开发一种高效的CTCs分离和富集方法,以便在ICP-MS检测前对血液样本进行处理。

导读:
近期,武汉大学胡斌教授课题组开发了一种新型级联相转移微流控芯片,结合磁性探针和电感耦合等离子体质谱(ICP-MS)技术,实现了对循环肿瘤细胞(CTCs)的高效分选、纯化、释放和高灵敏度检测,为早期癌症诊断提供了一种高集成度、高细胞活性和高回收率的分析方法。相关研究以“A Cascaded Phase-Transfer Microfluidic Chip with Magnetic Probe for High-Activity Sorting, Purification, Release, and Detection of Circulating Tumor Cells”为题目,发表在期刊《Analytical Chemistry》上。
本文要点:
1、本研究开发了一种集成磁性探针和电感耦合等离子体质谱(ICP-MS)技术的新型级联相转移微流控芯片,用于高效分离、纯化、释放及检测血液中的循环肿瘤细胞(CTCs)。
2、利用EpCAM适配体修饰的磁珠特异性捕获MCF-7细胞,通过芯片内不同功能区域实现细胞分离与纯化。
3、在释放区,细胞通过强磁力和流体动力被固定在凹槽内,与核酶溶液接触,核酶溶液能够切割捕获探针上的适配体,从而温和地释放出细胞,避免了细胞活性的损失。
4、通过使用ICP-MS测量细胞中的内源元素Zn进行细胞计数,在加标的血液样本中,MCF-7细胞的平均回收率达到了84%。
5、该方法成功应用于乳腺癌患者血液样品的CTC检测,为肿瘤早期诊断提供了新的策略。
全文总结/概括:
本研究开发的新型级联相转移微流控芯片在CTCs检测中主要有以下几大优势:
1、高效的CTCs分离和纯化能力:芯片结合了被动分选和主动分选机制,能够高效地从血液样本中分离CTCs,并将其与其他血液细胞进行有效分离。这大大提高了CTCs分选的效率和纯度。
2、温和的CTCs释放方式:芯片利用核酸酶溶液切断连接CTCs与磁珠的适配体,实现了CTCs的温和释放,保持了释放后细胞的高活性,为后续的细胞培养和分析提供了良好的基础。
3、灵敏准确的CTCs检测:芯片与ICP-MS检测系统集成,利用细胞内源性元素Zn进行CTCs计数,避免了外源性标记物对细胞的损伤,并能够实现对CTCs的灵敏、准确检测。
4、高度集成的功能:该芯片集CTCs捕获、分离、纯化、释放和检测于一体,大大简化了操作流程,提高了检测效率,为临床应用提供了良好的基础。
总之,这种新型级联相转移微流控芯片在CTCs检测中展现出高效、温和、灵敏的优势,为肿瘤早期诊断、疾病监测和预后评估等提供了一种创新性的分析平台。
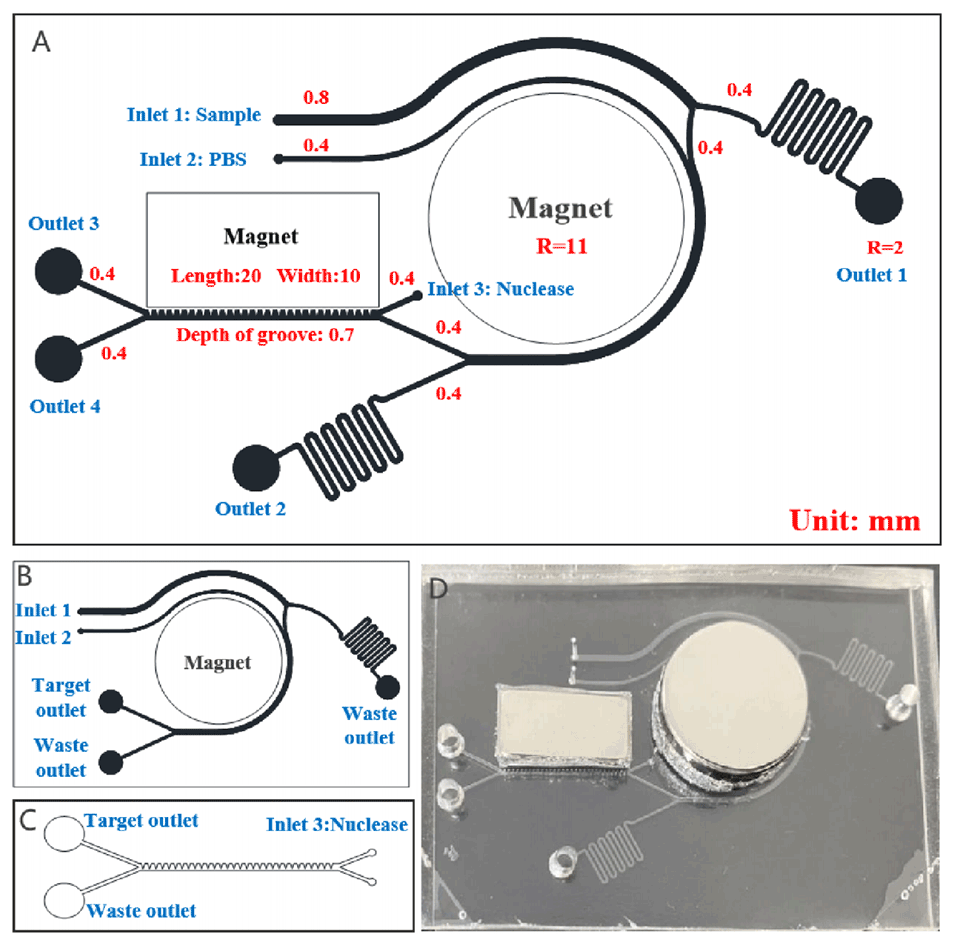
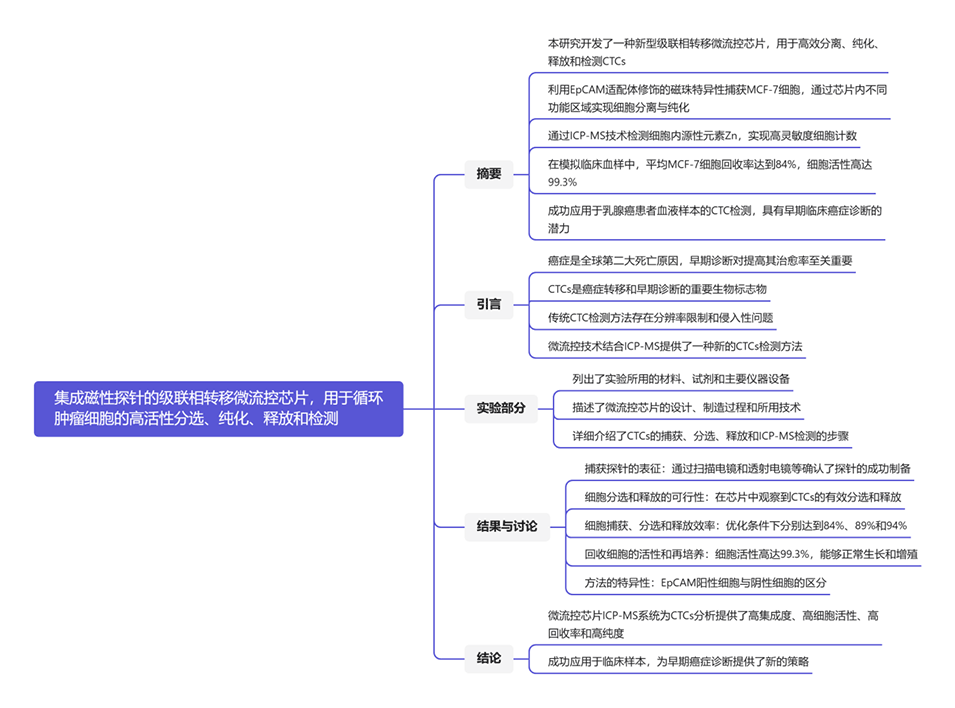
图1.芯片设计图和尺寸。
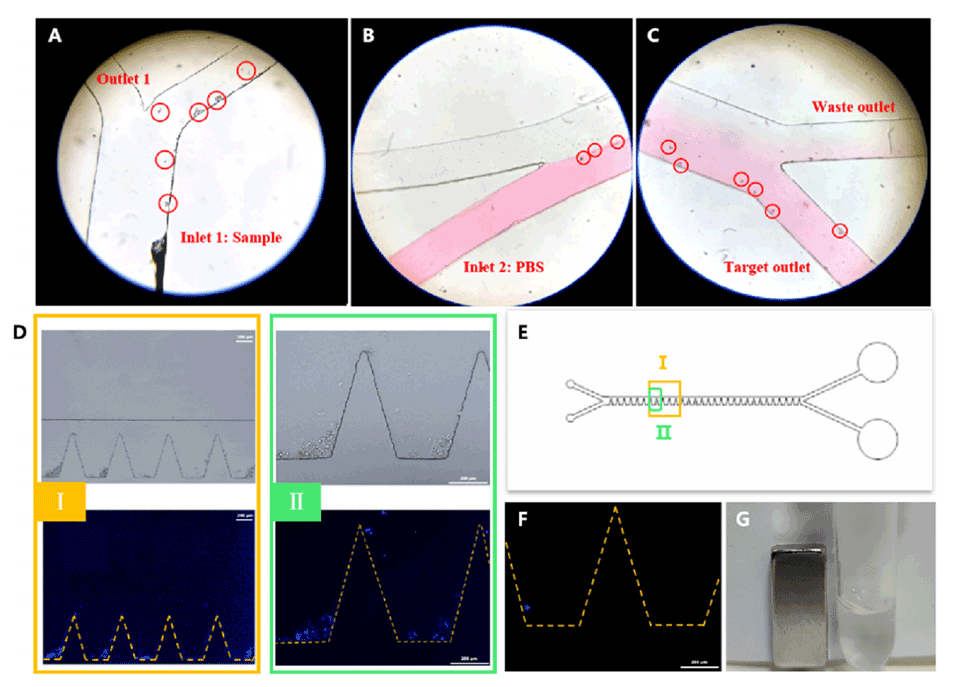
图2.细胞分选和释放的可行性。
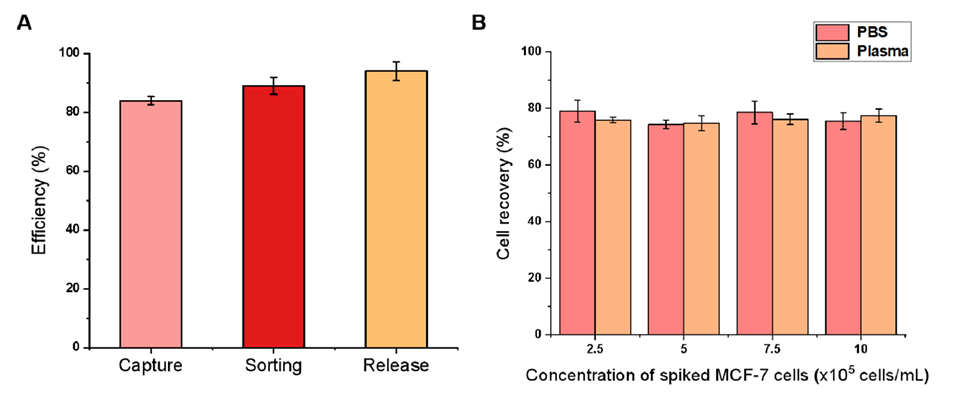
图3.(A)最佳条件下PBS中MCF-7细胞的细胞捕获、分选和释放效率;和(B)在PBS和血浆中不同密度的MCF-7细胞的细胞回收。
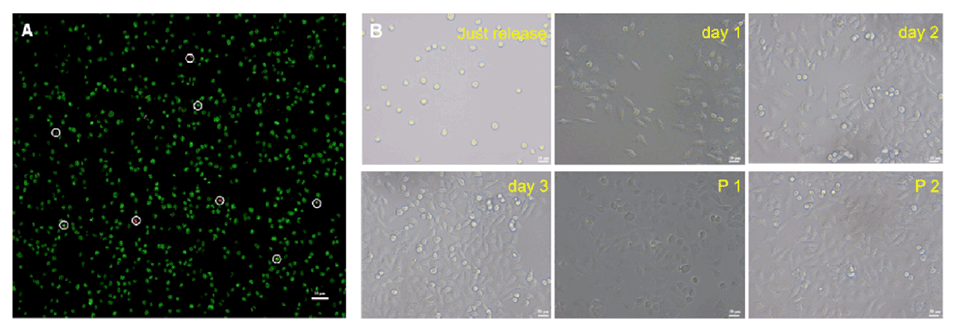
图4.(A)释放的MCF-7细胞经AO/EB染色后的荧光图像;(B)刚刚释放、再培养1、2和3天并到达第一代(P1,约6天)和第二代(P2,约10天)的MCF-8细胞的光学显微镜图像。
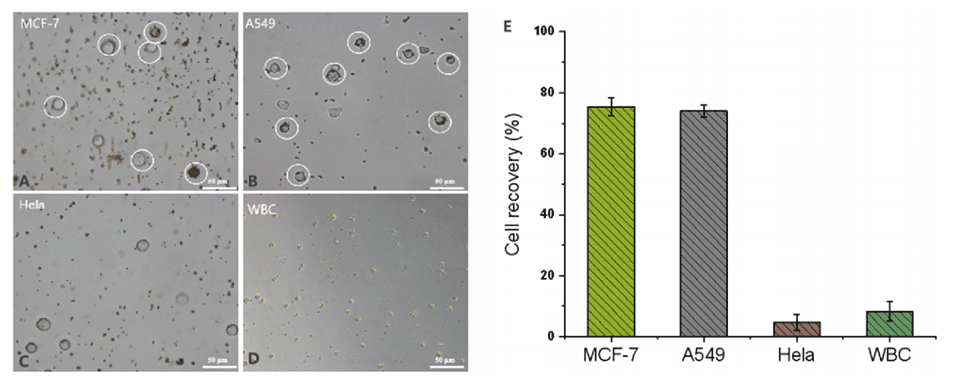
图5.方法的特异性。
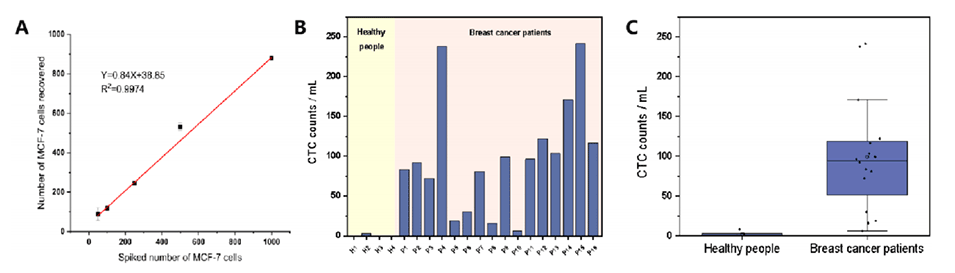
图6.(A)不同加标水平的模拟临床血样的ICP-MS计数结果;(B)来自16名乳腺癌患者和4名健康人的1mL全血中CTC的细胞计数的条形图和(C)箱形图。
原文链接:https://doi.org/10.1021/acs.analchem.3c03971














