患者来源的肿瘤类器官(PDOs)保留了肿瘤组织的复杂多样性和物理结构,近年来已成为癌症机制研究、癌症药物筛选和个体化医疗的一种很有前途的体外工具。然而,由于肿瘤生态位中细胞类型的异质性和多样性对治疗效果至关重要,单独的PDOs并不能完全代表体内肿瘤。肿瘤与免疫细胞之间的相互作用显著影响个体对免疫治疗的反应,因此构建肿瘤-免疫细胞相互作用模型显得尤为重要。尽管已有研究通过共培养PDOs与免疫细胞来探索肿瘤-免疫相互作用,但对免疫介导的杀伤行为和细胞因子变化的定量评估仍然是一个尚未解决的问题。

近期,北京协和医院梁乃新团队与北京理工大学魏泽文团队合作,开发了一种名为IOI-Chip的微流控芯片,用于评估患者来源的肿瘤类器官(PDOs)与自体免疫细胞之间的相互作用,并通过临床样本验证了其在评估免疫介导的肿瘤杀伤行为及细胞因子变化方面的有效性,为癌症的个性化治疗和药物筛选提供了新的体外评估工具。相关研究以“Quantitatively Evaluating Interactions between Patient-Derived Organoids and Autologous Immune Cells by Microfluidic Chip”为题目,发表在期刊《Analytical Chemistry》上。
本文要点:
1、本研究开发了一种微流控芯片(IOI-Chip),用于定量评估患者来源的肿瘤类器官(PDOs)与自体免疫细胞之间的相互作用。
2、该芯片采用挡板-孔结构,可有效捕获并长期共培养宝贵的PDOs和自体免疫细胞,并进行原位荧光观察。
3、芯片还集成了基于微球的免疫荧光检测方法,可同时定量检测多种免疫相关细胞因子。
4、通过对肺癌患者的样本进行测试,实现了PDO细胞凋亡和两种主要免疫相关细胞因子(TNF-α和IFN-γ)的同步定量。
5、本研究首次提供了在免疫介导的杀伤行为和多种免疫相关细胞因子两个层面上定量评估PDOs与自体免疫细胞相互作用的能力,为体外评估患者免疫反应奠定了技术基础。
传统的多孔板方法在定量检测多种细胞因子方面存在以下两个主要技术难题:
1、传统多孔板方法需要足够的细胞因子在培养基中积累以达到检测限的要求,这限制了对细胞因子的准确检测。
2、ELISA和ELI-spot等已建立的方法虽然可以用于检测培养基中的免疫相关细胞因子,但它们需要较长的样品准备时间(>6小时)和较大的样品体积(50μL),这排除了在基于多孔板的PDO-免疫模型中实时动态监测免疫细胞因子变化的可能性。
IOI-Chip通过以下方式解决了上述难题,并提供了对免疫介导的杀伤行为和细胞因子变化的定量评估:
1、IOI-Chip采用挡板-孔结构设计,即使样本量有限,也能确保对PDOs和自体免疫细胞的有效捕获、长期共培养和原位荧光观察。
2、微流控芯片利用基于微珠的免疫荧光检测方法,能够在极低的试剂消耗量(0.5μL)下,同时定量检测多种免疫相关细胞因子,提高了检测的灵敏度和准确性。
3、IOIChip的设计能够在共培养室和细胞因子检测室之间通过阀门控制通道,精确操纵微粒和流体,从而实现对免疫介导的杀伤行为和细胞因子变化的实时监测和定量评估。
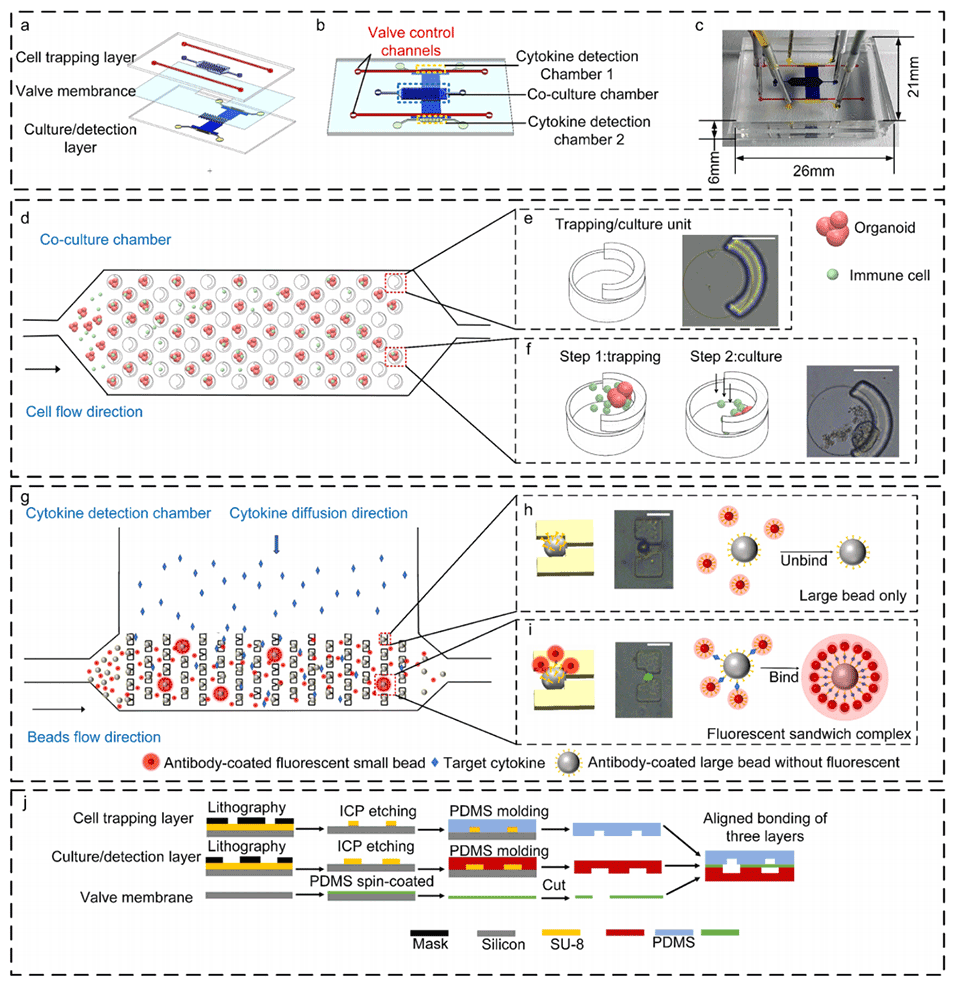
图1.用于评估患者来源的类器官与自体免疫细胞之间相互作用的微流控芯片(IOI-Chip)的示意图。
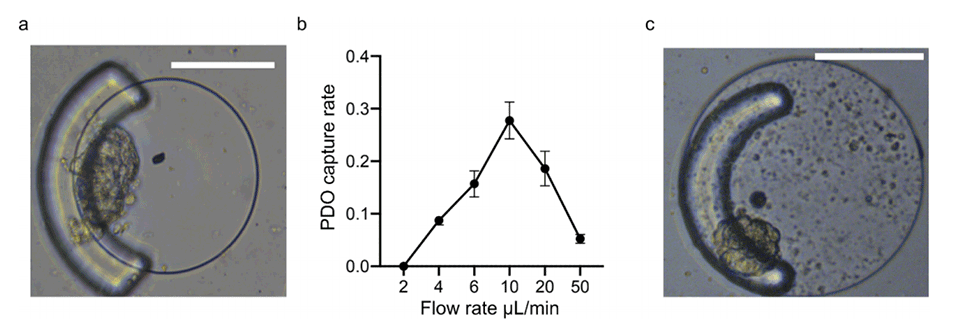
图2.IOI-Chip捕获PDOs/免疫细胞的性能。
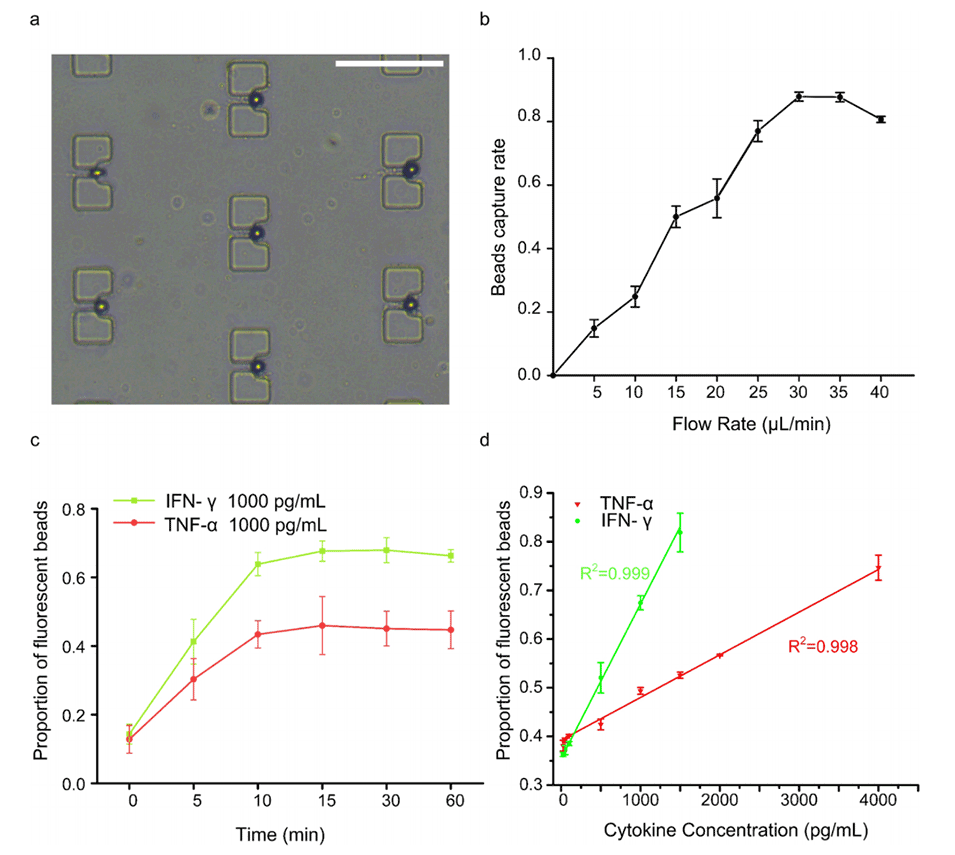
图3.IOI-Chip定量细胞因子的性能。
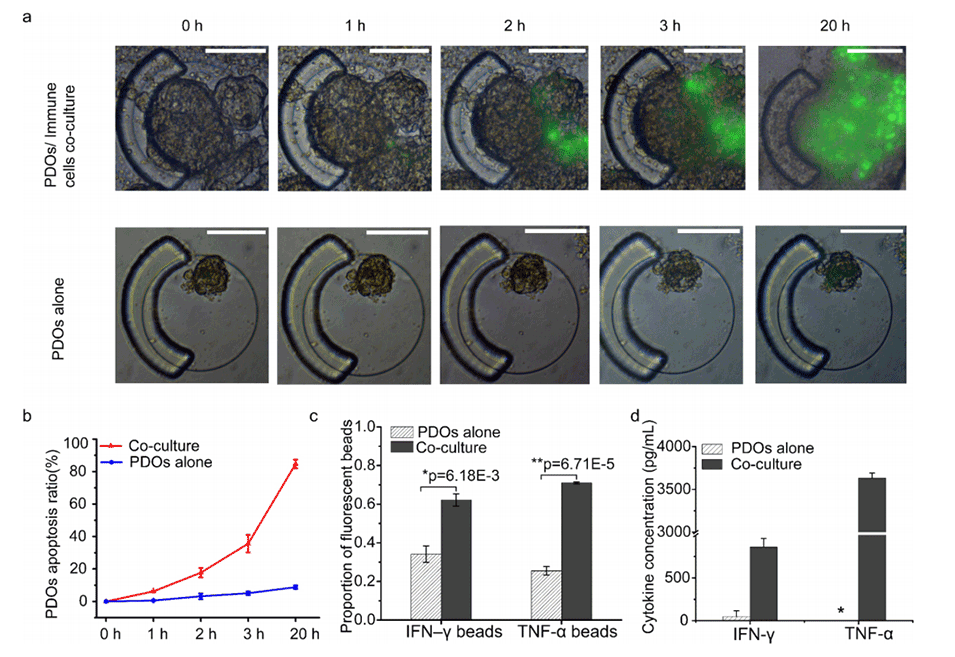
图4.IOI-Chip的临床样本测试。
原文链接:https://doi.org/10.1021/acs.analchem.4c01389














