循环肿瘤细胞(CTC)在癌症早期诊断和疗效监测中发挥着重要作用,是液体活检的重要靶点。然而,由于CTC的极度稀缺以及CTC与白细胞(WBC)的部分尺寸重叠,从血液中分离和检测CTC仍然是一个很大的挑战。

近期,武汉大学化学与分子科学学院胡斌教授团队设计并制造了一种集被动收缩-扩张阵列(CEA)惯性分选区和主动磁分选区于一体的微流控芯片,并与电感耦合等离子体质谱(ICP-MS)在线耦合,用于快速分离和精确检测血液样本中的循环肿瘤细胞(CTCs),在癌症早期诊断和疗效监测方面具有重要应用潜力。相关研究以“An Integrated Inertial-Magnetophoresis Microfluidic Chip Online-Coupled with ICP-MS for Rapid Separation and Precise Detection of Circulating Tumor Cells”为题目,发表在期刊《Analytical Chemistry》上。
本文要点:
1、设计并制造了一种集被动CEA惯性分选区和主动磁分选区于一体的微流控芯片,并与ICP-MS在线耦合,实现了血液样本中MCF-7细胞(作为CTCs模型)的快速分离和精确检测。
2、该集成微流控芯片可快速去除大部分小尺寸白细胞(WBCs),而剩余的磁标记WBCs可在磁场作用下被进一步捕获,从而实现CTCs的高效分离。
3、该集成微流控芯片-ICP-MS在线系统表现出快速(200μL/min)、高回收率(91.6%)、高去除率(99.08%)和高特异性的优异性能。
4、该方法成功应用于实际临床血液样本中CTCs的检测,每1mL血液的分析时间仅需5min,在临床诊断中表现出良好的应用潜力。
5、重要的是,该集成微流控芯片-ICP-MS平台具有良好的可扩展性,可通过替换不同的标记探针,用于检测其他类型的CTCs。
微流控芯片在分离CTCs时,如何确保细胞的活性和完整性?
1、温和的流体动力学设计:通过优化微流控芯片的流体通道,减少对CTCs的剪切应力,避免因流体动力学造成的细胞损伤。
2、表面涂层:在芯片表面涂覆促进细胞存活的材料,如抗粘连蛋白或细胞黏附分子,以减少细胞损伤并保持其活性。
3、适宜的培养环境:在分离过程中提供适宜的温度和pH值,模拟体内的生理条件,以维持CTCs的活性。
4、避免使用有害试剂:在分离过程中避免使用对CTCs有害的试剂,减少化学损伤的风险。
5、快速分离流程:设计高效的分离流程,减少CTCs在芯片中的停留时间,以降低因长时间操作导致的活性下降。
6、实时监控与评估:在分离过程中实施实时监控,并通过活性评估(如活细胞/死细胞染色)确保CTCs的活性和完整性。
对于不同癌症类型的CTCs检测,该集成微流控芯片-ICP-MS平台是否需要进行特定的优化或调整?
1、生物标志物选择:不同类型的癌症可能表达不同的细胞表面标志物,因此需要根据目标癌症类型选择合适的生物标志物进行特异性捕获。
2、抗体优化:针对不同癌症类型的CTCs,所使用的抗体(如针对EpCAM的抗体)可能需要进行优化,以提高其结合效率和特异性。
3、分离条件调整:不同癌症类型的CTCs在大小、形状和物理特性上可能存在差异,因此需要调整微流控平台的分离条件(如流速、压力等)以优化分离效果。
4、细胞培养和处理:不同癌症类型的CTCs在体外培养和处理时可能需要不同的培养基和处理条件,以保持其活性和特性。
5、检测灵敏度:针对某些低丰度的CTCs,可能需要提高检测灵敏度,例如通过增强信号放大技术或改进检测方法(如使用更灵敏的质谱技术)。
6、样本预处理:不同癌症类型的血液样本可能需要不同的预处理步骤,如红细胞去除、白细胞富集等,以提高CTCs的检测效率。
7、数据分析方法:不同癌症类型的CTCs可能具有不同的生物学特征,因此需要针对性的数据分析方法,以准确解读检测结果和生物学意义。
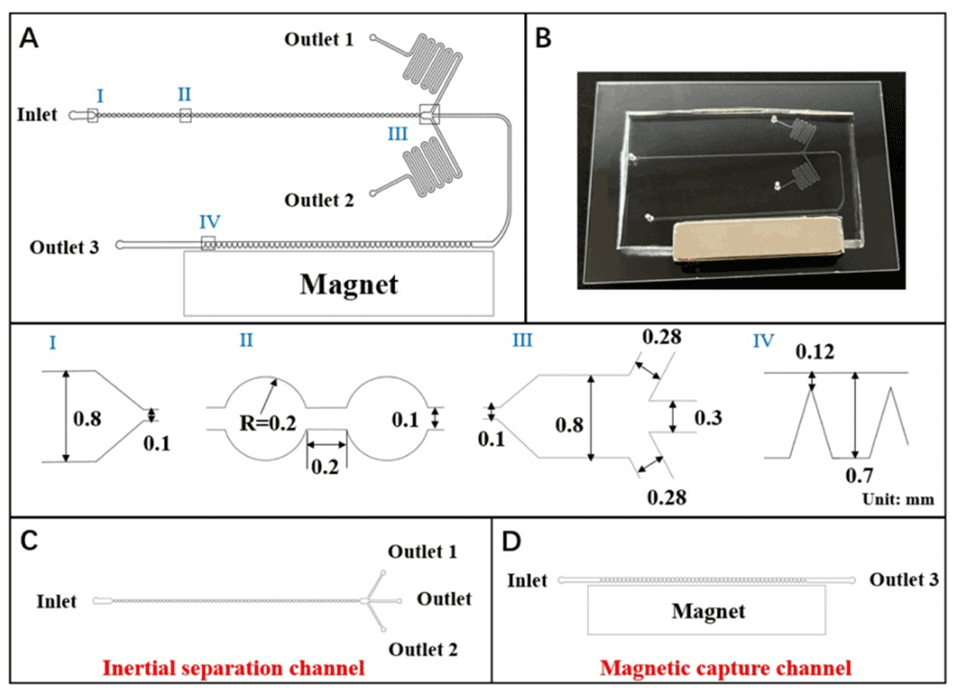
图1.芯片示意图和尺寸。
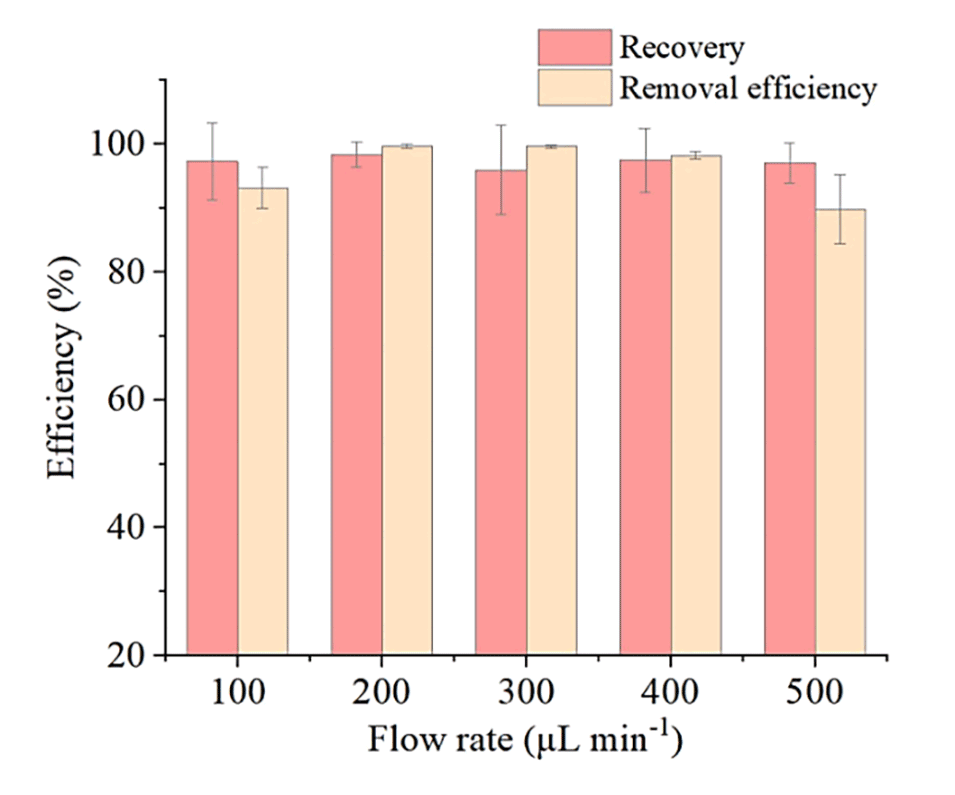
图2.不同流速下惯性芯片对PS微球的分离性能(误差条表示三次分析的标准偏差)。
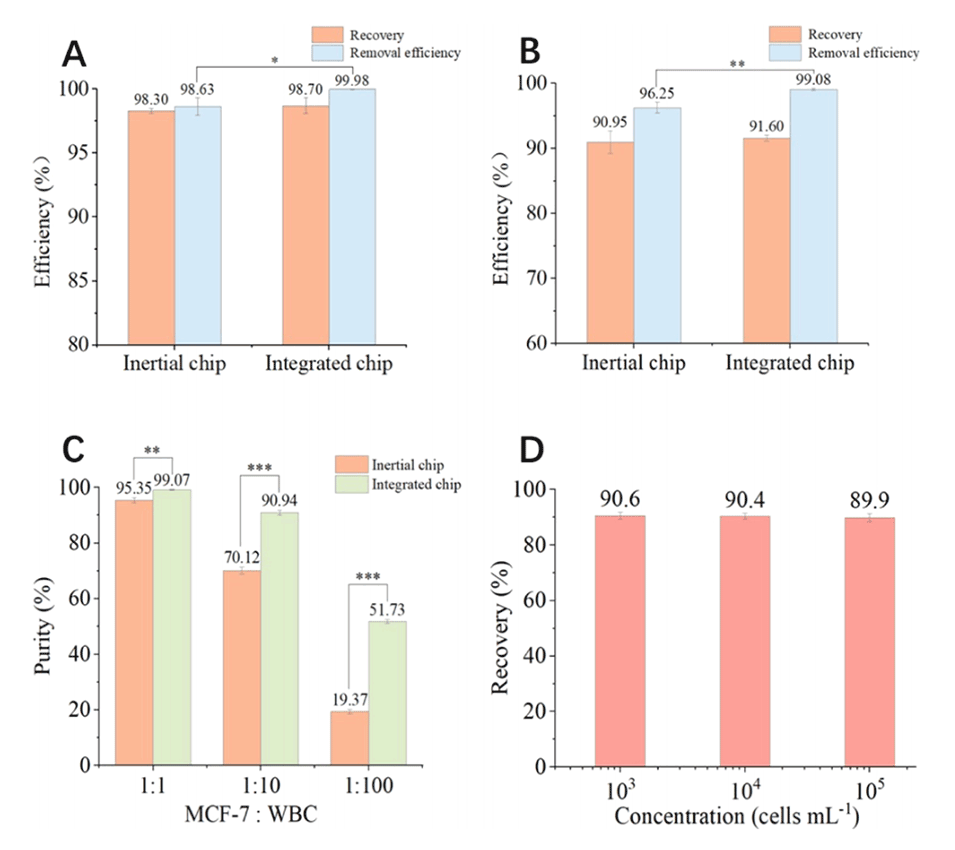
图3.惯性芯片和集成芯片对(A)PS微球和(B)细胞的分离性能比较;(C)惯性芯片和集成芯片对MCF-7细胞的纯度比较;(D)集成芯片对不同浓度MCF-7细胞的回收率。(误差条表示三次分析的标准偏差,*p≤0.05,**p≤0.01,***p≤0.001。)
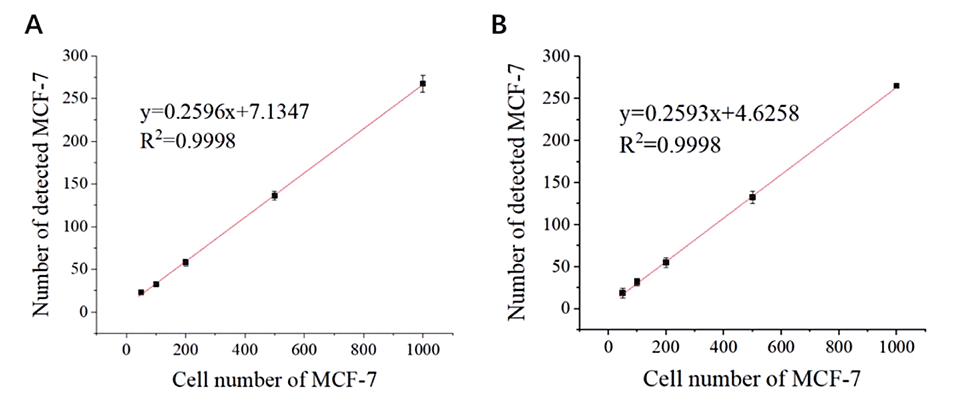
图4.检测到的MCF-7细胞数量与(A)PBS和(B)模拟血液样本中添加的MCF-7细胞数量之间的关系(误差条表示三次分析的标准偏差)。
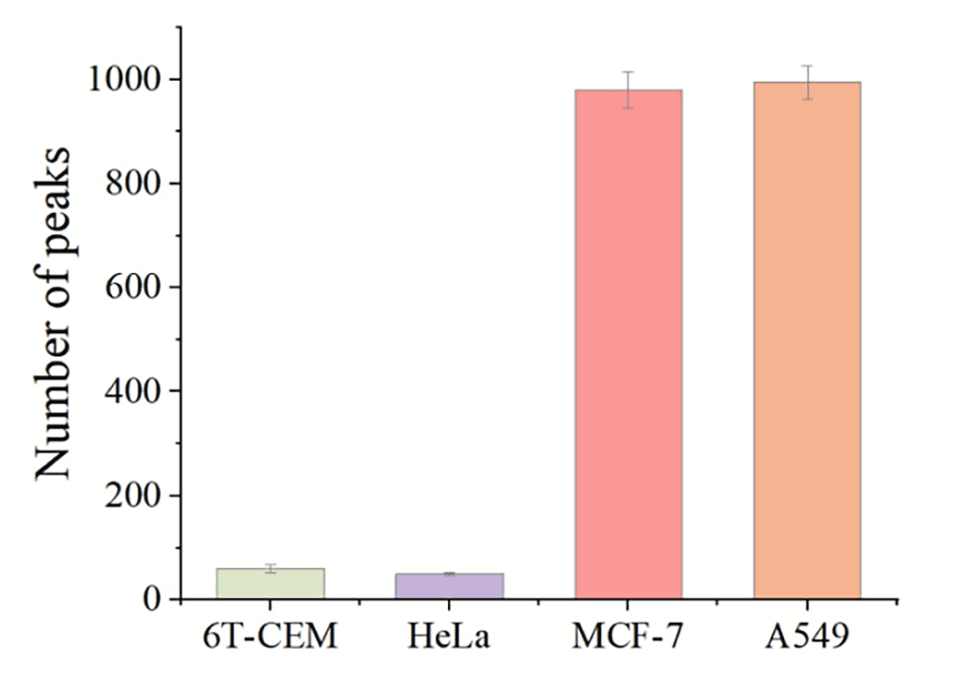
图5.在不同细胞系中检测到的峰数(误差条表示三次分析的标准偏差)。
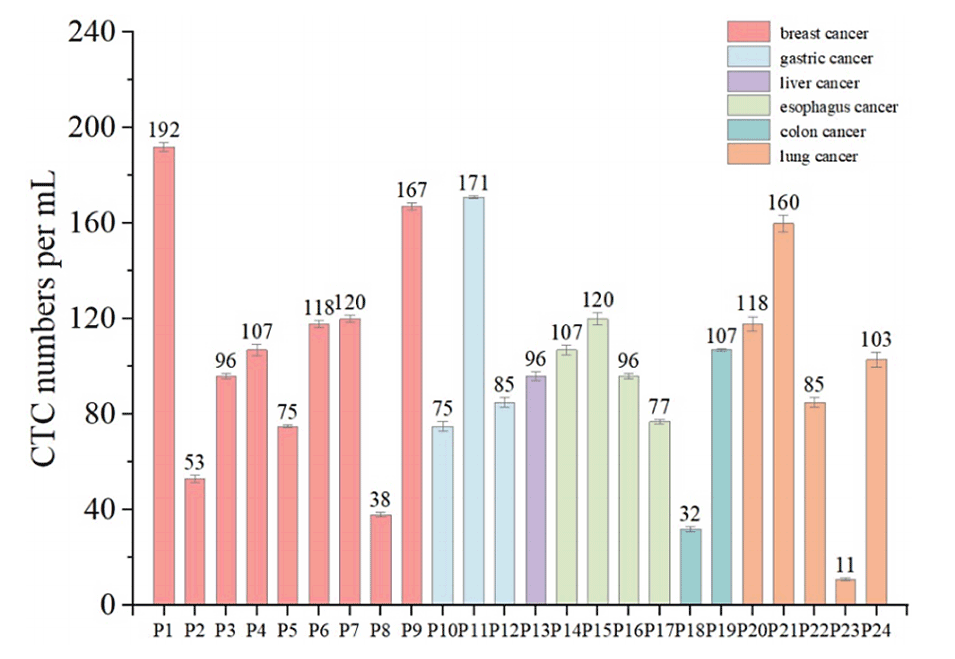
图6.不同类型癌症患者CTCs的定量结果(误差条表示三次分析的标准偏差)。
原文链接:https://doi.org/10.1021/acs.analchem.4c02876














