癌症是全球健康的重要挑战,早期检测对于改善治疗效果至关重要。癌胚抗原(CEA)作为一种重要的肿瘤标志物,在多种癌症的诊断和监测中具有重要意义。传统的检测方法存在灵敏度不足和操作复杂等问题,因此迫切需要开发快速、敏感的检测技术。化学发光免疫分析(CLIA)因其高灵敏度和简便性而受到广泛关注,但现有方法在信号强度和持续性方面仍存在挑战。

近期,济南大学魏琴教授、高中锋教授、马洪敏教授团队利用微流控技术合成了多级结构的化学发光纳米颗粒,并将其应用于化学发光免疫传感器的开发,以实现对肿瘤标志物CEA的高效、灵敏检测。相关研究以“Multi-level structured nanoparticles prepared by microfluidics control method for efficient and sensitive chemiluminescence immunoassay”为题目,发表在期刊《Journal of Colloid and Interface Science》上。
本文要点:
1、通过血红素(hematin)修饰合成了两亲性分子HP(Hematin@NH2-PEG-COOH),利用微流体技术将鲁米诺包封在HP分子内,从而形成高效的化学发光(CL)HPL(HP@Luminol)纳米颗粒。
2、在封装过程中获得的尺寸效应和复杂的多级结构赋予了纳米颗粒增强的催化CL能力。
3、以HPL纳米颗粒作为发光标记物,成功构建了一种CL免疫传感器,用于对肿瘤标志物CEA的灵敏检测。该传感器检测范围为0.001-100 ng/mL,检测限为0.32 pg/mL,具有良好的特异性和稳定性。
4、该研究不仅拓展了纳米材料的设计与合成策略,还为生物标记物的灵敏检测提供了一种实用的解决方案,展现了微流控技术在纳米科学和生物传感领域的应用潜力。
HPL纳米粒子是如何通过微流控技术制备的?
首先,合成了两亲分子HP(Hematin@NH2-PEG-COOH),然后利用微流控芯片精确控制三种物质——HP、鲁米诺和超纯水的流速,将它们泵入微流控芯片中。HP溶液的流速为10 μL·min-1,鲁米诺溶液的流速为5 μL·min-1,超纯水的流速为50 μL·min-1。
在微流控芯片中,由于流速的差异,HP分子和鲁米诺分子在水溶液中相遇并自组装,HP分子的亲水端NH2-PEG-COOH形成外壳,包裹鲁米诺分子,最终形成具有多级结构的HPL纳米粒子。制备完成后,通过透析去除多余的DMSO和一些试剂,得到最终的HPL纳米粒子。
微流体技术在纳米颗粒合成中的优势主要体现在以下几个方面:
1、精确控制:微流体技术能够精确调节微通道内的流体速度和混合比例,从而实现对纳米颗粒形态和结构的精确控制。这种微观层面的操控有助于获得所需的纳米颗粒特性。
2、自组装能力:利用自组装原理,微流体技术可以在微观尺度上促进不同组分的有效结合,形成多级结构的纳米颗粒,增强其催化能力和功能性。
3、提高反应效率:微流体系统的小体积和高表面积使得反应物能够更快地混合和反应,从而提高合成效率和产率。
4、可重复性和一致性:微流体技术的高度集成化和自动化特性使得每次实验的条件更加一致,从而提高了合成过程的可重复性。
5、多功能性:微流体技术可以同时处理多种反应物,便于合成具有多种功能的纳米颗粒,拓展了纳米材料的应用范围。
综上所述,微流体技术为纳米颗粒的设计与合成提供了新的思路和方法,具有广泛的应用前景。
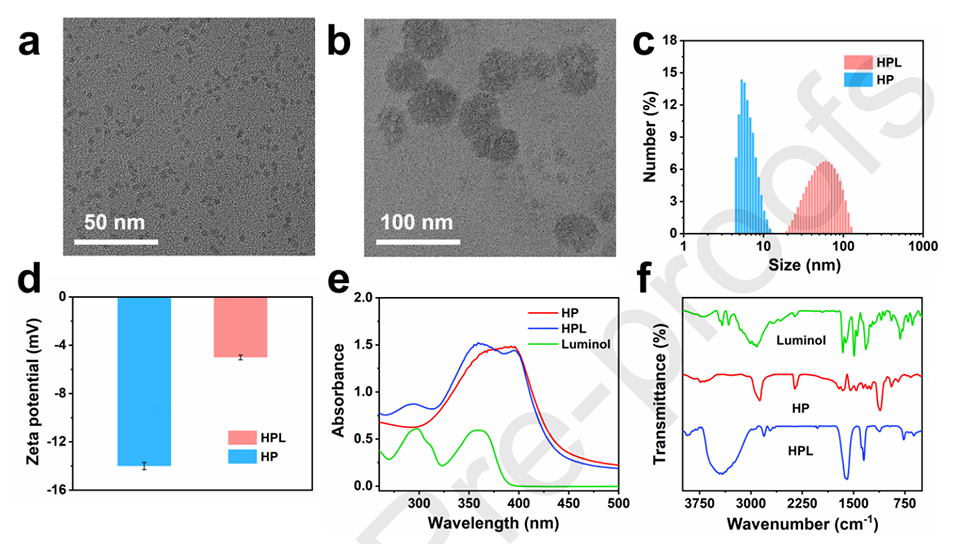
图1.(a)HP的透射电子显微镜(TEM)图像;(b)HPL的TEM图像;(c)HP和HPL的动态光散射(DLS);(d)HP和HPL的ζ-电位测量;(e)HP、鲁米诺和HPL的紫外-可见吸收光谱;(f)HP、鲁米诺和HPL的红外光谱。
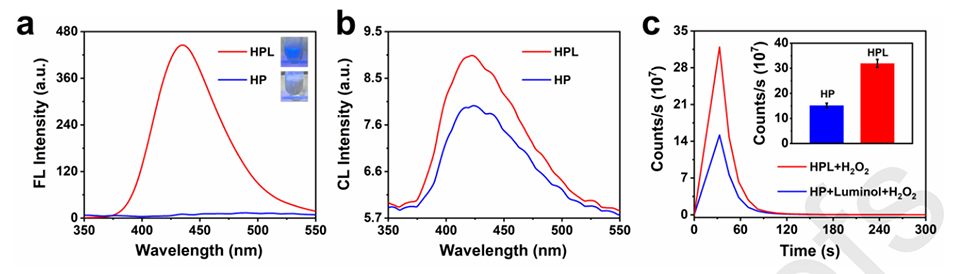
图2.(a)HP和HPL的荧光光谱(λex=340)以及紫外线照射后的图像;(b)HP和HPL与H2O2的CL光谱;(c)通过测试HP和HPL获得的CL动力学曲线。插图:进行了几次测试来测量HP和HPL的CL信号强度。(n=10)。
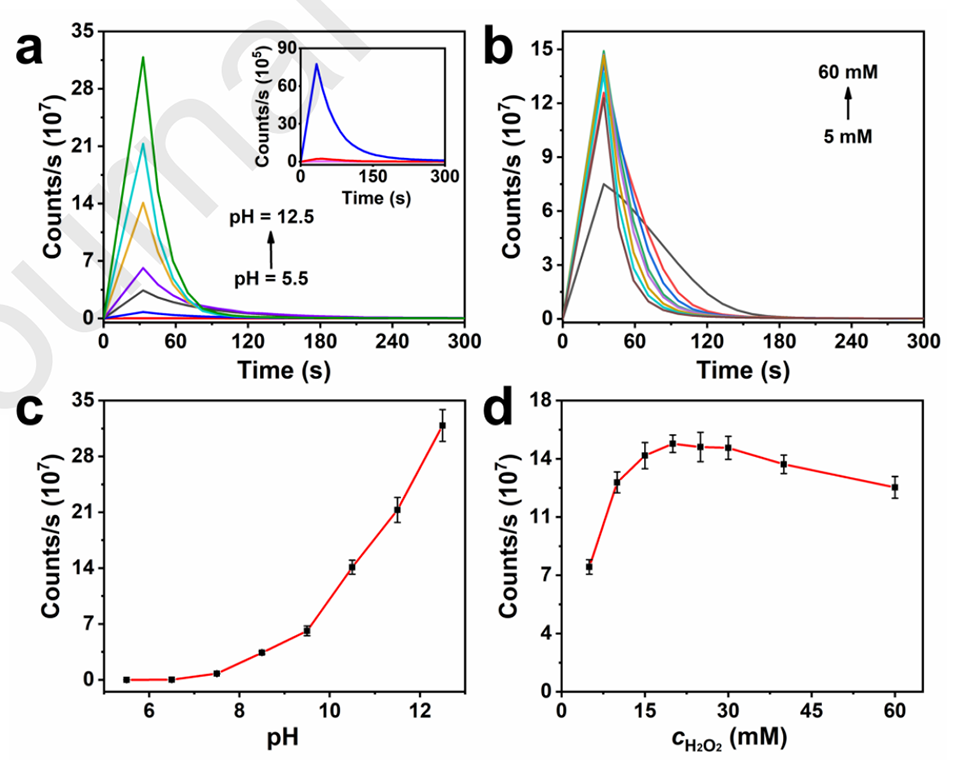
图3.优化测试条件(a,c)pH值:5.5、6.5、7.5、8.5、9.5、10.5、11.5、12.5;(b,d)H2O2浓度:5、10、15、20、25、30、40、60(mM)(n=3)。
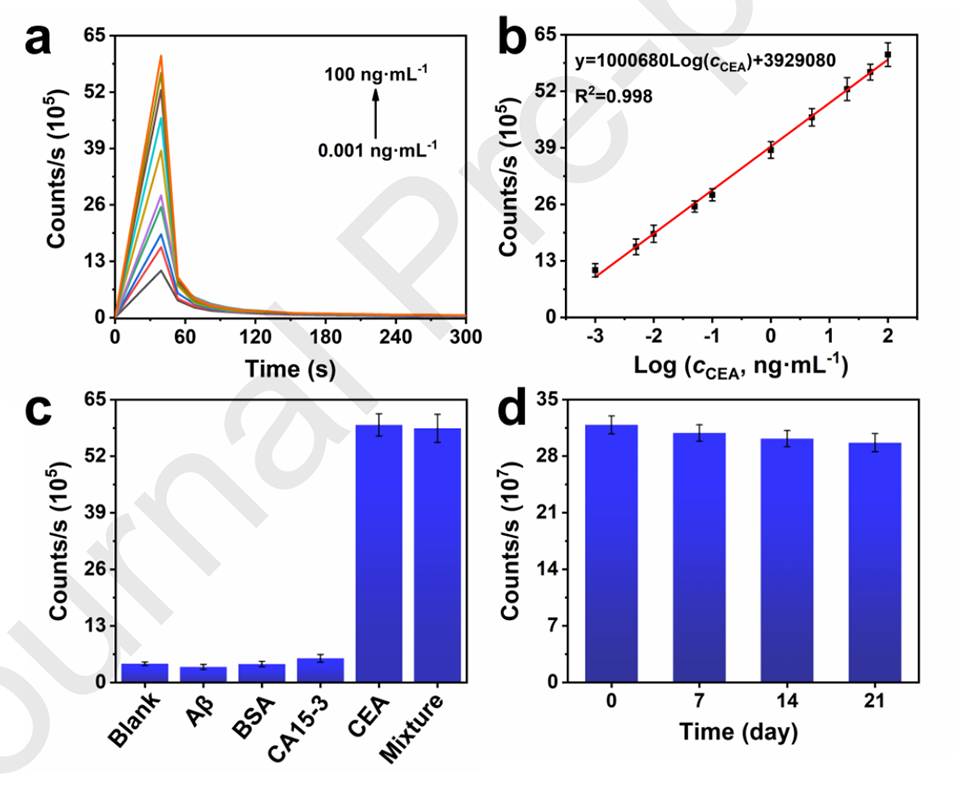
图4.(a)在pH=12.5和20mM的H2O2浓度下,使用构建的CL免疫传感器对不同浓度的CEA进行CL动力学测试;(b)CL信号与CEA浓度的对数呈线性关系;(c)对构建的CL免疫传感器进行了特异性测试;(d)对构建的CL免疫传感器进行稳定性测试(n=3)。
论文链接:https://doi.org/10.1016/j.jcis.2024.10.163














