
导读:
从异质样品中分选特定细胞对于研究和临床应用十分重要。近期,北京理工大学张帅龙课题组与中国科学院苏州生物医学工程技术研究所马汉彬课题组合作,提出了一种将深度学习图像识别与微流体操作相结合的新型无标签细胞分选方法,并利用HeLa细胞和聚苯乙烯珠对该方法进行了性能评估,获得了较高的分选精度和纯度。相关研究以“Deep Learning-Assisted Label-Free Parallel Cell Sorting with Digital Microfluidics”为题目发表于期刊《Advanced Science》。
本文要点:
1、本研究提出了一种新的无标记细胞分选方法,该方法将深度学习图像识别与微流体操作相结合,以根据形态区分细胞。
2、利用有源矩阵数字微流控(AM-DMF)平台,YOLOv8目标检测模型可确保精确的液滴分类,安全间隔路径规划算法管理多目标、无碰撞的液滴路径规划。
3、通过模拟和实验发现,检测模型精度、浓度比和分选周期显著影响回收率和纯度。以HeLa细胞和聚苯乙烯珠为样本,该方法实现了98.5%的分选精度、96.49%的纯度和80%的回收率。
4、此外,该方法还可用于从红细胞中分选HeLa细胞、从白细胞中分选癌细胞,以及区分白细胞亚型。
5、使用这种方法分选的细胞可以直接在芯片上裂解,确保样本损失最小,适用于下游生物分析。
6、总体而言,这种创新的AM-DMF细胞分选技术在推进细胞生物学诊断、治疗和基础研究方面具有巨大潜力。
本研究提出了一种基于深度学习图像识别和数字微流控技术的无标签细胞分选方法。与传统的细胞分选技术相比,该方法具有以下主要优势:
1、无需标记细胞,避免了对细胞活性和生理状态的影响,适用于后续的单细胞组学分析等应用。
2、集成了高精度的YOLOv8目标检测模型,可以准确识别和分选不同类型的细胞,分选纯度高达96.49%。
3、采用安全间隔路径规划算法实现了多目标、无碰撞的细胞分选,提高了分选效率。
4、通过在迭代分选循环中引入新鲜液滴,该方法可以达到80%以上的高回收率,满足稀有细胞分选的需求。
5、该方法集成了细胞分选和裂解等操作,为单细胞组学分析等应用提供了一体化的解决方案,最大限度减少了样品损失。
总之,该创新性的细胞分选技术具有无标签、高纯度和高回收率等显著优势,为细胞生物学诊断、治疗和基础研究带来了重大突破。
细胞分选的主要流程如下:
1、样品注入与液滴分裂:将细胞样品注入到AM-DMF芯片上,利用“一分为二”的液滴分裂技术,将样品分散成8×8的液滴阵列。
2、图像采集与细胞分类:通过10倍物镜对液滴阵列进行成像,捕获液滴中的细胞图像,并利用训练好的YOLOv8目标检测模型对液滴中的细胞进行分类。
3、液滴路径规划与分选:根据细胞分类结果,采用安全间隔路径规划(SIPP)算法对液滴进行路径规划,实现芯片上的无碰撞细胞分选。
4、液滴补充与回收:通过周期性地补充新的空液滴,降低目标细胞在液滴中的浓度,从而提高目标细胞的回收率。经过多次迭代分选,可以达到80%以上的回收率。
5、细胞裂解处理:将分选得到的目标细胞液滴与裂解缓冲液液滴合并,并对合并后的液滴进行循环往复操作,促进细胞内容物与裂解缓冲液的充分混合,从而实现细胞的裂解处理。
这种集成了深度学习图像识别和数字微流控技术的细胞分选方法,可以实现高精度、高纯度的无标签细胞分选,并进一步进行细胞裂解处理,为单细胞组学研究提供了一体化的解决方案。
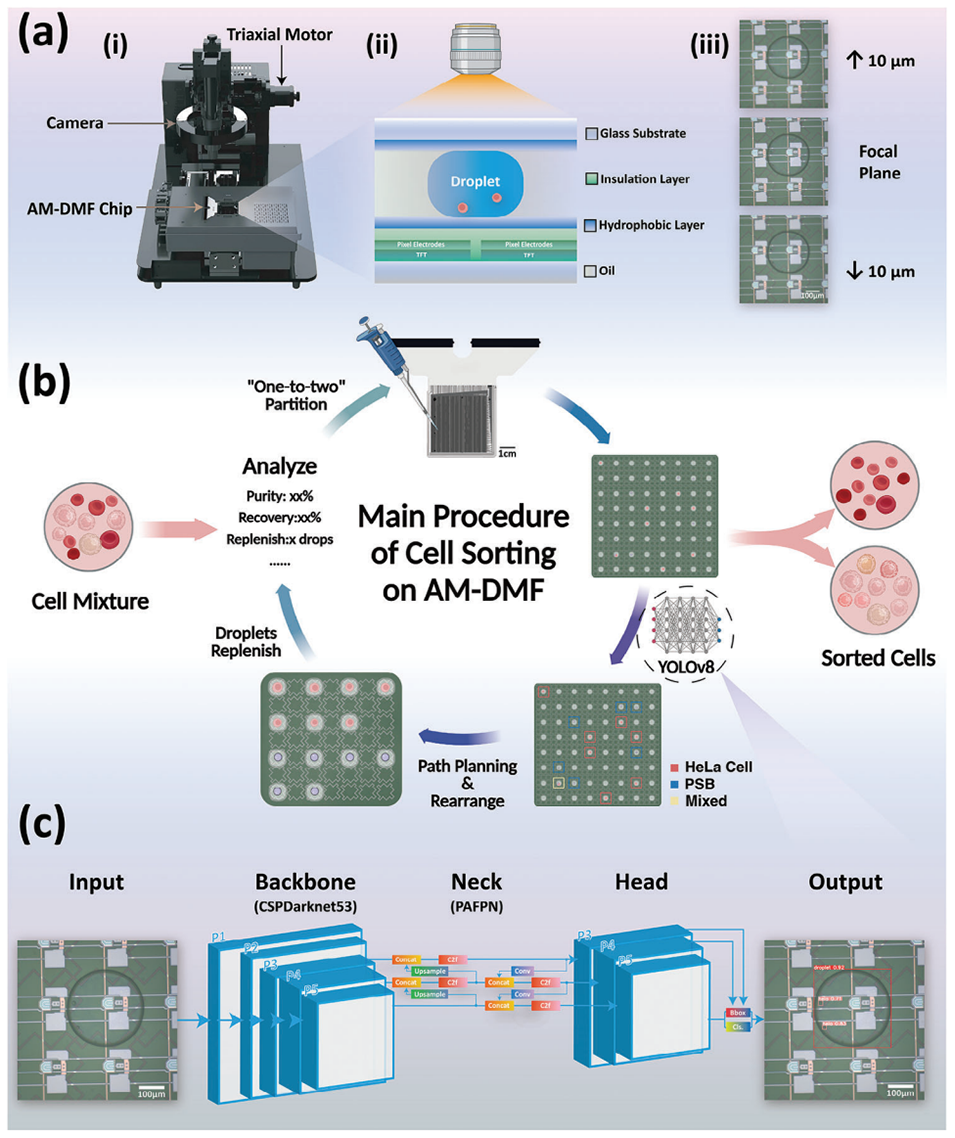
图1.AM-DMF上的细胞分选图示。
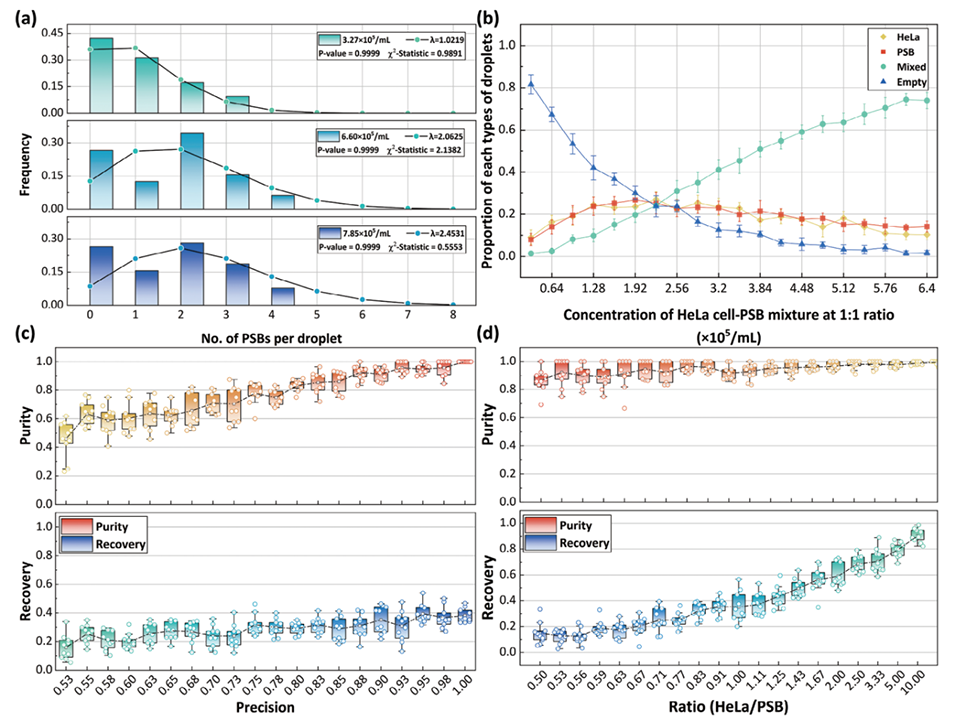
图2.精度和目标细胞与背景细胞的比例对纯度和回收率的影响。
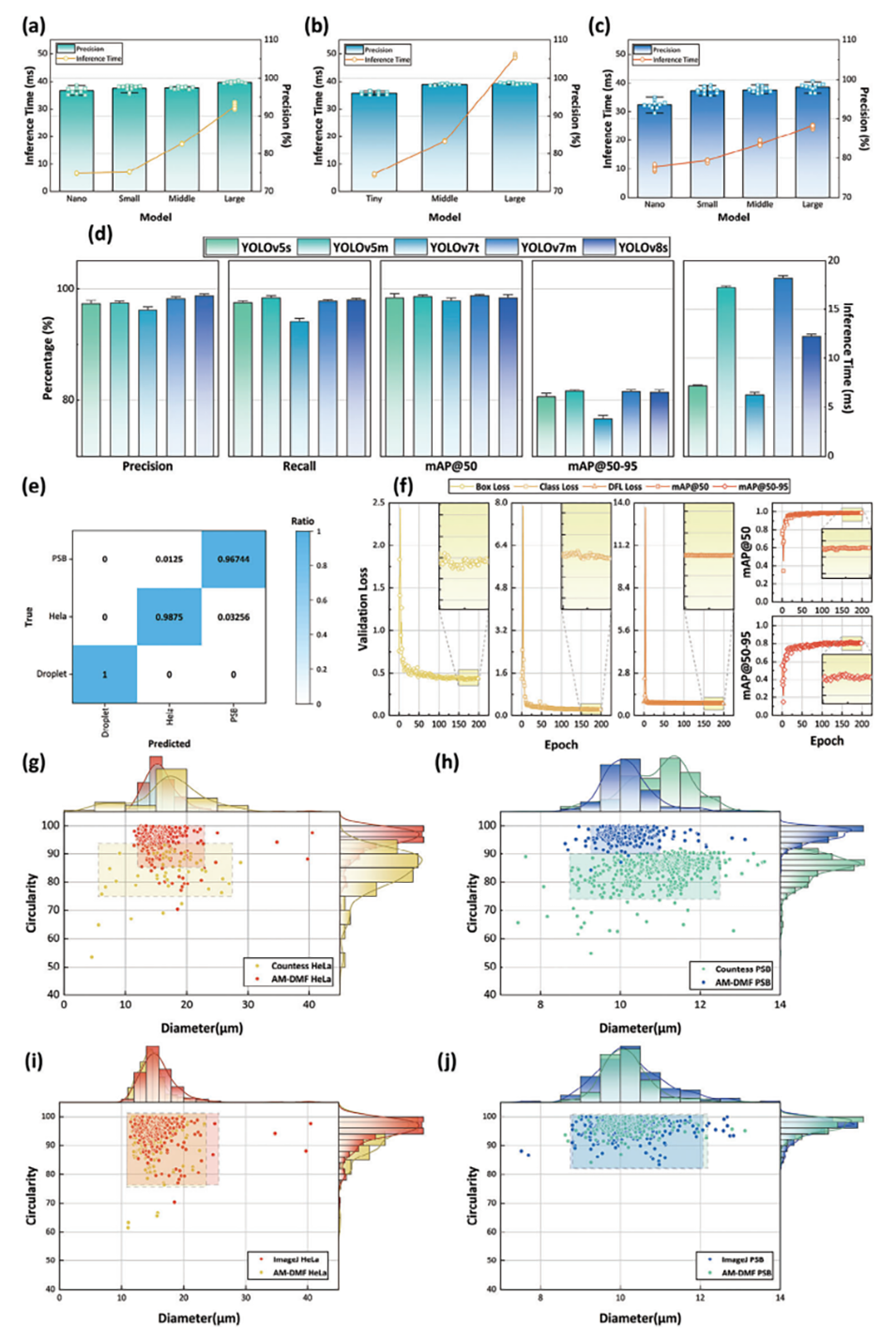
图3.模型训练评估。
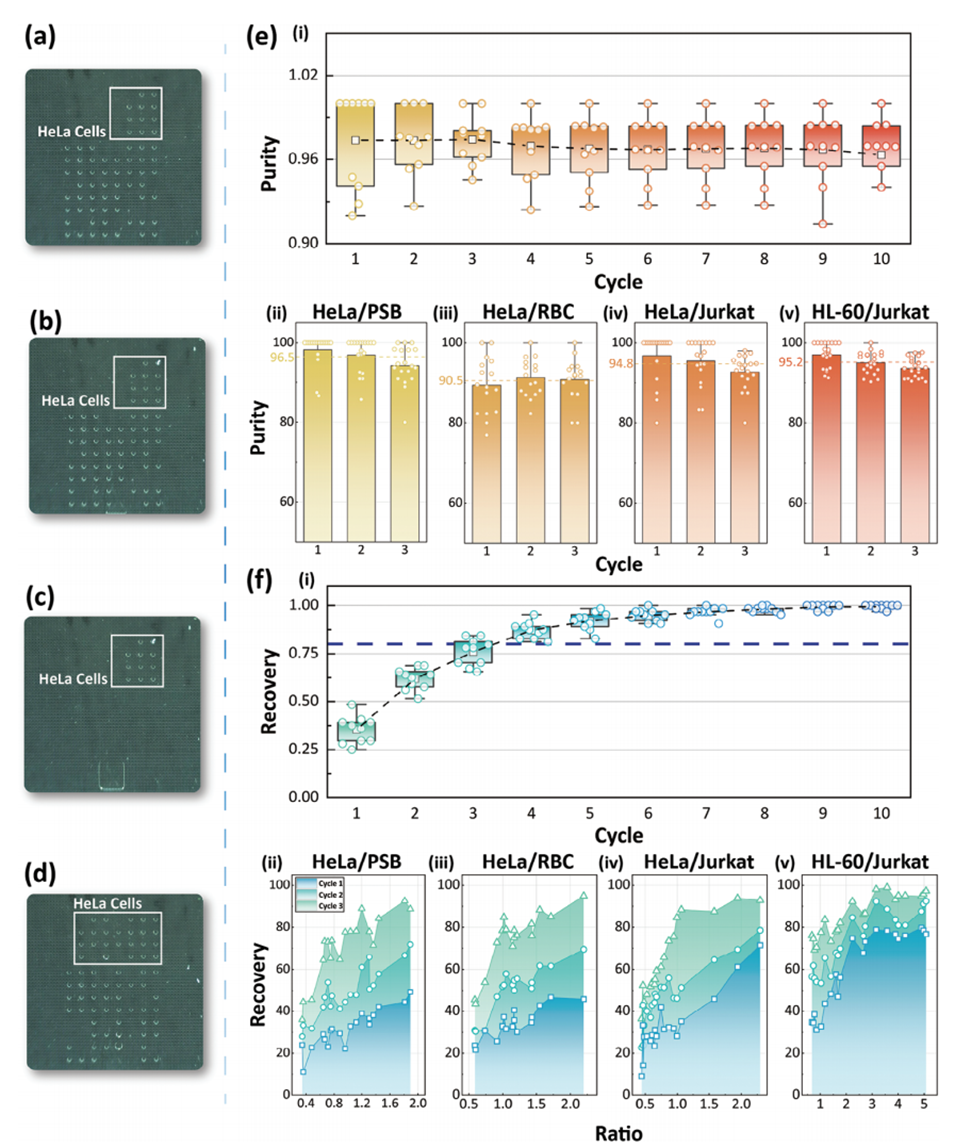
图4.分选周期数对细胞分选结果的影响。

图5.片上细胞裂解处理。
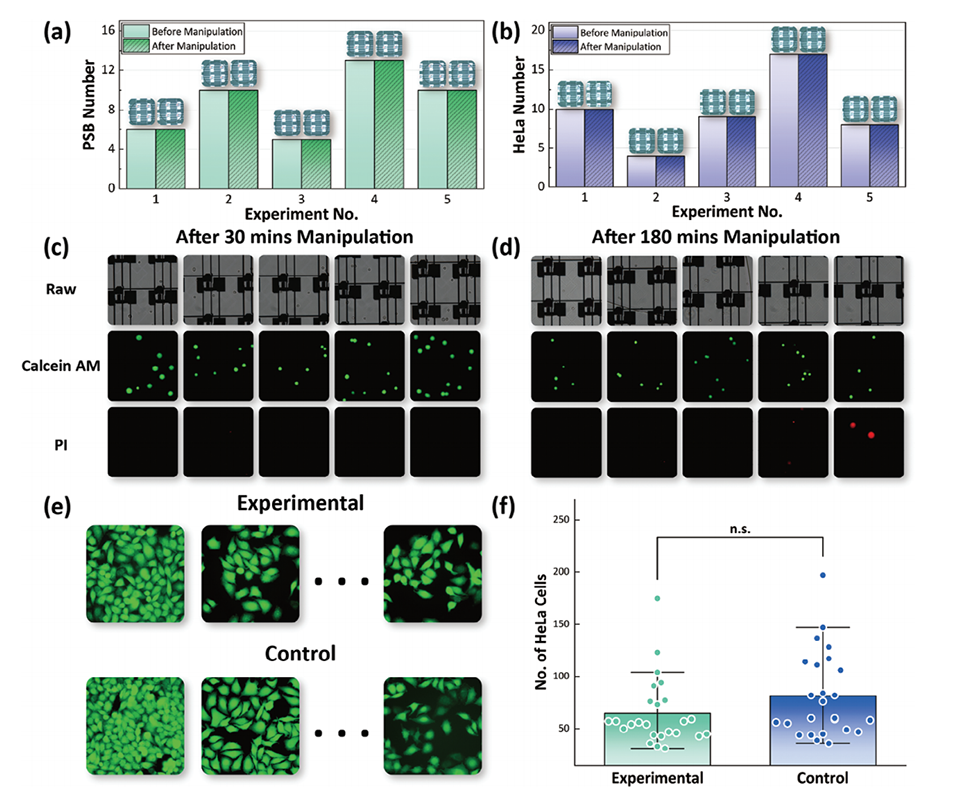
图6.片上和片外评估AM-DMF操作对细胞数量损失和活力的影响。
论文链接:https://doi.org/10.1002/advs.202408353














