为在不改变肿瘤干细胞样细胞(TSC)生物学特性的前提下深化其研究,单细胞来源肿瘤球(STS)成为重要模型。TSCs受其周围微环境的调节,因此模拟肿瘤微环境对于促进STS的形成至关重要。近年来,源自肿瘤微环境的外泌体已成为模拟肿瘤微环境的一种有前途的方法。在肿瘤微环境中,各种相关细胞(如成纤维细胞、内皮细胞和免疫细胞)发挥着关键作用。利用这些细胞来源的外泌体能够有效模拟肿瘤微环境,并促进STS的形成。

近期,西安医学院庞龙博士、李雪萍教授、范江霖教授等人合作开发了一种集成微流控系统,通过混合HUVEC和NIH/3T3细胞来源的外泌体生成浓度梯度,显著促进了单细胞来源肿瘤球体的形成率和大小,并验证了纳米药物(如PLGA-DOX)相较于传统化疗药物能更有效降低肿瘤干细胞样细胞的耐药性,尤其对小而高变形能力的细胞效果更优。相关研究以“An Integrating Microfluidic System for Concentration Gradient Generation of Exosomes and Exosome-Assisted Single-Cell-Derived Tumor-Sphere Formation”为题目,发表在期刊《ACS Sensors》上。
本文要点:
1、本研究开发了一种集成微流控平台,包含外泌体浓度梯度生成器(ECG)和单细胞球体形成陷阱阵列(SFTA),用于评估多种外泌体对STS形成的影响。
2、ECG模块通过紧凑的“中国回纹”混合器生成HUVEC和NIH/3T3细胞来源外泌体的连续浓度梯度,SFTA模块则用于捕获单细胞并观察STS形成。
3、实验表明,混合外泌体比单一来源外泌体更能提升STS的形成率和尺寸,且小尺寸/高变形性TSC对混合外泌体更敏感。
4、进一步研究发现,负载阿霉素的PLGA纳米颗粒(PLGA-DOX)较游离药物显著降低TSC耐药性,尤其对小/高变形性TSC效果更佳。
5、该平台为STS研究及肿瘤微环境模拟提供了新策略,并为纳米药物评估提供了高效工具。
该集成微流控系统的工作原理基于两个核心功能模块:外泌体浓度梯度生成模块(ECG)和单细胞来源球体形成捕获阵列模块(SFTA)。以下是其详细运行过程:
1.外泌体浓度梯度生成模块(ECG)
混合与稀释:
ECG模块采用紧凑的“中式回纹图案”(CMP)混合器,通过其中心螺旋流道和离心力作用生成二次流。
这一模块利用5级稀释设计,逐步引入多个CMP混合器:初始稀释使用三组并联CMP混合器,后续稀释中每级增加更多混合器,在最后一级共有7个CMP混合器。
最终,该模块从两个入口注入两种不同来源的外泌体,通过混合和稀释生成7种不同浓度的外泌体梯度,从7个出口释放。
输出连接:
每个出口通过管道连接至下游的SFTA模块,用于单细胞来源球体(STS)形成实验。
2.单细胞来源球体形成捕获阵列模块(SFTA)
单细胞捕获与分离:
SFTA模块基于“多重微结构障碍滤网”(MMOF)矩阵,按照细胞的大小和变形性将单细胞分离和捕获。
MMOF矩阵分为5组滤网(G1、G2),每组中间隙逐步缩小(如G1为16-8 μm,G2为14-6 μm),形成捕获单元。
同时引入圆柱形微孔(microwells)为捕获的单细胞提供培养环境。标准SFTA平台可容纳1365个捕获单元。
操作步骤:
注入:通过入口注入细胞悬液,并依次注入外泌体等相关试剂;
捕获:细胞在微结构阵列中被捕获,基于流速高效分离单细胞;
芯片翻转:捕获的单细胞被转移至圆柱形微孔用于STS培养;
外泌体作用:通过连接的ECG模块持续递送不同外泌体梯度溶液,诱导STS生成;
再注入:注入试剂以开展进一步实验(如药物筛选)。
结果输出:
评估STS的形成速率、球体大小和药物敏感性。此外,通过优化流速(如75 μL/min)和细胞密度(如3000细胞/mL),该平台实现了高效单细胞分离(捕获效率>82%)且细胞活性保持>90%。
3.整体功能集成
ECG模块生成梯度外泌体后,无缝连接至SFTA模块,以实现单细胞捕获及其在外泌体作用下的肿瘤球实验。
该系统通过自动化与高通量设计,为研究肿瘤干样细胞(TSC)的生物特性、外泌体影响及纳米药物疗效提供了创新工具。
总体而言,该微流控平台通过精确生成浓度梯度和高效捕获单细胞,为模拟肿瘤微环境及研究肿瘤干细胞药物响应提供了一种高度集成的系统化方法。
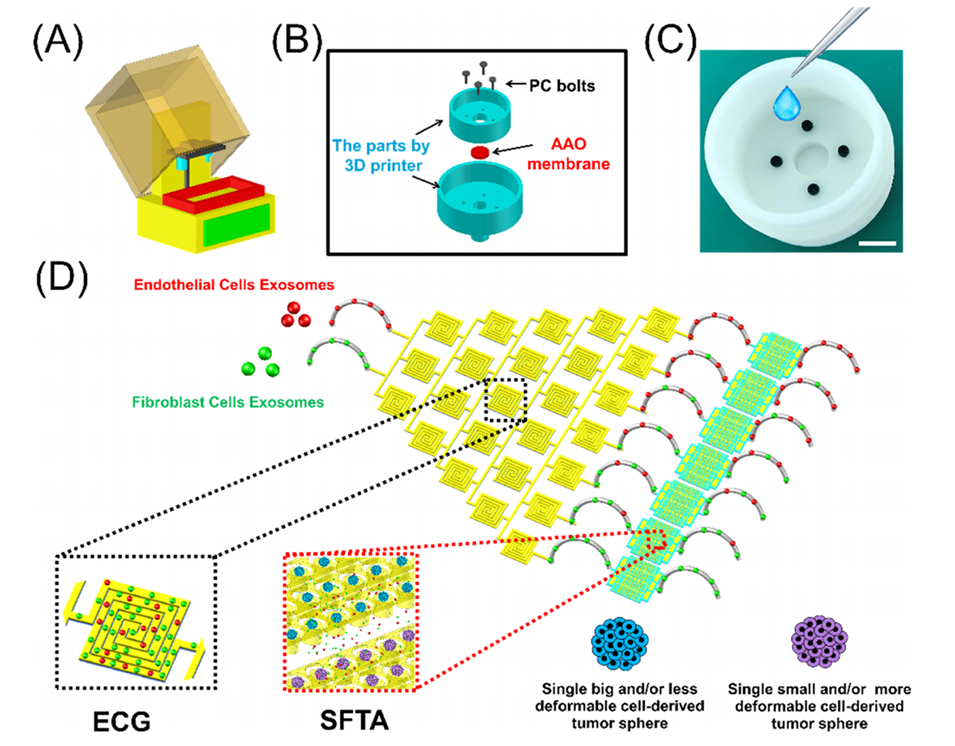
图1.集成微流控平台实现了两种不同类型外泌体的浓度梯度生成,并用于评估外泌体辅助的单细胞来源肿瘤球(STS)形成。
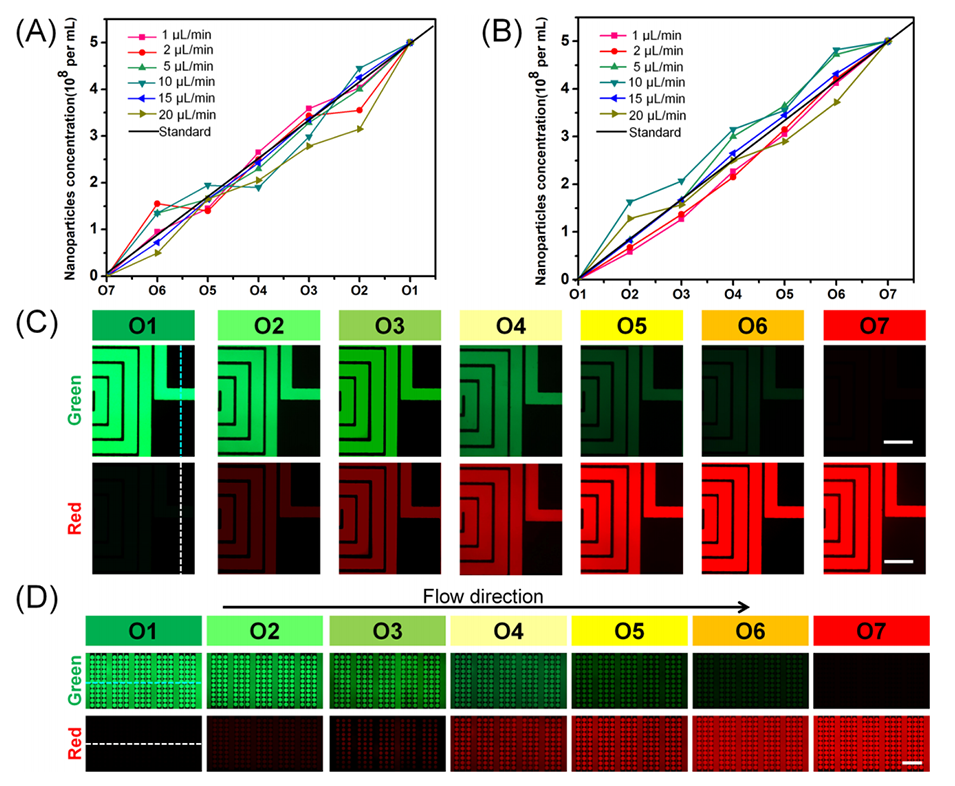
图2.微流控平台上梯度稀释模块的性能验证。
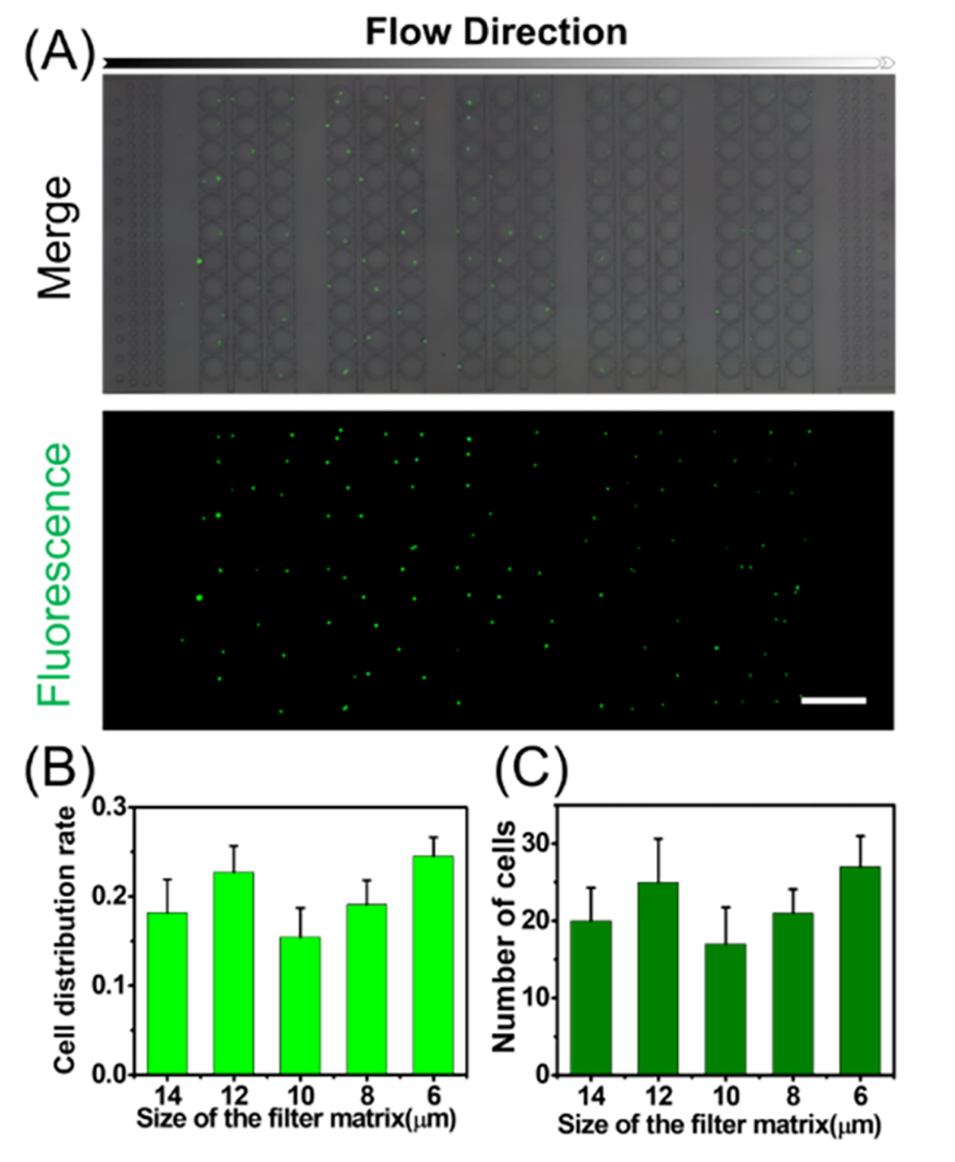
图3.在75 μL/min流速和3000 cells/mL的细胞密度下,MMOF矩阵中单细胞阵列的实验结果。
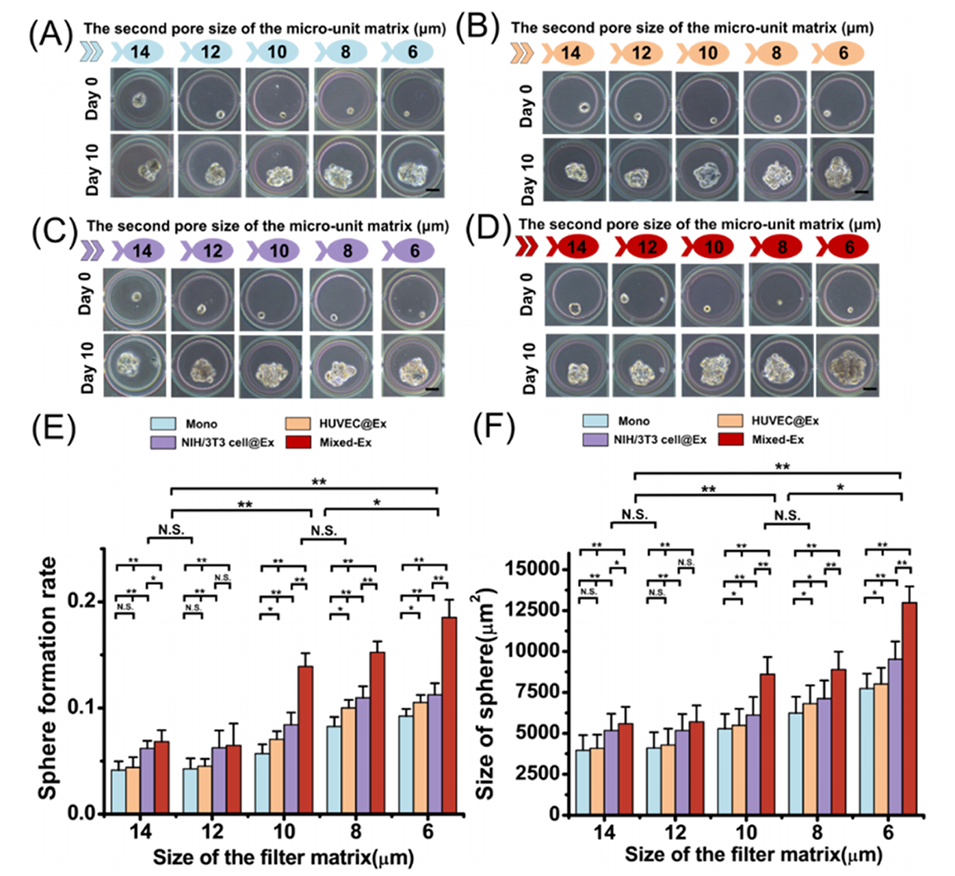
图4.在单培养和与提取的外泌体共培养中,在由单个原代胶质母细胞瘤细胞启动的腔室中观察到球体形成率和球体大小。本文展示了源自单一原发性胶质母细胞瘤的STSs图像。
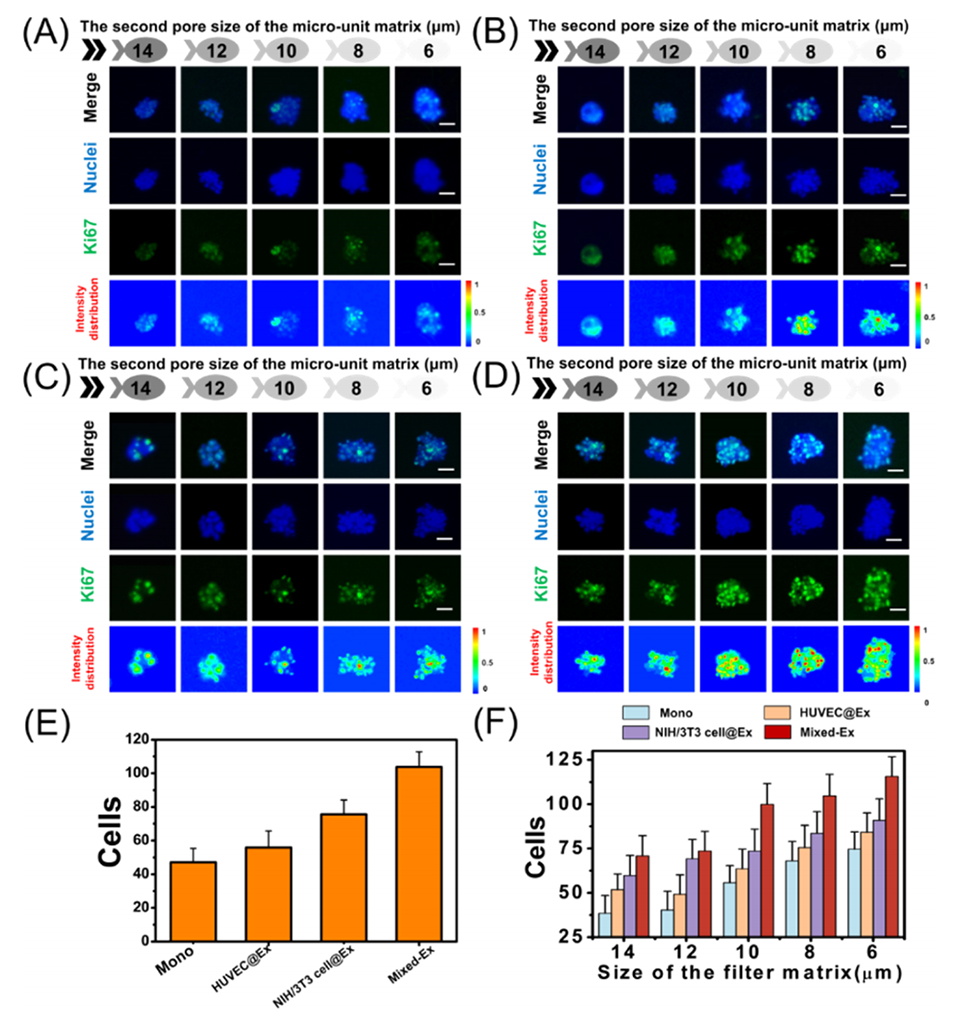
图5.在培养10天后,STS细胞的Ki67(绿色)和细胞核(蓝色)染色的荧光图像。
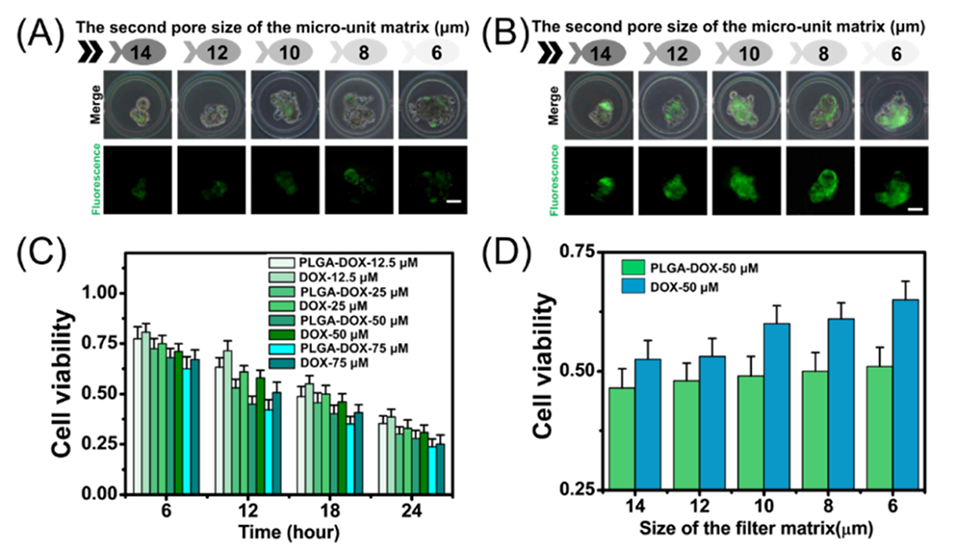
图6.(A,B)经50μM游离DOX或PLGA-DOX NPs处理,然后孵育12小时的STSs的共聚焦荧光显微镜图像(比例尺:50μM)。(C)在不同孵育时间下评估用不同浓度(即12.5、25、50和75μM)的游离DOX和PLGA-DOX NPs处理的STSs的细胞存活率。(D)经50μM游离DOX处理或PLGA-DOX NPs处理,然后孵育12小时,不同微单元矩阵中STSs的细胞存活率。标准偏差来自五个重复实验。
论文链接:https://doi.org/10.1021/acssensors.4c01542














