血管周围-骨内膜多微环境(PVM-EM)的3D模型对于研究早期乳腺癌(BrCa)骨转移至关重要。然而,现有模型难以准确重现多微环境的组成和空间复杂性,限制了其对细胞功能表达的支持。

近期,西南交通大学王垚磊副教授、成都中医药大学申重阳副教授、西部战区总医院骨科副主任医师谢庆云等人通过嵌套双水相体系乳液模板技术开发了一种新型多孔核壳微球,成功构建了模拟乳腺癌骨转移的3D血管周围-骨内膜多微环境模型(PVM-EM),实现了对微环境的精确调控,并有效模拟了早期骨转移的关键生物学过程,为临床前研究和药物筛选提供了高效、精准的模型。相关研究以“One‐Step Fabrication of Highly Customizable Porous Core–Shell Microspheres for the Construction of a 3D Physiologically Relevant Perivascular‐Endosteal Multi‐Microenvironment Model of Breast Cancer Bone Metastasis”为题目,发表在期刊《Advanced Functional Materials》上。
本文要点:
1、本研究利用嵌套双水相体系乳液作为模板,开发了一种新型核壳微球,用于构建乳腺癌骨转移的PVM-EM 3D模型。
2、该模型实现了对化学成分、大孔结构和细胞定位的精准控制,通过调整各项微环境参数,一步成功重建了核心区室化PVM与壳体功能性EM。
3、研究结果显示,多孔结构和精准细胞定位显著提高了微环境中的细胞活性和功能。
4、更重要的是,该模型有效模拟了乳腺癌骨转移早期的重要生物学过程,包括细胞因子表达上调、PVM中的广泛血管生成以及EM中碱性磷酸酶表达的显著抑制。
5、此方法为高效、精准构建生理相关的PVM-EM模型提供了新途径,有助于乳腺癌骨转移的临床前研究及药物筛选。
核壳微球通过其多功能性在乳腺癌骨转移研究中起到了重要作用,具体如下:
首先,它们能够实现核心与外壳成分的独立调控,包括化学成分、孔隙率及细胞定位,这种精确控制有助于模拟骨髓内的血管周围微环境(PVM)和骨内膜微环境(EM)。
其次,微球的多孔结构为细胞提供了更多空间和营养支持,有效促进血管生成,并维持较高的细胞活性与生物功能。
此外,核壳微球模型能够再现与骨转移相关的关键生物过程,例如细胞因子(如VEGF和IL-6)分泌增加、血管生成显著增强以及骨形成的抑制。
这种模型还可以通过多微环境的精确构建,区分不同侵袭性乳腺癌细胞在骨转移过程中的表现,为早期肿瘤骨侵袭机制研究及药物筛选提供了高效工具。
本研究利用嵌套双水相体系乳液(ATPS乳液)作为模板开发多孔核壳微球,具体步骤包括:
1、双水相体系(ATPS)的制备:
向离心管中加入聚乙二醇(PEG, Mw = 8 kDa)和葡聚糖(Dex, Mw = 500 kDa),以去离子水混合并搅拌6小时,待其达到相平衡,从而分离出上层的PEG富集相和下层的Dex富集相。
2、核壳乳液的核心与壳流体制备:
将Dex相和PEG相以特定体积比例(如170:30、150:50等)进行乳化(2000 rpm),分别生成含有分散液滴的Dex-in-PEG乳液和PEG-in-Dex乳液。
核流体由Dex-in-PEG乳液与特定比例的Matrigel和藻酸盐(Alginate)混合制成。
壳流体由PEG-in-Dex乳液与另一比例的Matrigel和藻酸盐混合制成。
3、核壳嵌套乳液形成:
使用嵌针装置,内针连接盛放核流体的注射器,外针连接盛放壳流体的注射器。
调节注射泵的流速,先推入壳流体形成外围层,再推入核流体,形成核壳结构的滴液,其因重力作用下降至盛有CaCl2-PEG溶液的培养板中,通过交联反应形成核壳微球。
4、交联与固化:
在37°C下将形成的嵌套乳液滴液孵育15分钟,通过CaCl2-PEG溶液完成交联固化,生成具有良好结构稳定性的核壳多孔微球。
5、结构特性的调控:
通过调整核心流体和壳层流体中PEG相与Dex相的体积比,可以实现对微球核心和壳层尺寸及孔径的精确调节,例如核心孔径从25至70 μm,壳层孔径从20至50 μm。
此外,通过控制乳化时间和流体的比例,还可以灵活调整核壳结构的体积比例,从而满足特定组织生长的需求。
通过以上制备步骤,本研究成功开发出了高度可定制化的多孔核壳海藻酸盐-Matrigel微球(Porous Core-Shell Alginate-Matrigel,P-CS-AM微球),其能显著提升细胞活性与功能,为后续生理相关模型的构建奠定了基础。
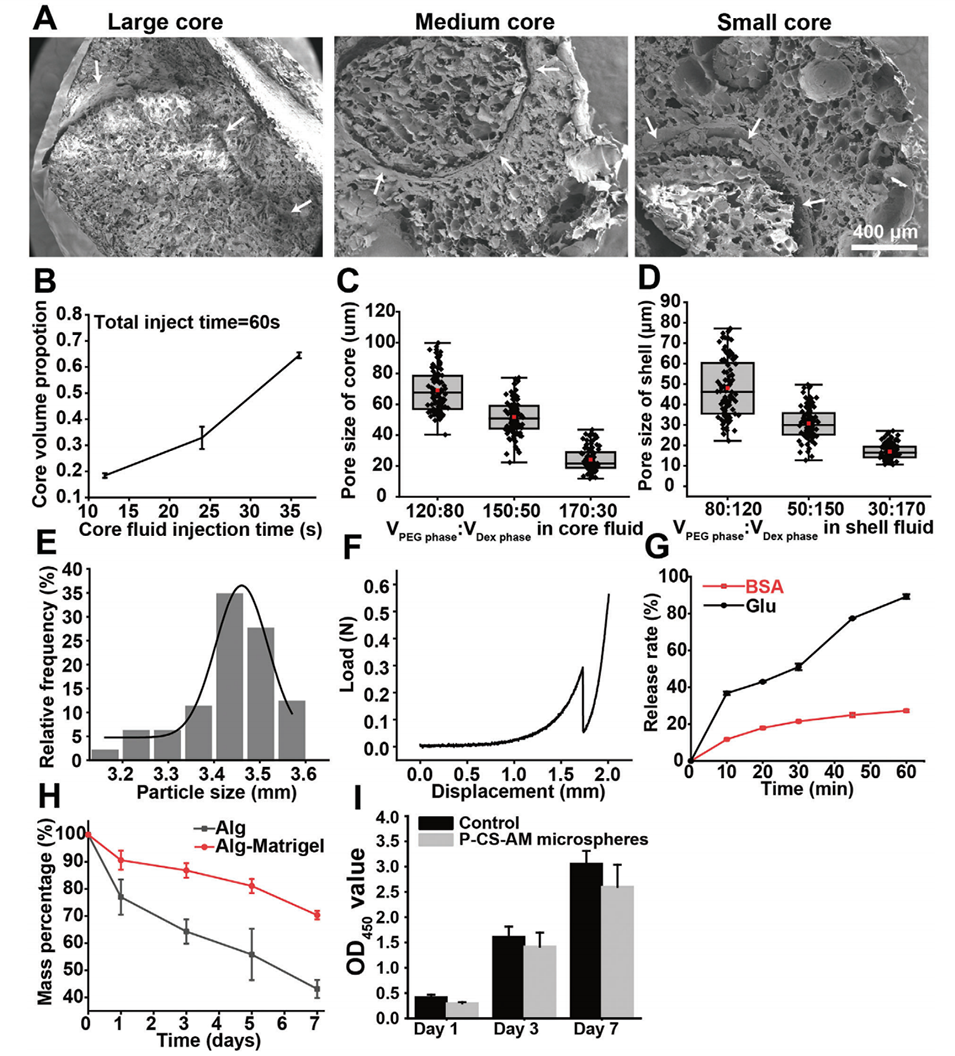
图1:P-CS-AM微球的表征。A:P-CS-AM微球的扫描电子显微镜(SEM)图像,展示了不同核体积比例的微球以及核与壳之间的清晰边界(白色箭头指示)。B:核流体注射时间对微球核体积比例的影响。C:通过调整核流体中PEG相/Dex相的体积比,控制微球核的孔径大小。D:通过调整壳流体中PEG相/Dex相的体积比,控制微球壳的孔径大小。E:P-CS-AM微球的粒径分布。F:P-CS-AM微球的载荷-位移曲线,表明该微球可承受≈0.3N的力而不断裂,其最大承载力可达0.56 N。G:P-CS-AM微球中L-谷氨酸(L-Glu)和牛血清白蛋白(BSA)的释放能力测试。H:P-CS-AM微球与多孔核壳纯海藻酸盐微球的降解性能对比。I:P-CS-AM微球与细胞共培养1、3、7天的生物相容性测试,细胞存活率约为85%。
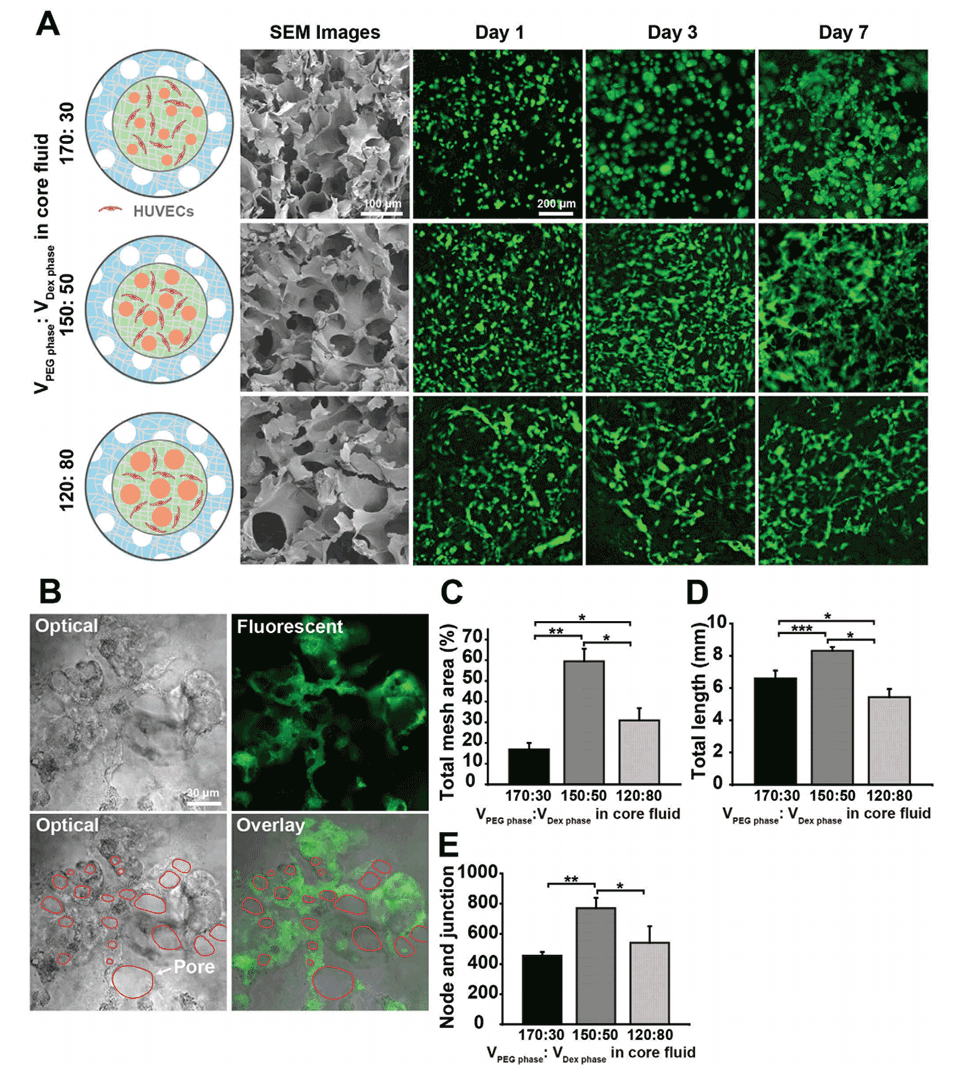
图2:P-CS-AM微球的血管生成能力。A:SEM图像展示了P-CS-AM微球核中不同孔径大小的多孔结构,以及在不同培养时间(1、3、7天)下内皮细胞(HUVECs)在微球核中的血管化情况。B:在培养7天后,内皮细胞在微球核的多孔结构周围分化为血管网络。C-E:在培养7天时,不同孔径大小的微球核中血管网络的总网格面积、总血管管长度以及节点和连接点的数量。结果显示,孔径为50 μm的微球在血管生成方面表现最佳。
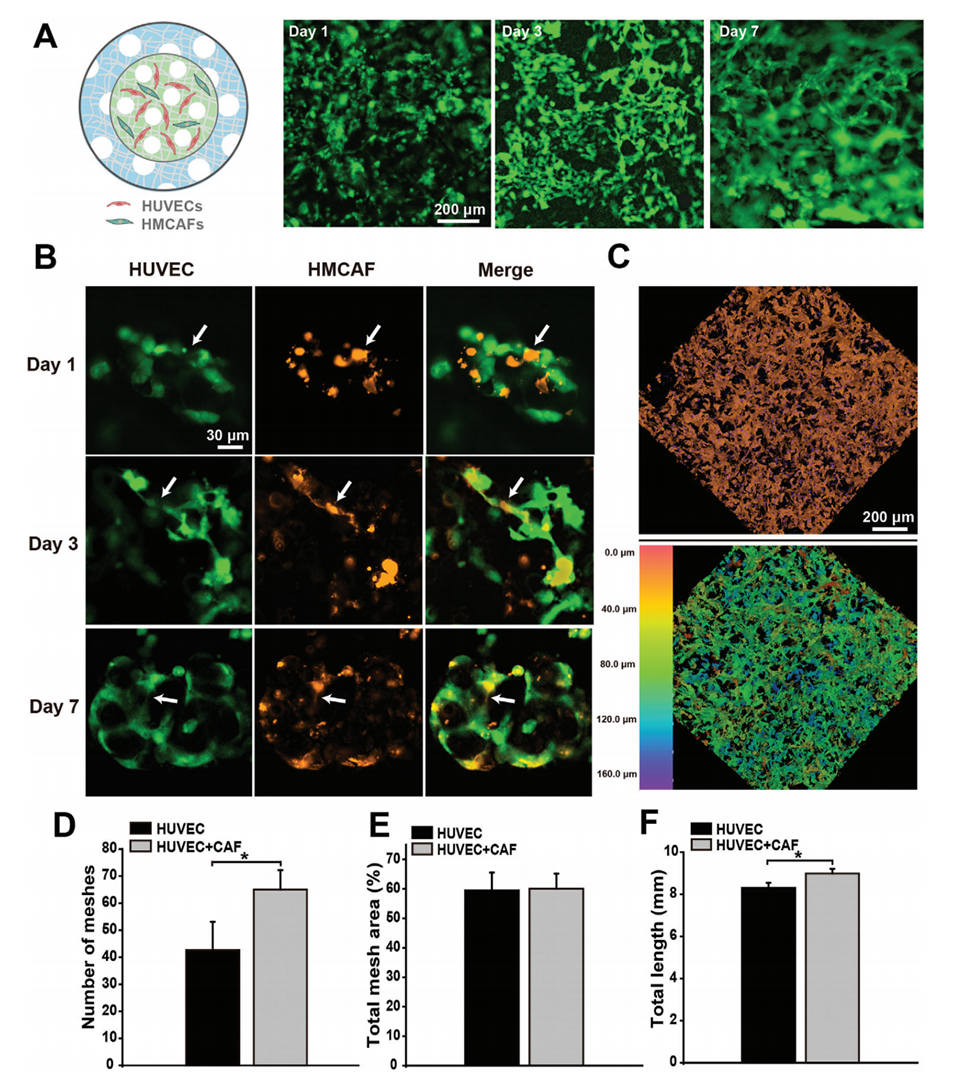
图3:CAFs在血管生成中的作用。A:示意图展示了HUVECs和CAFs在P-CS-AM微球中的分布以及在共培养3天、7天后的血管化情况。B:在1、3、7天时,CAFs在新血管形成中的定位情况。C:共培养7天后,HUVECs和CAFs在P-CS-AM微球核中的血管网络形成和深度分布的共聚焦图像。D-F:在培养7天时,HUVECs和CAFs共培养系统在微球核中的网格数量、总网格面积和总血管管长度。结果显示,CAFs显著促进了血管密度的增加。
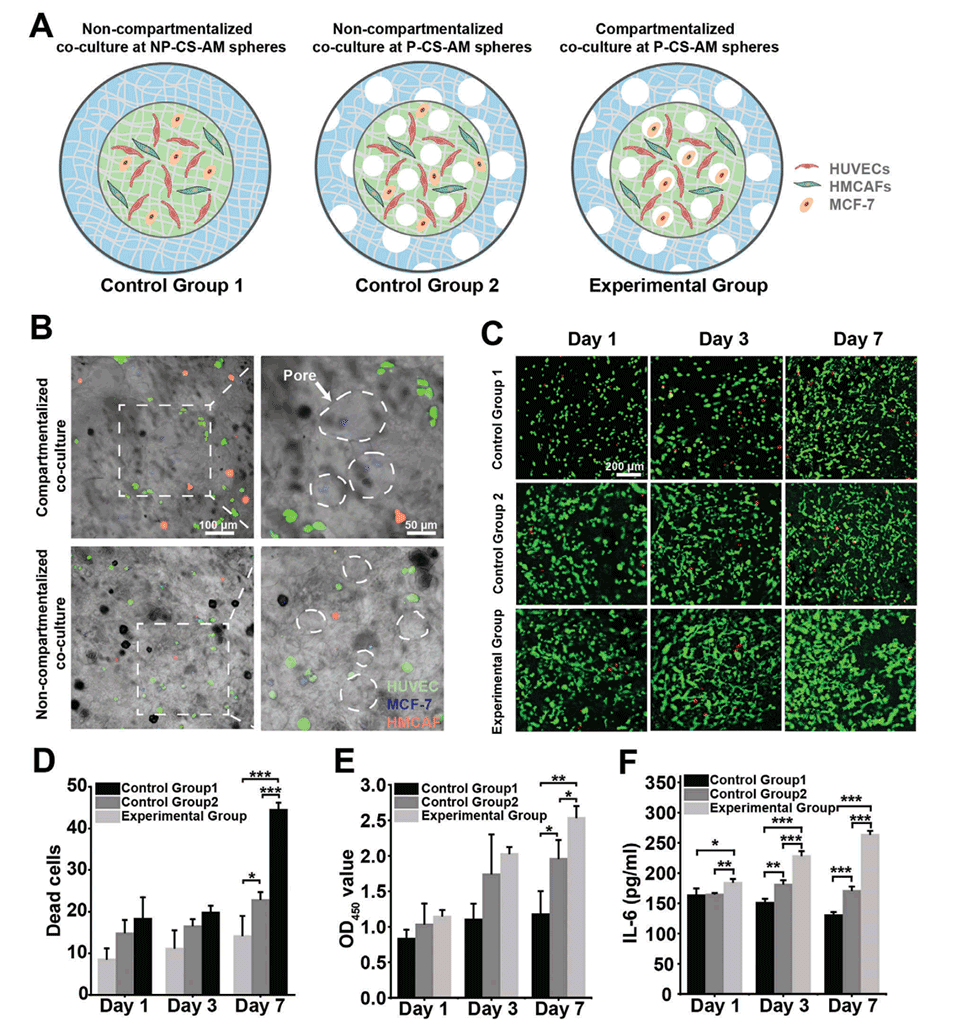
图4:单PVM模型的构建。A:示意图展示了在对照组和实验组中,HUVECs、CAFs和MCF-7细胞的分布情况。B:共聚焦图像展示了在对照组2和实验组中,HUVECs、CAFs和MCF-7细胞的分布情况。C:在1、3、7天时,对照组和实验组的活/死荧光结果。D-F:在1、3、7天时,对照组和实验组的死亡细胞数量、OD450值和IL-6分泌水平。结果显示,实验组的细胞增殖率更高,细胞死亡数量更少,且IL-6分泌水平更高。
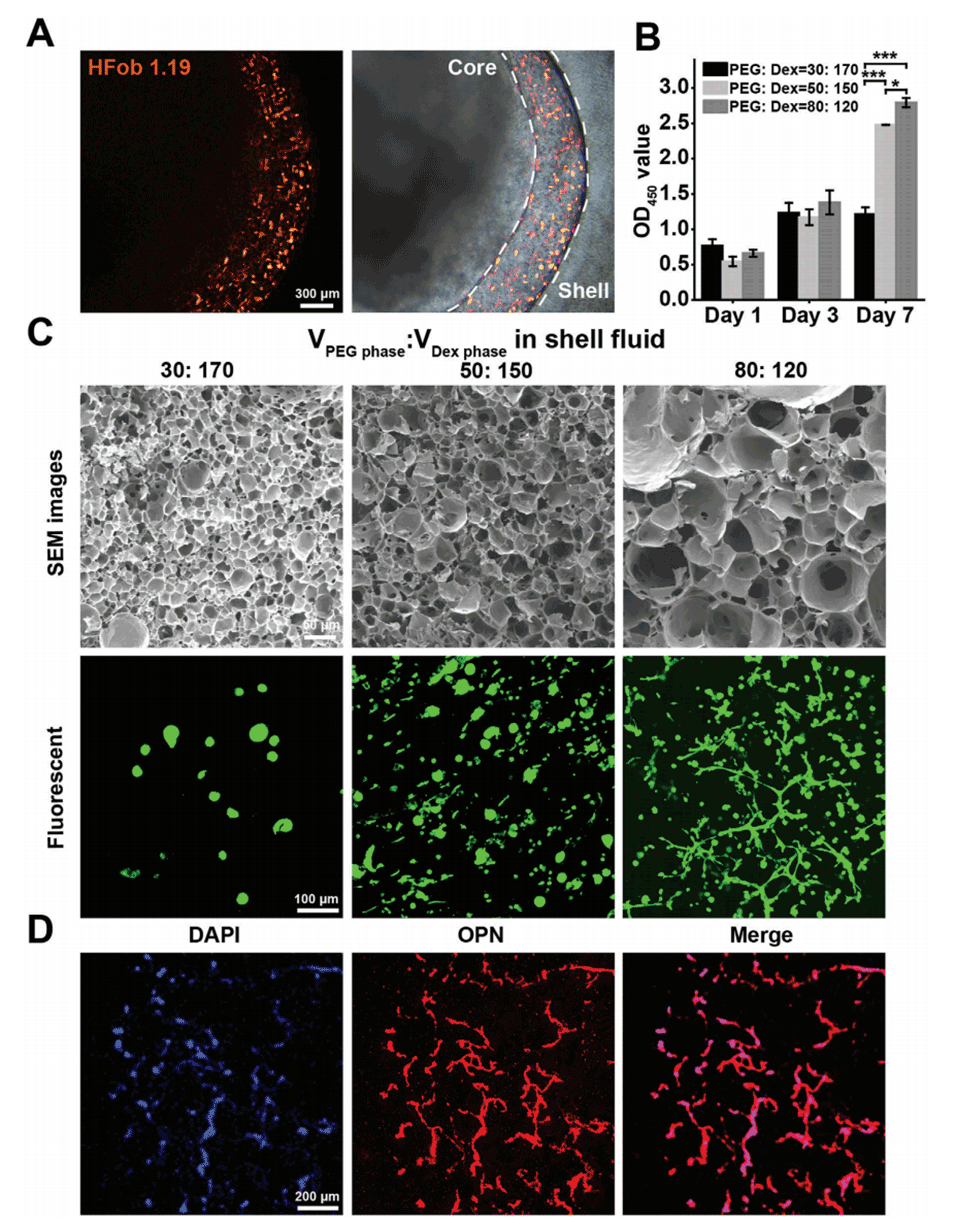
图5:单EM模型的构建。A:hFob 1.19细胞在P-CS-AM微球中的分布情况。B:在不同培养时间(1、3、7天)下,不同孔径大小的微球壳中hFob 1.19细胞的OD450值。C:不同孔径大小的微球壳中hFob 1.19细胞的SEM图像,展示了细胞在培养7天后的生长情况。D:在培养7天时,hFob 1.19细胞在微球壳中表达的骨桥蛋白(OPN)水平。结果显示,孔径为50 μm的微球壳为成骨细胞提供了最佳的生长环境。
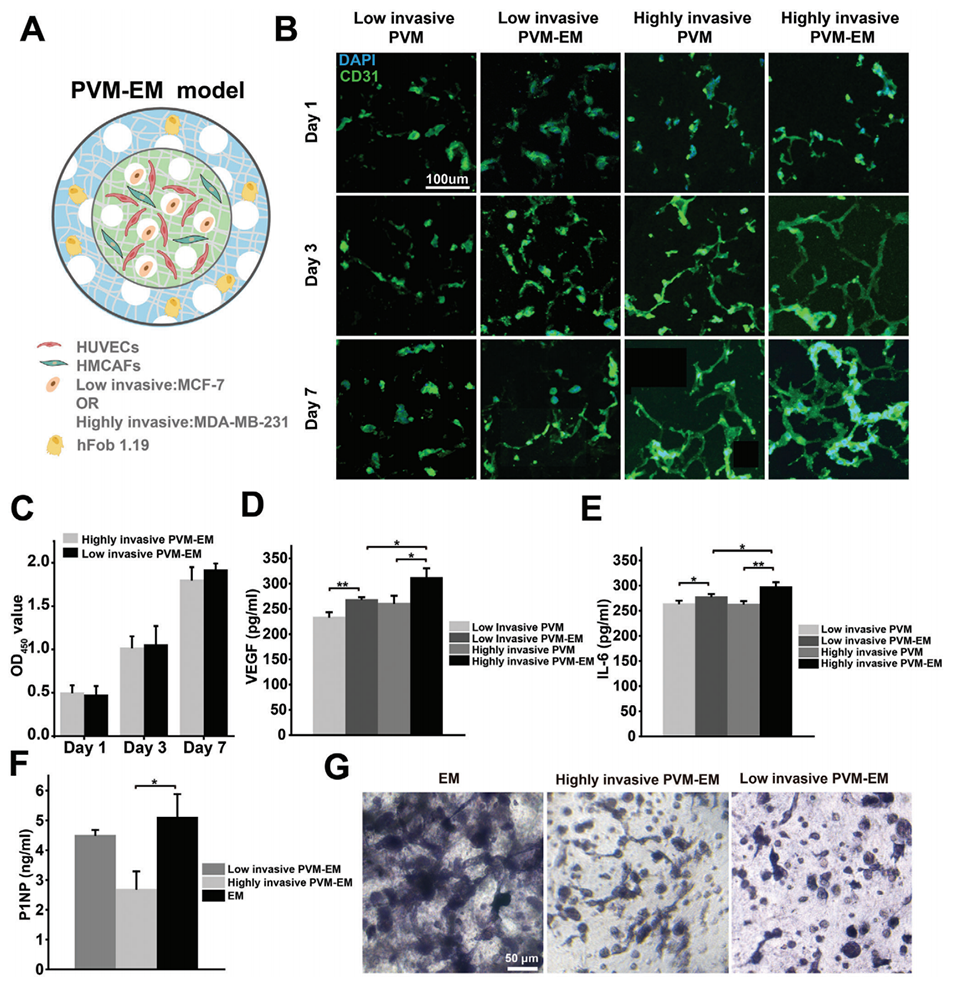
图6:多微环境模型的构建。A:示意图展示了在PVM-EM模型中不同细胞类型的分布情况。B:在不同培养时间下,不同模型中CD31的表达水平。C:两种PVM-EM模型在1、3、7天时的OD450值。D-F:在培养7天时,不同模型中VEGF、IL-6和P1NP的分泌水平。G:在培养7天时,不同模型中ALP的染色结果。结果显示,PVM-EM模型能够有效模拟乳腺癌骨转移早期的关键过程,包括细胞因子分泌增加、血管生成和成骨活性抑制。
论文链接:https://doi.org/10.1002/adfm.202419798














