
导读:
近期,中国科学技术大学赵刚教授、金腾川教授、何立群副教授联合深圳大学李自达副教授,开发了名为“液滴浓度控制与视觉平台”(DCCV)的新型微反应器系统,通过半透性双乳液滴与可编程渗透梯度相结合,实现了液滴内溶质浓度的动态调控。该系统融合了基于深度学习的自动化视觉分析,可高通量、无标记地监测液滴状态,并在20小时内成功制备出X射线级质量的蛋白质晶体,解决了传统结晶方法样本用量大、周期长、重复性差及常规微流控技术浓度难以动态调控的痛点,为微尺度反应工程、生物分子自组装等领域提供了通用框架。相关研究以“AI-Guided Droplet Microreactors Enable Rapid and Reproducible Protein Crystallization”为题目,发表于期刊《Small》。
本文要点:
1、该研究开发了液滴浓度控制与视觉(DCCV)平台,整合可编程渗透调节与深度学习驱动的无标记液滴表征技术,以双乳液液滴为微反应器,解决传统蛋白质结晶方法样本用量大、筛选繁琐、耗时久且重现性差,以及常规微流控液滴形成后内部成分固定的局限。
2、平台借助半透性油壳的渗透梯度,可在液滴形成后动态调节溶质浓度,结合YOLOv5神经网络与DeepSORT算法,实现液滴的自动检测、分类、跟踪及尺寸测量,精度与手动测量高度一致。同时构建渗透传输理论模型,能准确预测液滴尺寸和溶质浓度变化。
3、实验验证显示,DCCV平台可在20小时内获得满足X射线衍射要求的溶菌酶晶体,且适用于索马甜、辣根过氧化物酶等多种蛋白质,兼容氯化钠、PEG 400等不同渗透剂。
4、与传统气相扩散法相比,该平台能连续、可编程调控过饱和度,兼具高通量、低样本消耗、重现性强等优势,除蛋白质结晶外,还为微尺度反应工程、生物分子自组装及材料发现提供了通用框架。
DCCV平台巧妙融合微流控、AI 视觉与渗透传质技术,充分发挥跨领域集成优势,但其走向实际应用需解决通用性与专用化之间的矛盾。
一方面,平台需模块化设计:将微流控液滴生成、渗透调控模块、成像单元、AI算法包解耦,允许用户根据蛋白质特性(如分子量、疏水性、稳定性)替换渗透膜材质(调整截留分子量)、更换外相渗透剂(如盐类、聚合物、有机溶剂),以适应不同蛋白质的结晶窗口。
另一方面,需建立标准化数据接口与预测模型库:将不同蛋白质体系的成功结晶条件(渗透梯度曲线、晶体质量数据)与AI视觉特征关联,形成可迁移的结晶知识图谱。这样,用户针对新蛋白质时,平台可推荐相似体系的调控策略,在通用硬件上实现专用化优化,加速其在膜蛋白、大分子复合物等难结晶体系中的高通量筛选应用。
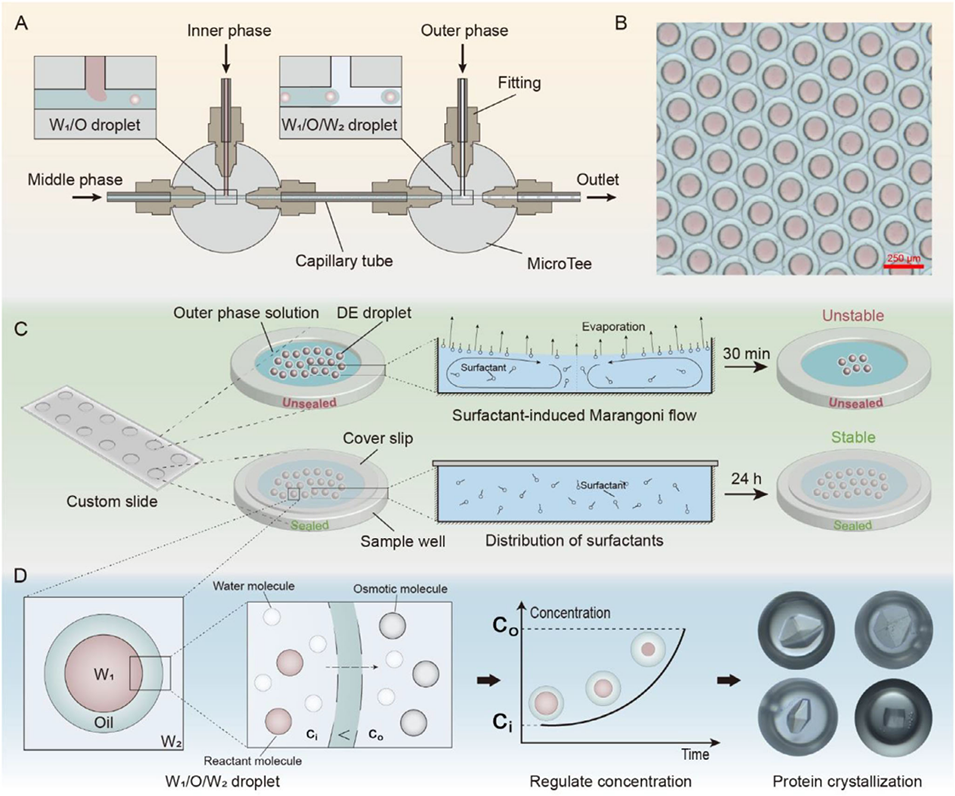
图1 DCCV 策略的示意图和概念概述。(A) 玻璃毛细管微流控系统生成双乳液(DE)的示意图。(B) 单分散单核双乳液液滴的光学显微镜图像。(C) 示意图显示双乳液液滴密封在定制载玻片和盖玻片内,避免与气-液界面接触。未密封液滴在约 30 分钟内出现结构不稳定,而密封液滴可保持完整数天。(D) 概念图说明 DCCV 平台如何通过调节内外水相间的渗透压梯度,实现双乳液基微反应器中溶质浓度的动态调控。该方法可对化学反应进行可编程控制,并在蛋白质结晶等应用中得到验证。
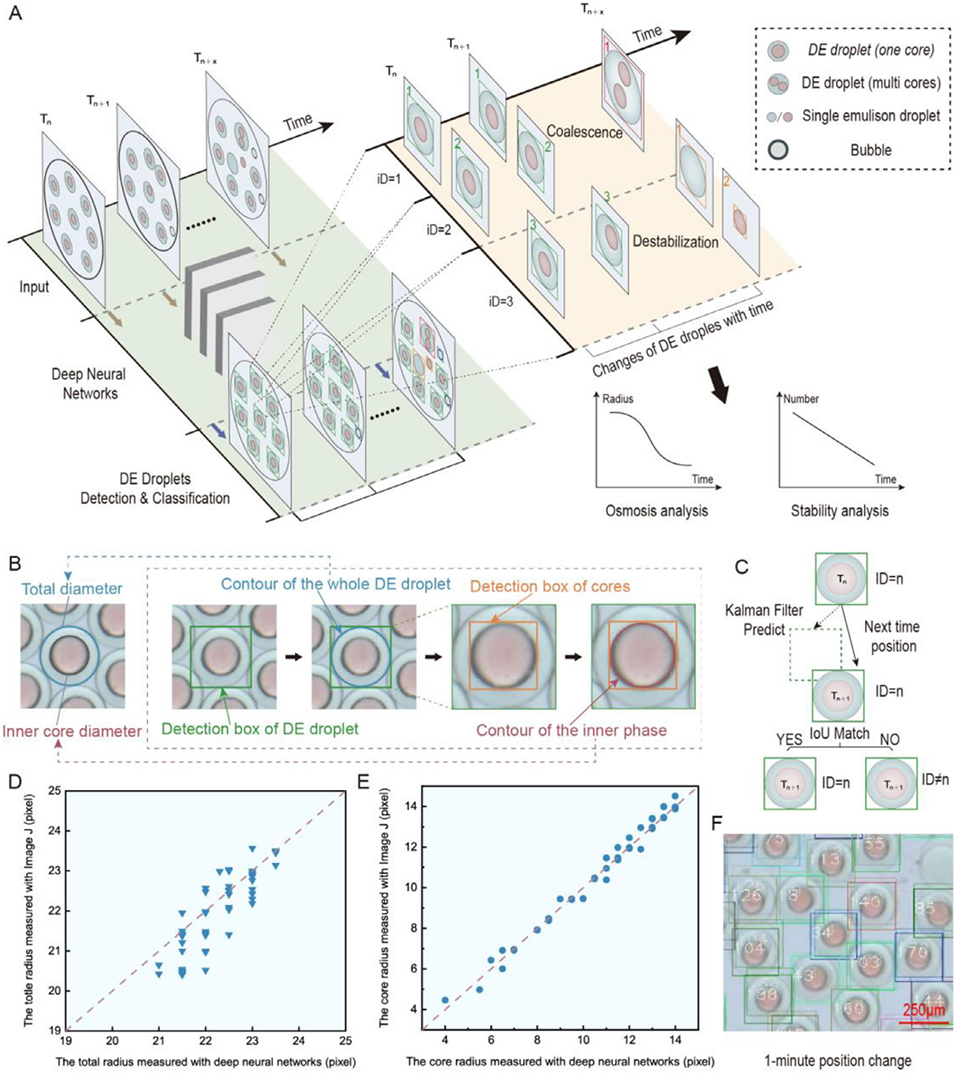
图2 基于计算机视觉算法的双乳液(DE)液滴自动表征。(A) 利用 YOLOv5 深度神经网络对双乳液液滴进行无标记检测和分类。液滴类别和尺寸的时间变化可用于分析渗透行为和结构稳定性。(B) 利用边界框提取液滴总半径和核心半径的示意图。(C) 通过 DeepSORT 算法对单个双乳液液滴进行实时跟踪,实现液滴演变的连续监测。(D) 计算机视觉算法测得的液滴总半径与 ImageJ 手动测量结果的对比(n=50)。(E) 算法计算的双乳液液滴核心半径与 ImageJ 手动测量值的对比(n=50)。(F) 双乳液液滴在一分钟内的代表性位移轨迹,浅色标记为各液滴的历史位置供参考。
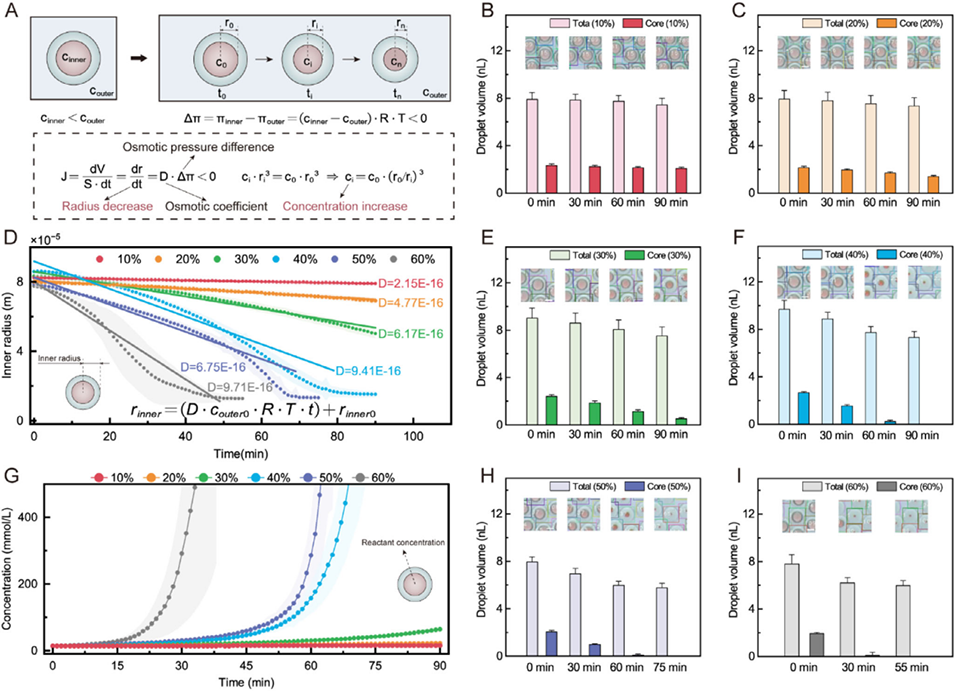
图3 提高液滴微反应器中反应物浓度的研究。(A) 双乳液液滴内反应物浓度升高的示意图,以及液滴尺寸和浓度的典型变化。(B、C) 外相分别为 10 wt.% 和 20 wt.% 甘油水溶液时的液滴体积变化。(D) 外相为不同浓度甘油水溶液时,液滴内相半径随时间的变化。图中显示了拟合的渗透系数 D(单位:m²・s・kg⁻¹)及对应的半径-时间曲线(实线)。(E、F) 外相分别为 30 wt.% 和 40 wt.% 甘油水溶液时的液滴体积变化。(G) 不同外相甘油浓度下,内相浓度随时间的变化。(H、I) 外相分别为 50 wt.% 和 60 wt.% 甘油水溶液时的液滴体积变化。所有定量分析中,每个条件至少分析 60 个液滴(n≥60)。
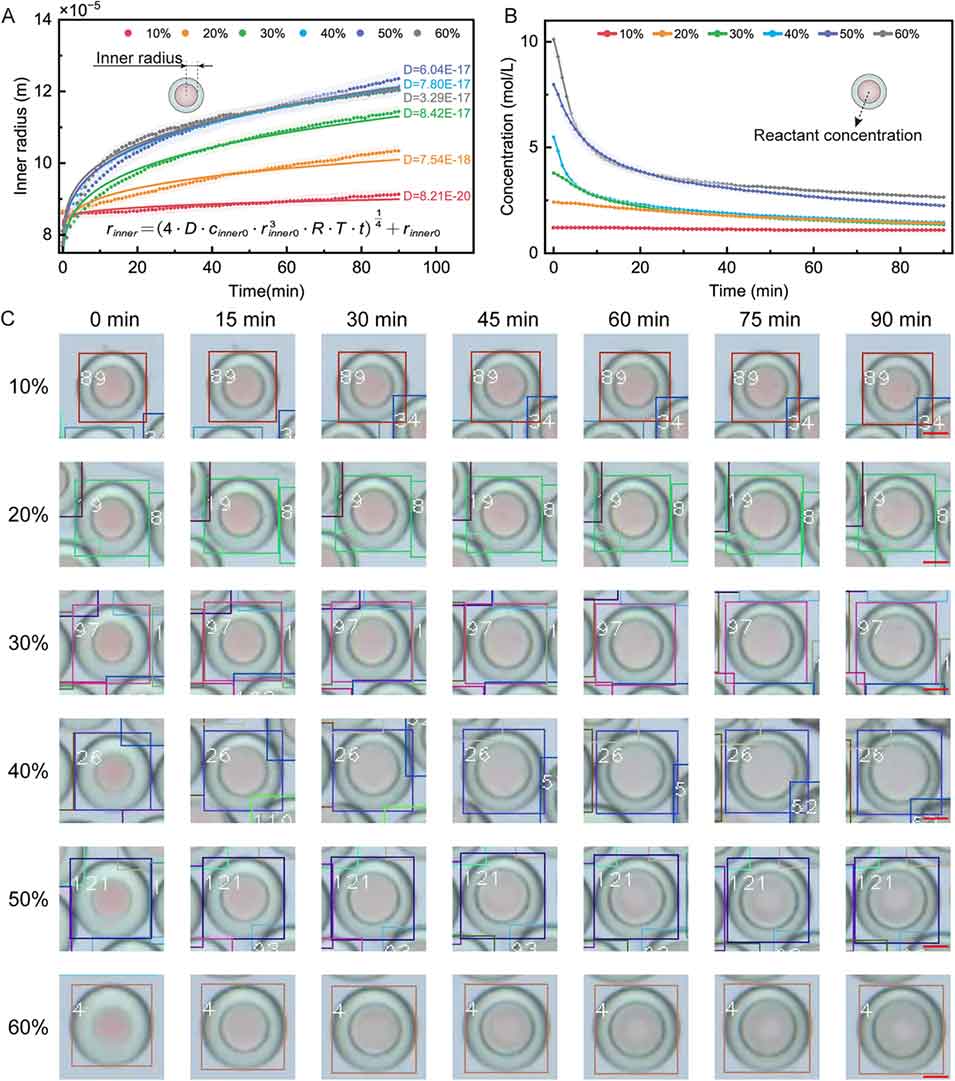
图4 降低液滴微反应器中反应物浓度的研究。(A) 内相为不同浓度甘油水溶液时,液滴内相半径随时间的变化。图中提供了拟合的渗透系数 D(单位:m²・s・kg⁻¹)及基于该系数的半径-时间曲线(实线)。(B) 内相为不同浓度甘油水溶液时,内相浓度随时间的变化。(C) 内相分别为 10 wt.%、20 wt.%、30 wt.%、40 wt.%、50 wt.% 和 60 wt.% 甘油水溶液时,单个液滴在不同时间点的显微镜图像。红色标尺为 100 µm。所有定量分析中,每个条件至少分析 60 个液滴(n≥60)。
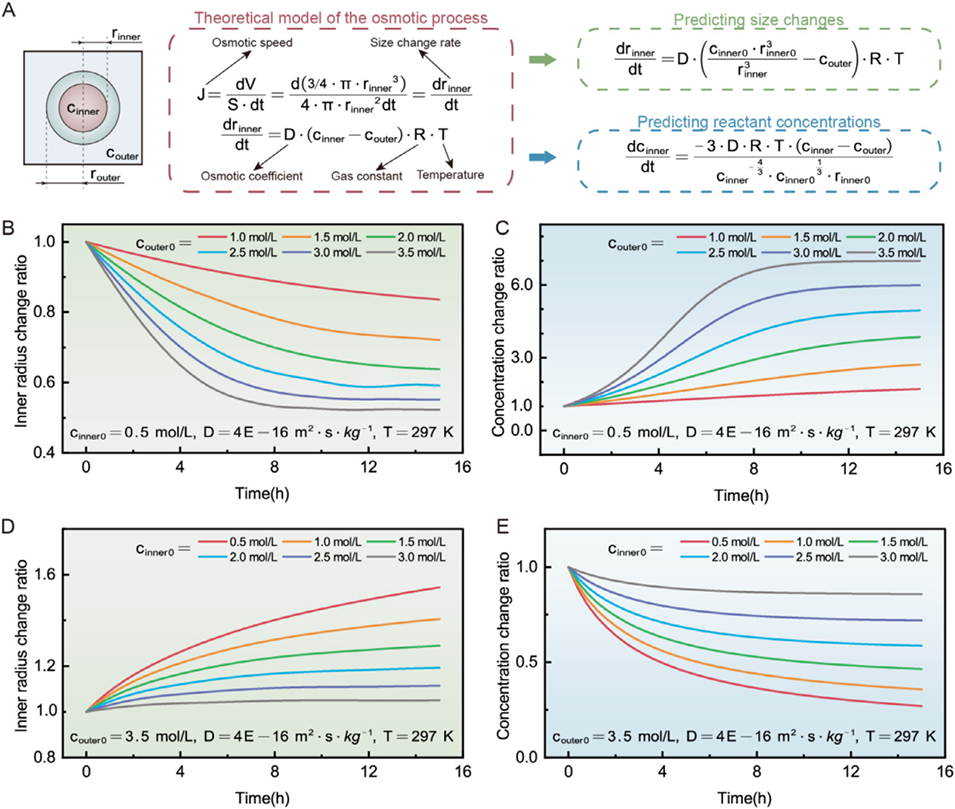
图5 DCCV 平台预测双乳液微反应器内液滴尺寸和内部溶质浓度随时间演变的理论模型。(A) 双乳液渗透过程的理论模型,以及利用该模型预测的尺寸和反应物浓度随时间的变化。(B、C) 在 297 K 下,初始内相浓度(cinner0)设为 0.5 mol/L、渗透系数 D 为 4×10⁻¹⁶ m²・s・kg⁻¹ 时,不同初始外相浓度(couter0=1.0、1.5、2.0、2.5、3.0 和 3.5 mol/L)下内相半径和反应物浓度的预测变化率。(D、E) 在 297 K 下,外相浓度(couter0)设为 3.5 mol/L、渗透系数 D 为 4×10⁻¹⁶ m²・s・kg⁻¹ 时,不同初始内相浓度(cinner0=0.5、1.0、1.5、2.0、2.5 和 3.0 mol/L)下内相尺寸和反应物浓度的预测变化率。
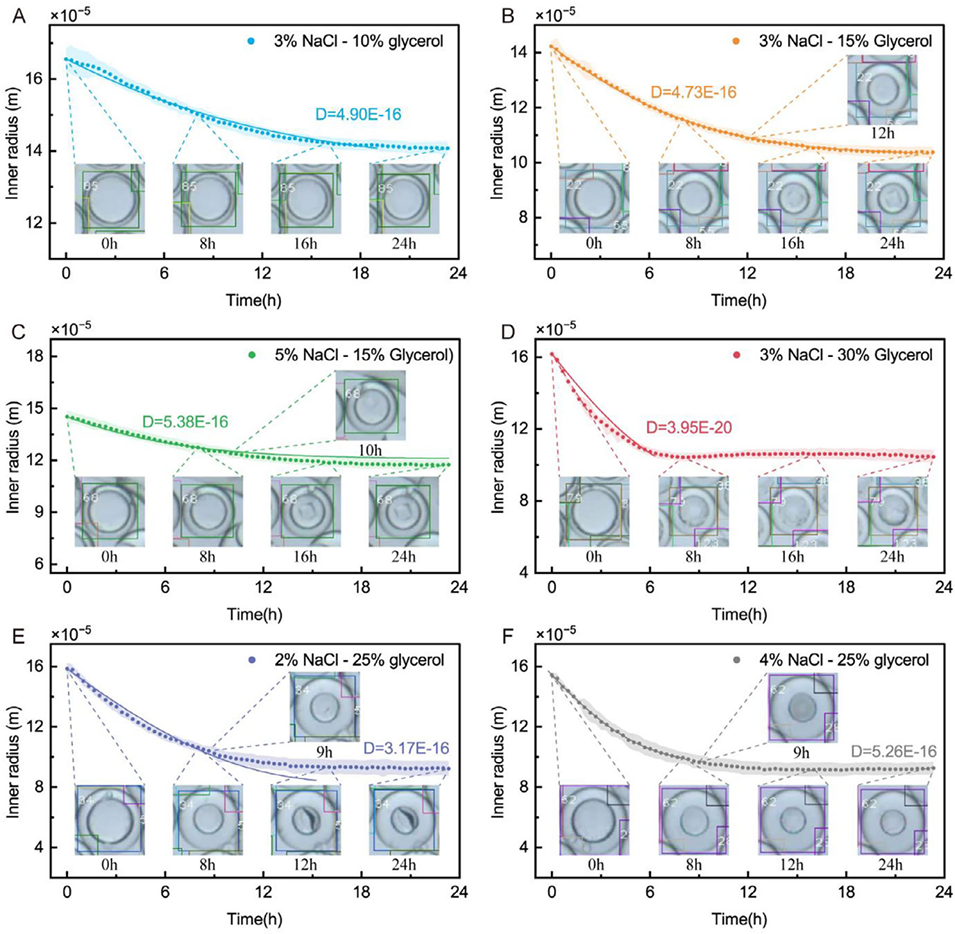
图6 双乳液(DE)中的蛋白质结晶。(A-F) 双乳液液滴内外相溶液浓度变化对溶菌酶结晶及后续结构表征的影响。所有实验使用的蛋白质溶液为含 80 mg/mL 溶菌酶的 50 mM NaAc-HAc 缓冲液(pH 4.5),沉淀剂溶液为含不同质量分数 NaCl(2%、3%、4% 和 5%)的 0.1 M NaAc-HAc 缓冲液(pH 4.6),外相水溶液中甘油的质量分数分别为 10%、15%、20%、25% 和 30%。每个条件下至少对 60 个液滴进行统计分析(n≥60)。符号表示实验测量数据点,实线为利用理论渗透模型得到的拟合曲线。每条曲线旁标注了拟合的油壳渗透系数 D,单位为 m²・s・kg⁻¹。
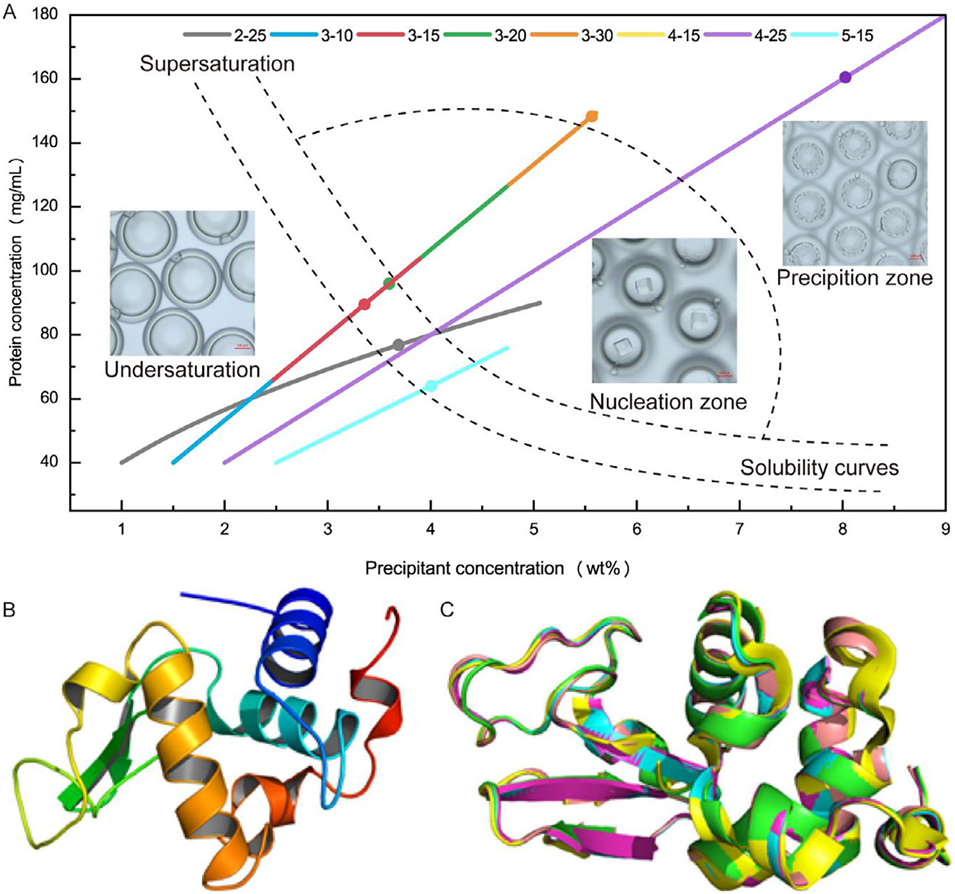
图7 溶菌酶的相图构建与结构分析。(A) 基于不同条件下观察到的晶体形成情况构建的溶菌酶蛋白质结晶推测相图(n≥60)。较大符号表示观察到晶体形成或沉淀的时间点。(B) 通过 DCCV 平台制备的溶菌酶整体结构(PDB ID:8K8M)。(C) 通过 DCCV 平台制备的溶菌酶(PDB ID:8K8M)与其他方法形成的晶体结构(PDB ID:1HEO、193L、6KD1 和 1HEL)的结构对比。8K8M 的二级结构元件为绿色,1HEL 为青色,1HEO 为品红色,6KD1 为黄色,193L 为橙红色。
论文链接:https://doi.org/10.1002/smll.202510977
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














