
导读:
单分散Pickering乳液的制备目前只能通过微流控或膜乳化来实现,限制了其在诸多领域的广泛应用。近期,香港中文大学魏涛教授、英国赫尔大学Bernard P. Binks教授通过引入天然蜂花粉颗粒,利用其固有均一性及坚固外壁在机械剪切过程中直接形成“油包水包花粉”结构的单分散乳液,并进一步结合溶胶-凝胶界面工程,以孢粉素外壁胶囊(SECs)为核心模板,成功制备出“蛋黄-壳”双壳微胶囊,显著提升了活性物质的封装效率与稳定性。相关研究以“Harnessing the Power of Nature: Monodisperse Pickering Emulsion Droplets and Yolk-Shell Microcapsules Utilizing Bee Pollen Particles”为题目,发表在期刊《Advanced Functional Materials》上。
本文要点:
1、本文提出了一种利用天然蜂花粉颗粒制备单分散Pickering乳液的新方法。
2、研究发现,在机械乳化过程中引入花粉颗粒,其坚固外壁可承受剪切力并保持结构完整,形成“油包水包花粉”单分散乳液。
3、花粉的固有均一性直接决定了乳液液滴的尺寸一致性,通过离心即可高效收集。
4、进一步以孢粉素外壁胶囊(SECs)替代原始花粉,结合溶胶-凝胶界面工程,成功制备了“蛋黄-壳”双壳微胶囊。
5、该结构以花粉外壁为内层、二氧化硅为外壳,不仅解决了SECs活性物质泄漏问题,还赋予微胶囊优异的均匀性和稳定性。
6、不同形态花粉(如近球型油菜花粉、刺状向日葵花粉)均适用此方法,验证了其普适性。
7、本研究为天然材料与界面工程结合提供了新思路,在生物医药、功能材料等领域具有应用潜力。
利用蜂花粉颗粒制备单分散油包水(w/o)Pickering乳液的过程可分为以下几个关键步骤:
1、花粉预处理
将天然蜂花粉颗粒用乙醇-水混合液(体积比2:1)反复超声清洗,去除表面脂质和蛋白质杂质。
清洗后的花粉分散于去离子水中,浓度控制在10%-20%(w/v),通过超声处理(37 kHz)确保均匀分散。
2、油相乳化剂制备
将疏水二氧化硅纳米颗粒(R974)按3%质量浓度(w/v)分散于硅油(如D5)中,超声处理形成稳定悬浮液。
3、剪切乳化
将含花粉的水相逐滴加入油相中,控制油水体积比为10:1或更高(如20:1),避免体系黏度过高。
使用高速剪切均质机(20,000 rpm)进行机械乳化,剪切时间以形成均匀液滴为准(通常数分钟)。
4、离心纯化
将乳液以4000 g离心10分钟,含单个花粉的大液滴沉降至管底,移除上层含小液滴的油相。
5、乳液收集与表征
收集下层乳液,获得单分散w/o Pickering乳液(液滴直径略大于花粉粒径,如38.6±2.1 μm)。
通过光学显微镜或共聚焦激光扫描显微镜(CLSM)验证液滴单分散性及花粉分布。
在溶胶-凝胶界面工程中,如何实现二氧化硅外壳对复杂表面(如刺状SECs)的高保形包覆?其工艺参数的优化空间与潜在失效机制是什么?
本研究通过正硅酸乙酯(TEOS)在油水界面的水解缩合反应形成二氧化硅外壳,其保形包覆的关键机制包括:
1、界面限域反应:TEOS优先在油水界面处水解生成硅酸,随后缩合沉积于SECs表面,形成连续壳层。此过程受界面张力和反应物扩散速率控制,确保包覆均匀性。
2、表面润湿性匹配:SECs的疏水性外壁(孢粉素主导)与油相亲和,促使TEOS在界面处富集,而疏水二氧化硅纳米颗粒(R974)进一步稳定界面,减少壳层缺陷。
优化空间与挑战:
反应动力学调控:TEOS浓度、氨水添加速率和温度需协同优化。例如,降低TEOS浓度可减缓反应速率,减少局部过厚(如刺状尖端),但需平衡壳层完整性。
复杂表面适配性:向日葵SECs的刺状结构可能因尖端曲率大导致壳层应力集中。未来可通过原子层沉积(ALD)预涂覆氧化铝薄层,提升表面化学均一性,促进硅壳均匀生长。
原位监测技术:现有SEM表征仅提供静态结果,需引入原位AFM或拉曼光谱,实时追踪界面反应动态,识别失效节点(如壳层裂纹萌生)。
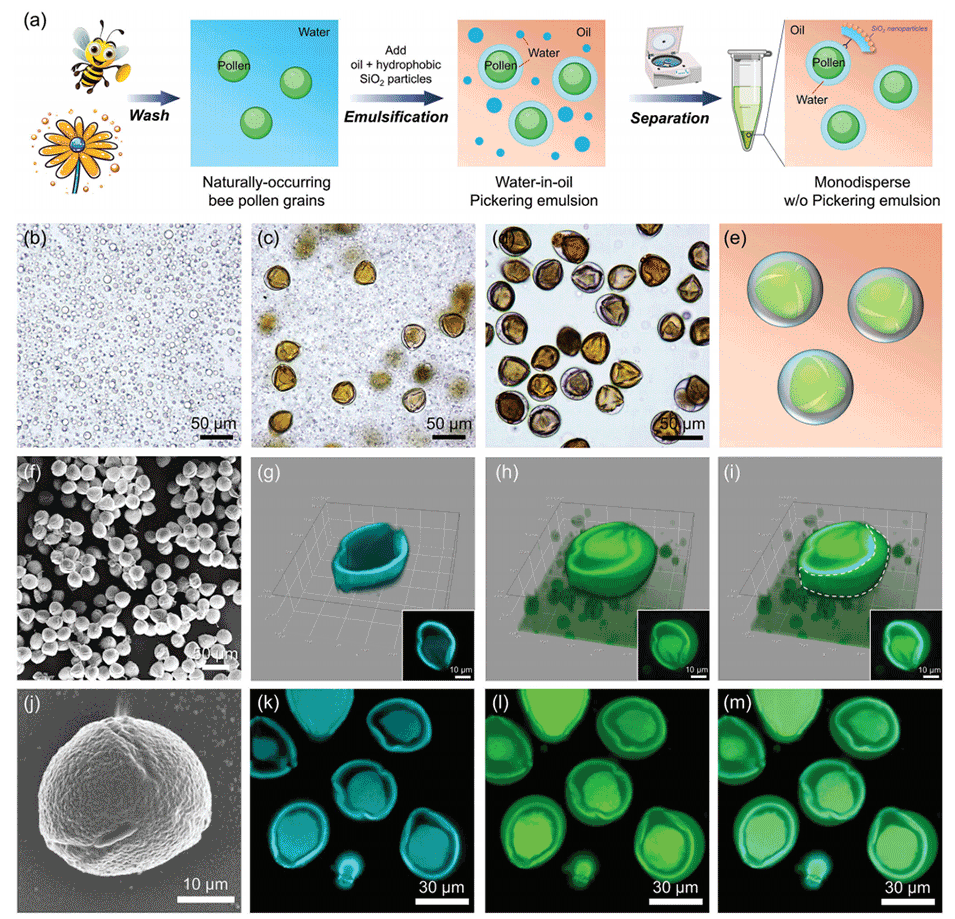
图1:a为利用蜂花粉颗粒制备单分散油包水(w/o)Pickering乳液的工艺示意图,通过MedPeer绘制;b为不含花粉的w/o Pickering乳液光学显微镜图像(液滴尺寸<5 μm);c为含山茶花粉的w/o乳液图像,显示“油包水包花粉”结构;d为离心分离后的单花粉液滴显微图像(高度单分散);e为单花粉液滴模型示意图;f与j为洗涤后山茶花粉的SEM图像,显示其三角锥形表面特征;g-i为含有山茶花花粉颗粒的初级油包水Pickering乳液在不同荧光通道下的三维共聚焦激光扫描显微镜图像;插图表示乳液液滴的横截面;k-m为离心后,含有单个山茶花花粉颗粒的单分散油包水Pickering乳液在不同荧光通道下的共聚焦激光扫描显微镜图像。
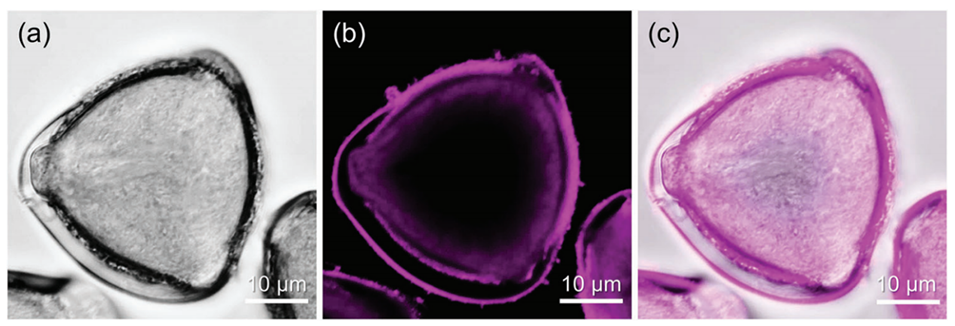
图2:单分散油包水Pickering乳液(每个液滴中含有一个山茶花花粉颗粒)在差分干涉对比通道(a)、紫色通道(b)及叠加通道(c)下的CLSM图像。
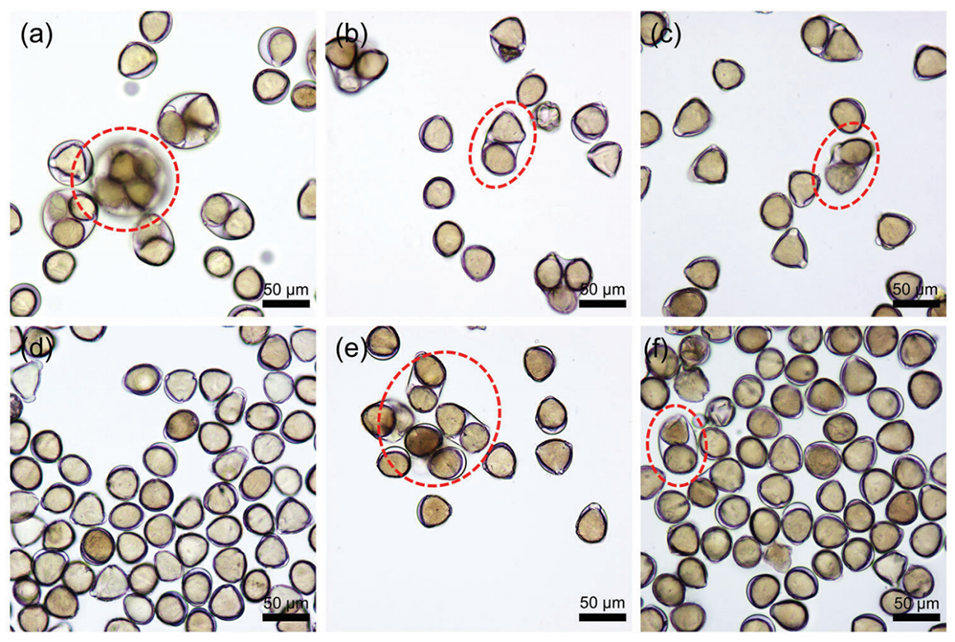
图3:a-c分别为10,000 rpm、15,000 rpm、17,600 rpm剪切速度下含山茶花粉的w/o Pickering乳液显微图像,显示剪切速度对液滴包裹花粉数量的影响(速度越高,单花粉液滴占比增加);d为20,000 rpm优化条件下的单分散液滴(38.6±2.1 μm);e-f分别为油水比5:1与花粉浓度40%时的非均匀液滴,说明了参数调控的必要性。
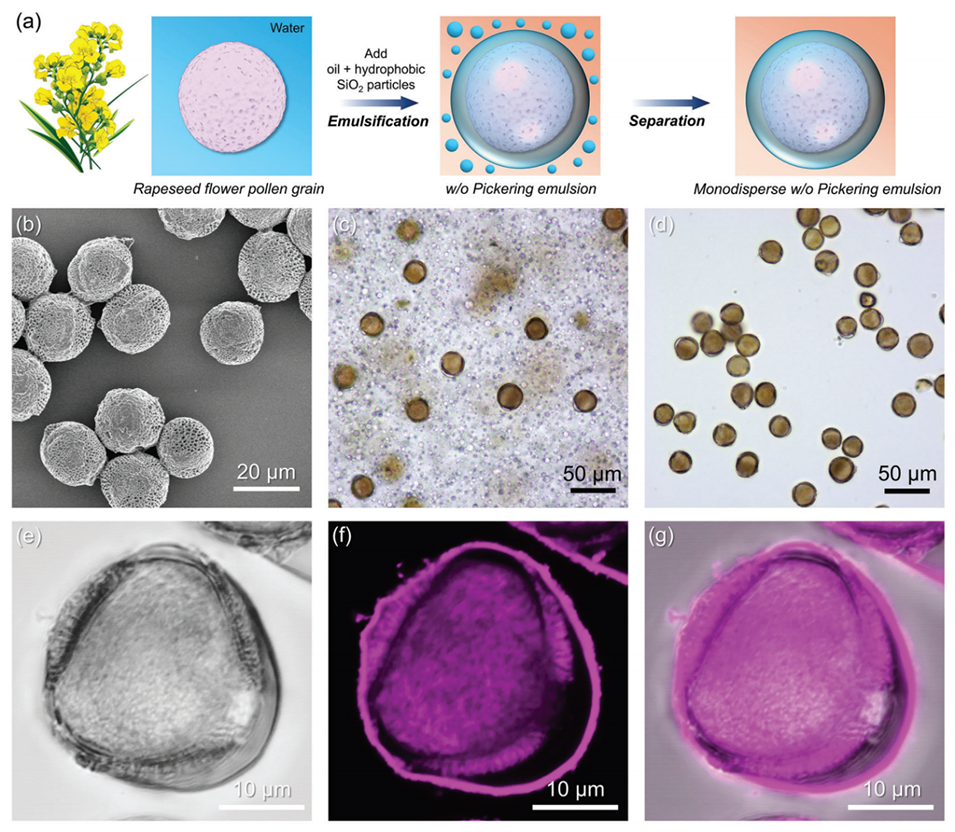
图4:a为油菜花粉制备乳液的流程示意图;b为清洗后油菜花粉的SEM图像(近球形,直径≈26 μm);c为含油菜花粉的w/o Pickering乳液的光学显微图像;d为离心后单花粉液滴的光学显微图像;e-g为含单个油菜花花粉颗粒的单分散油包水Pickering乳液在不同共聚焦通道下的共聚焦激光扫描显微镜图像。油水体积比为10:1,均质化速度为20,000 rpm,花粉浓度为20%。
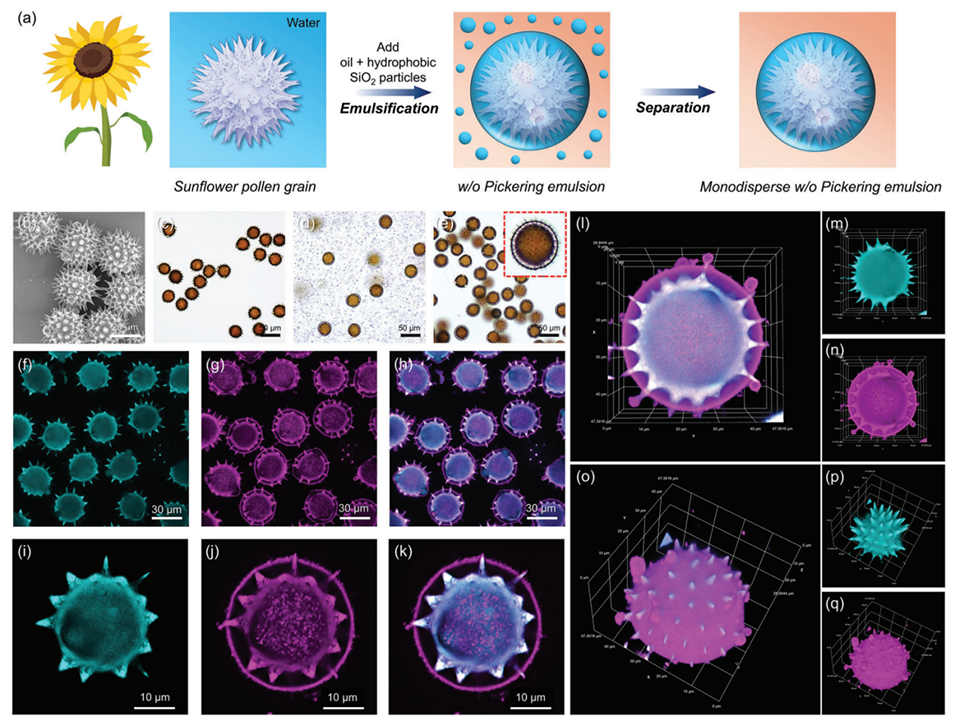
图5:a为向日葵花粉制备乳液的流程示意图;b-c为清洗后向日葵花粉的SEM与显微图像,显示表面刺状突起;d为含有向日葵花粉颗粒的油包水Pickering乳液的光学显微镜图像;e为经分离后,含有单个向日葵花粉颗粒的油包水Pickering乳液的光学显微镜图像;插图是单个液滴的放大图。f-k为单分散油包水Pickering乳液(每个液滴中含有单个向日葵花粉颗粒)在不同荧光通道下的共聚焦激光扫描显微镜图像,两种放大倍数。l-n为含有向日葵花粉颗粒的油包水Pickering乳液液滴的三维共聚焦激光扫描显微镜图像(前视图)。o-q为含有向日葵花粉颗粒的油包水Pickering乳液液滴的三维共聚焦激光扫描显微镜图像(侧视图)。油水体积比为10:1,均质化速度为20,000 rpm,花粉浓度为20%。
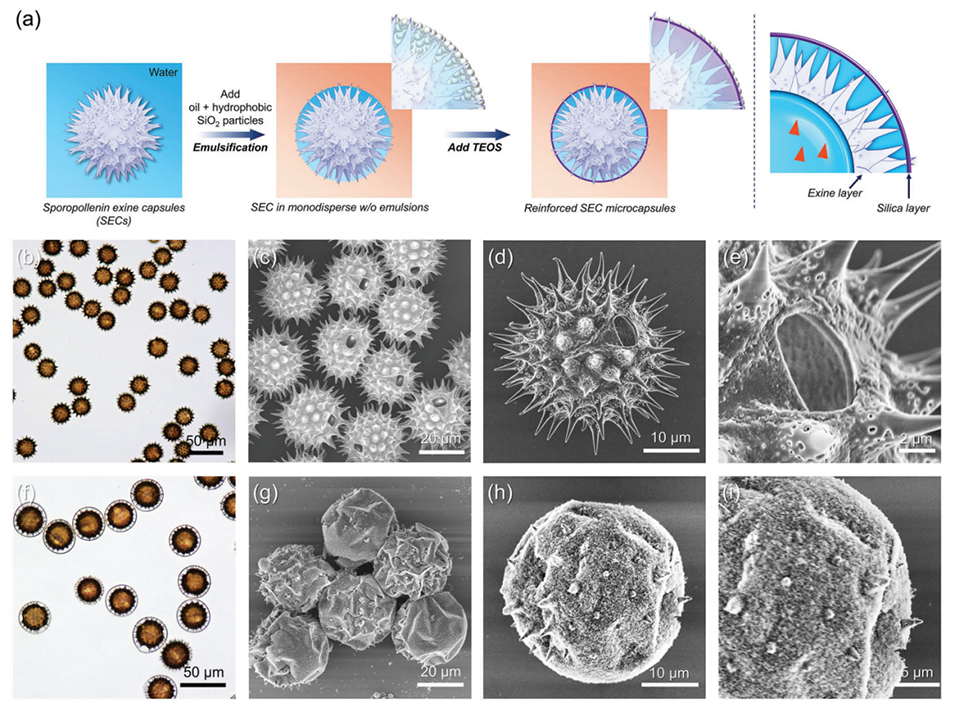
图6:a为使用SECs制备单分散“蛋黄-壳”微胶囊的工艺流程图;b-c为SECs的光学显微图像与SEM图像,显示表面微孔;d-e为具有大孔径的单个SEC的SEM细节;f为单分散“蛋黄-壳”微胶囊的光学显微图像;g为“蛋黄-壳”微胶囊的SEM图像;h-i为单个“蛋黄-壳”微胶囊的SEM图像。
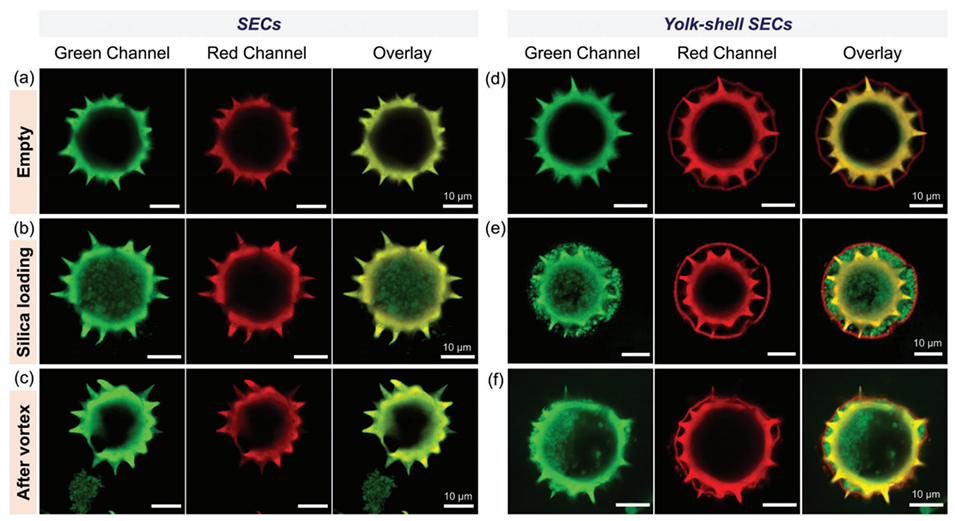
图7:a-c为空SECs、负载300 nm二氧化硅颗粒的SECs以及涡旋后二氧化硅负载SECs的CLSM图像;d-f为空“蛋黄-壳”SECs、负载300 nm二氧化硅颗粒的“蛋黄-壳”SECs以及涡旋后二氧化硅负载“蛋黄-壳”SECs的CLSM图像。FSS标记的二氧化硅颗粒(绿色)用作模型货物。SECs分散在水中,“蛋黄-壳”SECs分散在油中。
论文链接:https://doi.org/10.1002/adfm.202316510














