
开发无载体全活性纳米平台以发挥有效的肿瘤治疗作用并预防肿瘤复发仍然是一项具有挑战性的任务。近期,东华大学史向阳教授团队采用微流控技术合成了一种无载体全活性金属-酚纳米胶囊(GFT NCs),用于肿瘤的磁共振成像及化疗-化学动力学-免疫联合治疗。相关研究以“Microfluidic Synthesis of Carrier-Free Full-Active Metal-Phenolic Nanocapsules for Tumor Chemo-Chemodynamic-Immune Therapy”为题目,发表在期刊《Advanced Functional Materials》上。
本文要点:
1、本研究通过微流控合成了一种自组装无载体棉酚(Gos)-铁离子(Fe3+)-丰加霉素(Toy)纳米胶囊(GFT NCs),用于肿瘤的磁共振成像和化学-化学动力学-免疫联合治疗。
2、构建的平均直径为101.9 nm的GFT NCs在酸性条件下显示出理想的胶体稳定性、均匀性、pH响应性药物释放特性和增强的r1弛豫率(3.71 mm−1s−1)。
3、GFT NCs通过协同Gos诱导的线粒体功能障碍、Fe3+介导的化学动力疗法和Toy扩增的内质网应激,诱导明显的免疫原性细胞死亡,从而有效抑制肿瘤生长和转移,同时触发有效的抗肿瘤免疫。
4、将GFT NCs与程序性细胞死亡配体1抗体联合使用,可以显著增强免疫激活并建立肿瘤特异性免疫记忆效应,从而预防肿瘤复发。
5、与临床T1 MR成像对比剂Magnevist相比,GFT NCs在等效的体内铁或镓浓度下显示出更优的肿瘤T1加权MR成像效果。
6、总之,本研究开发的GFT NCs代表了一种潜在的无载体全活性纳米药物制剂,可用于不同类型肿瘤的多模式增强免疫治疗。
使用无载体的全活性纳米制剂在肿瘤治疗中具有以下优势:
1、提高药物载量和递送效率:无载体的纳米制剂由活性成分自组装而成,可以实现更高的药物载量和更有效的肿瘤靶向递送。
2、减少毒副作用:无需载体材料,可以降低免疫原性和毒性,提高生物相容性和安全性。
3、协同增强治疗效果:通过协同作用,如化疗、化学动力学疗法和免疫疗法,实现更强的抗肿瘤活性。
4、提高制备质量:采用微流控技术可以精确控制纳米制剂的尺寸、形貌和组成,制备出高质量、均一性好的纳米制剂。
5、有利于临床转化:无载体的全活性纳米制剂具有更好的生物相容性和安全性,有利于推进肿瘤临床治疗及转化应用。
总之,无载体的全活性纳米制剂在提高治疗效果、降低毒副作用、增强制备质量和促进临床转化等方面具有显著优势,是一种有前景的肿瘤治疗新策略。
GFT NCs在肿瘤微环境中的具体作用机制如下:
1、化学动力治疗(CDT):GFT NCs中的Fe3+与肿瘤微环境中的H2O2发生芬顿反应,产生高毒性的羟基自由基(·OH),诱导癌细胞凋亡。
2、免疫原性细胞死亡(ICD):GFT NCs诱导的ICD通过释放损伤相关分子模式(DAMPs),激活树突状细胞(DCs)和细胞毒性T淋巴细胞,增强抗肿瘤免疫反应。
3、线粒体功能障碍:GFT NCs中的Gos诱导线粒体功能障碍,增加ROS产生,促进癌细胞凋亡。
4、内质网应激(ERS)放大:GFT NCs中的Toy通过阻断IRE1α-XBP1途径加剧ERS,诱导癌细胞凋亡。
酸性肿瘤微环境如何影响GFT NCs的药物释放?
GFT NCs在酸性条件(pH 6.5)下表现出更高的Gos、Fe3+和Toy的累积释放,分别达到9%、14.2%和62.9%,而在生理pH 7.4条件下的释放量明显较低。
这是由于GFT NCs中的金属-酚类配位键在酸性环境下更容易断裂,从而促进了活性成分的释放。
酸性肿瘤微环境可以诱发GFT NCs的解离,使Gos、Fe3+和Toy等活性成分快速释放到肿瘤部位,而在血液循环中保持较高的稳定性,从而减少对正常组织的毒副作用。
这种pH响应性的药物释放行为有利于GFT NCs在肿瘤部位实现高效的化疗、化学动力学疗法和免疫治疗,提高治疗效果。
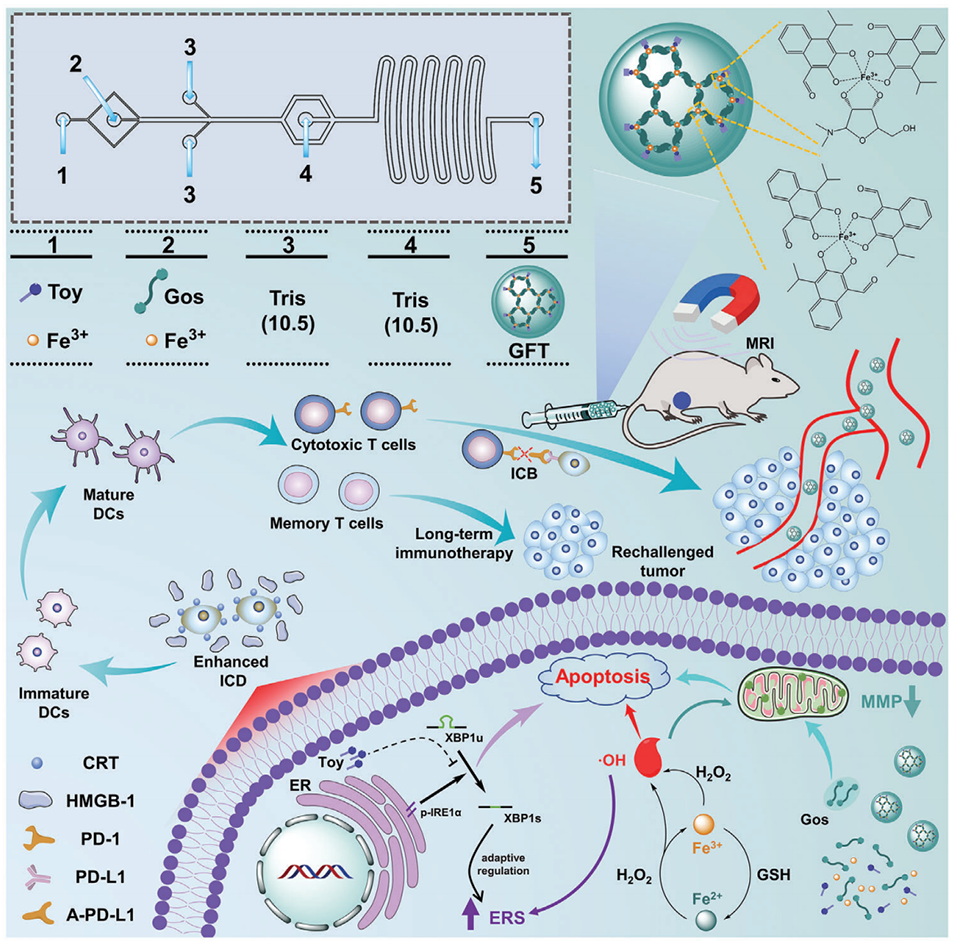
图1.微流体合成GFT NCs用于肿瘤治疗。
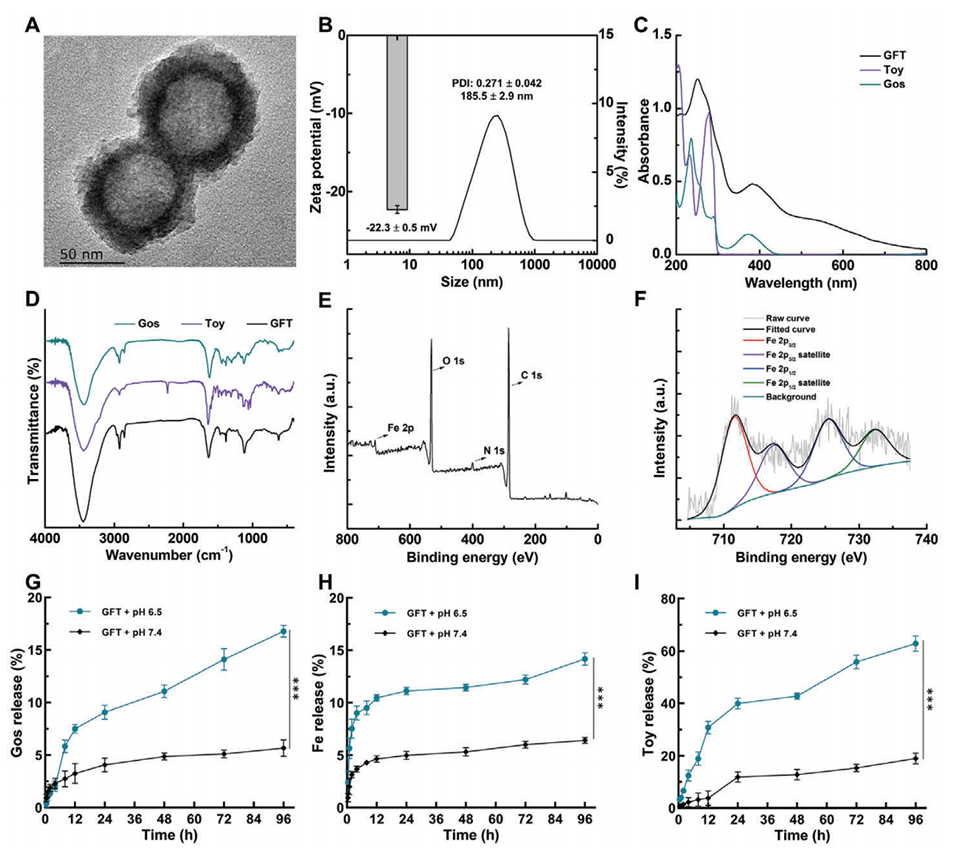
图2.GFT NCs的表征。
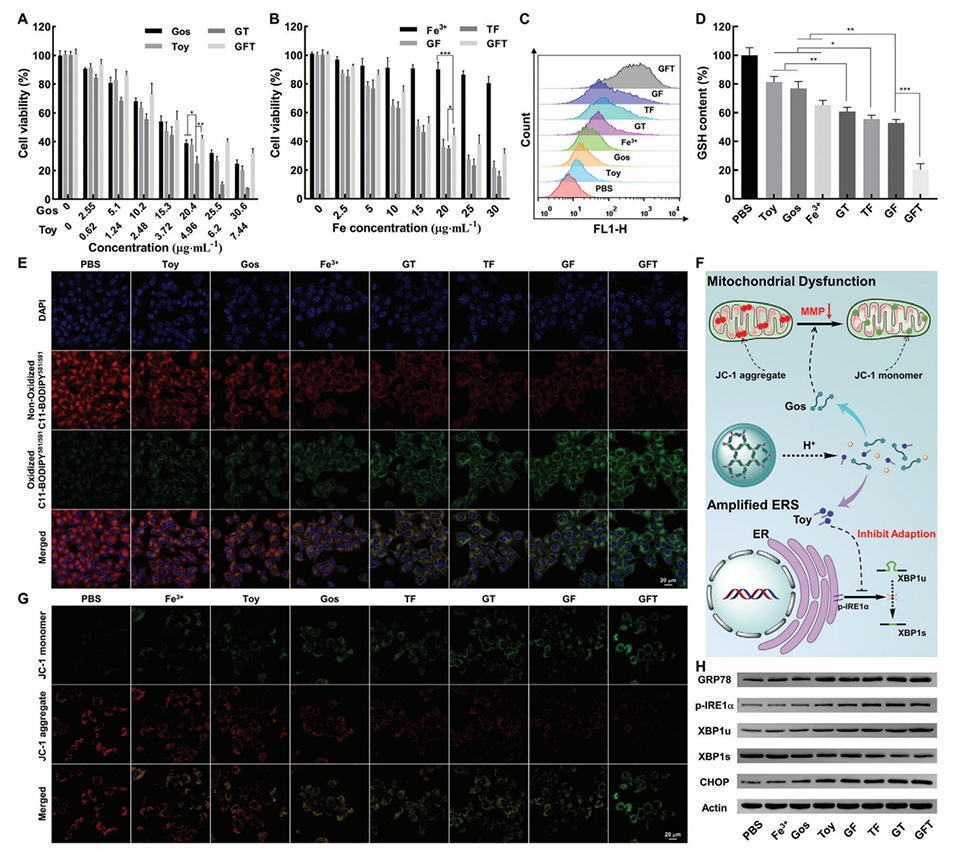
图3.GFT NCs在体外诱导ROS生成、线粒体功能障碍和放大的内质网应激(ERS)。
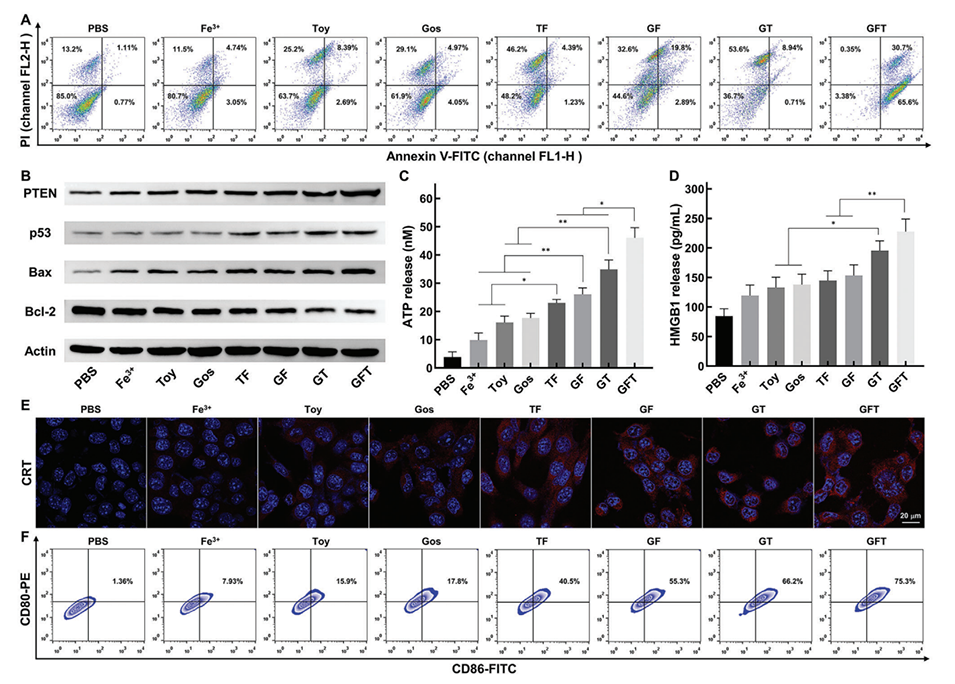
图4.GFT NCs体外诱导ICD(免疫原性细胞死亡)和DCs(树突状细胞)成熟。
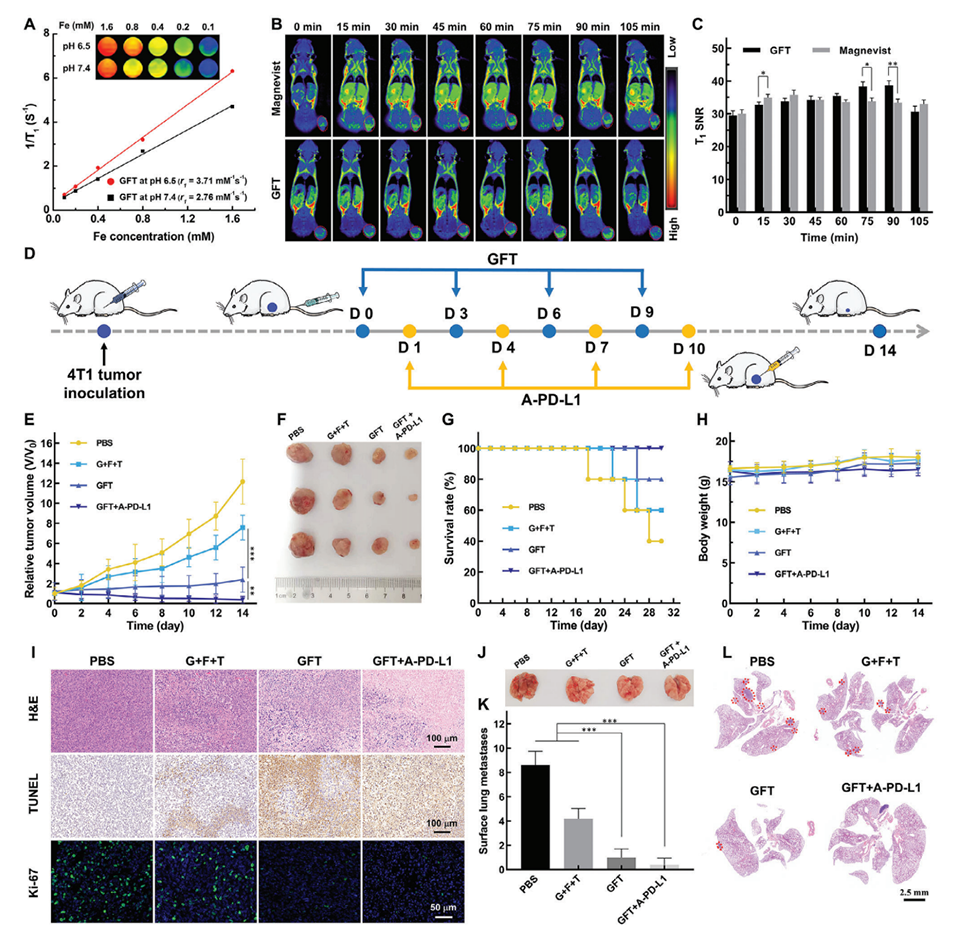
图5.使用开发的GFT NCs对4T1肿瘤进行MR成像和治疗。
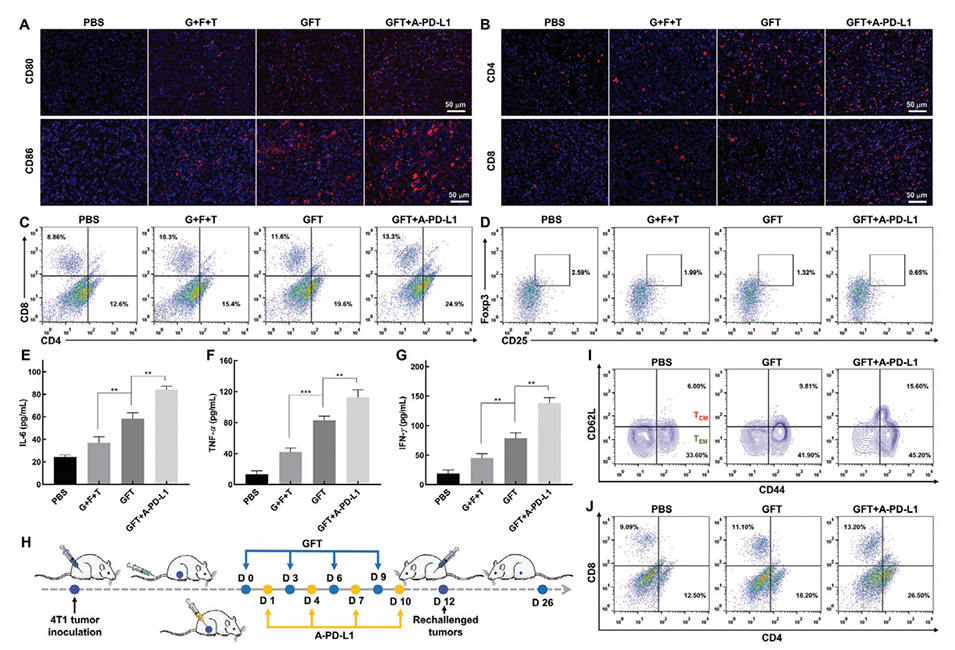
图6.GFT NCs联合A-PD-L1的抗肿瘤免疫反应和肿瘤特异性免疫记忆效应。
论文链接:https://doi.org/10.1002/adfm.202417070














