
成骨微环境(OME)显著影响骨修复,然而,再现其动态激活和修复过程仍然具有挑战性。近期,南京大学医学院附属鼓楼医院秦晓东教授、朱泽章教授、刘臻教授等人开发了一种复合肽修饰的微流控微球,通过序贯激活成骨微环境促进骨再生,为治疗难治性骨缺损提供了新策略。相关研究以“Sequential activation of osteogenic microenvironment via composite peptide-modified microfluidic microspheres for promoting bone regeneration”为题目,发表在期刊《Biomaterials》上。
本文要点:
1、本研究设计了一种可注射的复合肽修饰多孔微球,以研究成骨微环境(OME)的级联变化及其潜在机制。
2、采用微流控技术制备的聚L-乳酸微球经表面改性,通过非均相接枝牛血清白蛋白纳米颗粒和干细胞趋化肽(BNP@SKP)以及BMP-2模拟肽(P24),实现了肽的初始释放和原位固定。
3、细胞实验显示,这些微球对间充质干细胞的趋化招募和成骨分化有不同程度的影响。
4、进一步的生物学分析显示,BNP@SKP通过靶向Ras/Erk轴上调基质金属蛋白酶(MMP)2和MMP9的表达,从而增强初始趋化和招募。
5、体内研究验证了以微球为中心的动态调控OME的建立,导致干细胞募集增加,分化微环境的序贯激活,并促进了原位成骨而无异位骨化。
6、该研究成功制备了复合肽修饰微球,并系统探讨了非均相接枝信号分子序贯激活OME实现骨形成的机制,为基于微环境调节的生物材料提供了理论依据。
复合肽修饰的微球通过多种机制影响间充质干细胞(MSC)的行为,具体如下:
1、化学趋化:微球表面修饰的肽(如SKP和P24)能够有效吸引MSC到达骨损伤部位。实验表明,修饰微球的存在显著提高了MSC的迁移能力,尤其是在P-P24@SKP组中,MSC的迁移数量比对照组高出三倍。
2、促进骨生成分化:微球通过释放BMP-2模仿肽(P24)和其他信号分子,激活MSC的骨生成分化。体外实验显示,MSC在P-P24@SKP微球上培养后,表现出更高的碱性磷酸酶(ALP)活性和矿化能力,表明其骨生成能力增强。
3、信号通路激活:复合肽修饰的微球通过靶向Ras/Erk信号通路,促进MMP2和MMP9的表达,这些基质金属蛋白酶在细胞迁移和骨基质重塑中起重要作用。
4、微环境调节:微球的动态释放和原位固定机制能够模拟生理性骨生成过程,建立一个有利于MSC活动的动态骨生成微环境(OME)。这种微环境调节促进了MSC的招募、分化和骨基质的重塑。
综上所述,复合肽修饰的微球通过促进MSC的趋化、增强其骨生成分化能力以及调节相关信号通路,显著影响了MSC的生物行为,为骨再生提供了有效的策略。
微流控技术在复合肽修饰微球的制备中相比传统方法具有以下优势:
1、尺寸均一性:微流控技术通过精确控制流体流速和剪切力,制备出的微球具有高度均一的尺寸分布,避免了传统乳化法中尺寸不均的问题。
2、结构可控性:微流控技术可以设计多层次或核壳结构的微球,支持信号分子的分区加载和序贯释放。
3、高效功能化:在微流控平台上,微球制备与表面修饰可以同步完成,显著提高了复合肽接枝的效率和均匀性。
4、绿色环保:微流控技术使用的试剂量少,反应条件温和,减少了化学废弃物的产生。
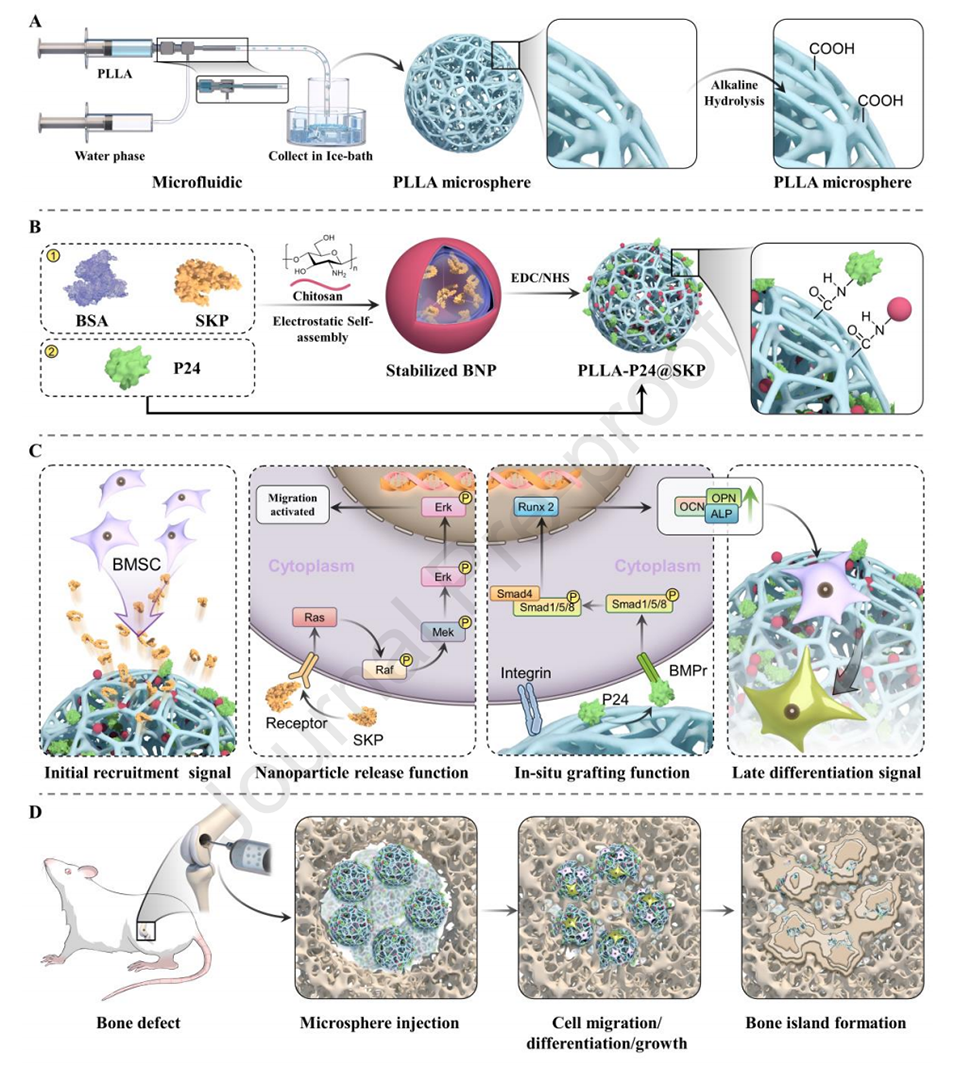
图1.微球结构和应用示意图。
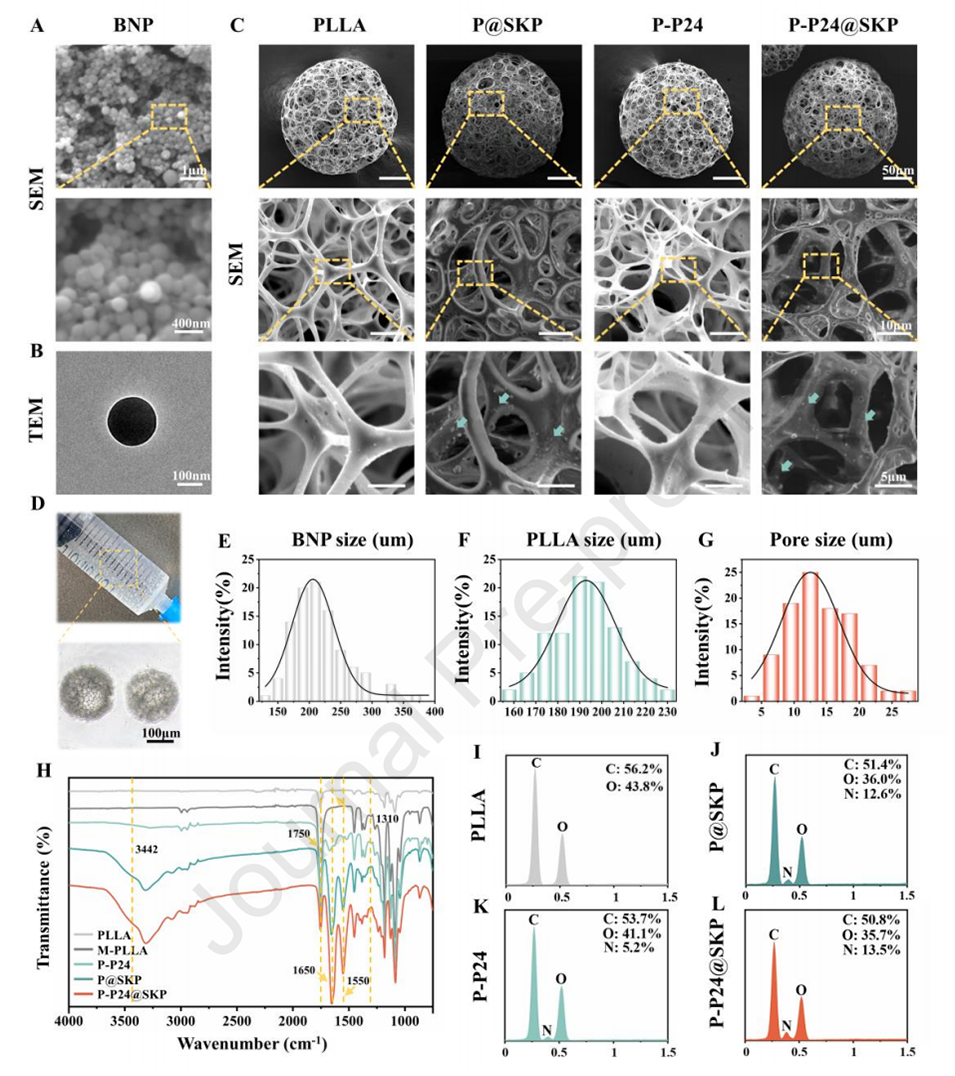
图2.微球和纳米粒子的形态和表征。
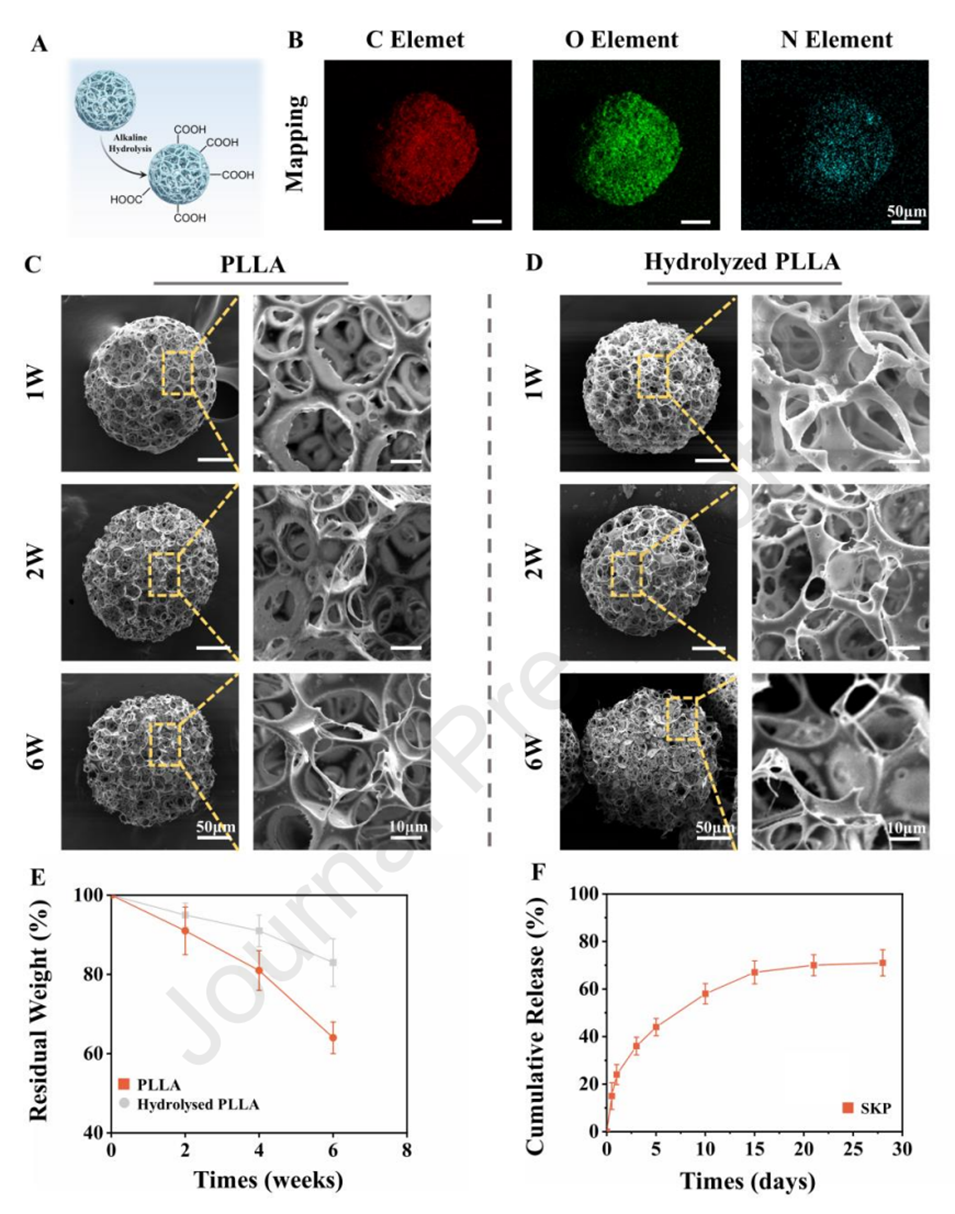
图3.微球的水解、降解和释放曲线。
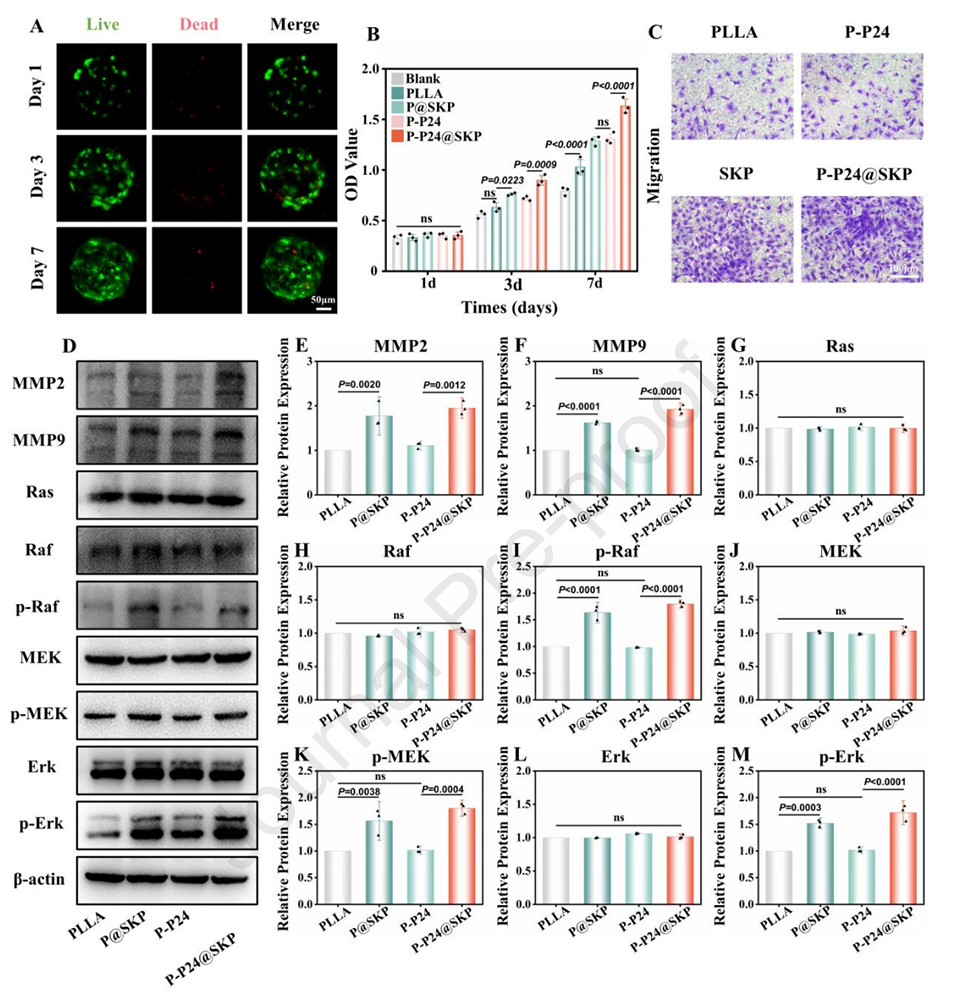
图4.微球/BMSCs的生物相容性及趋化机制。
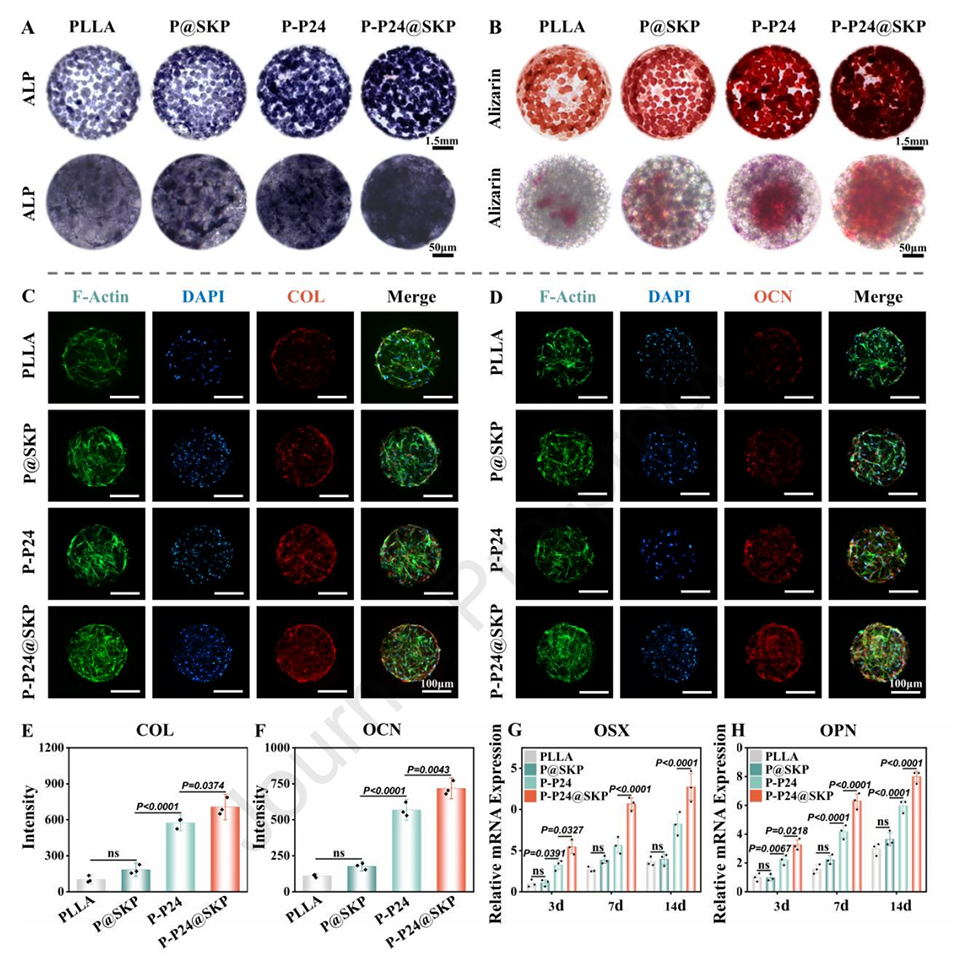
图5.微球/BMSCs的成骨分化。
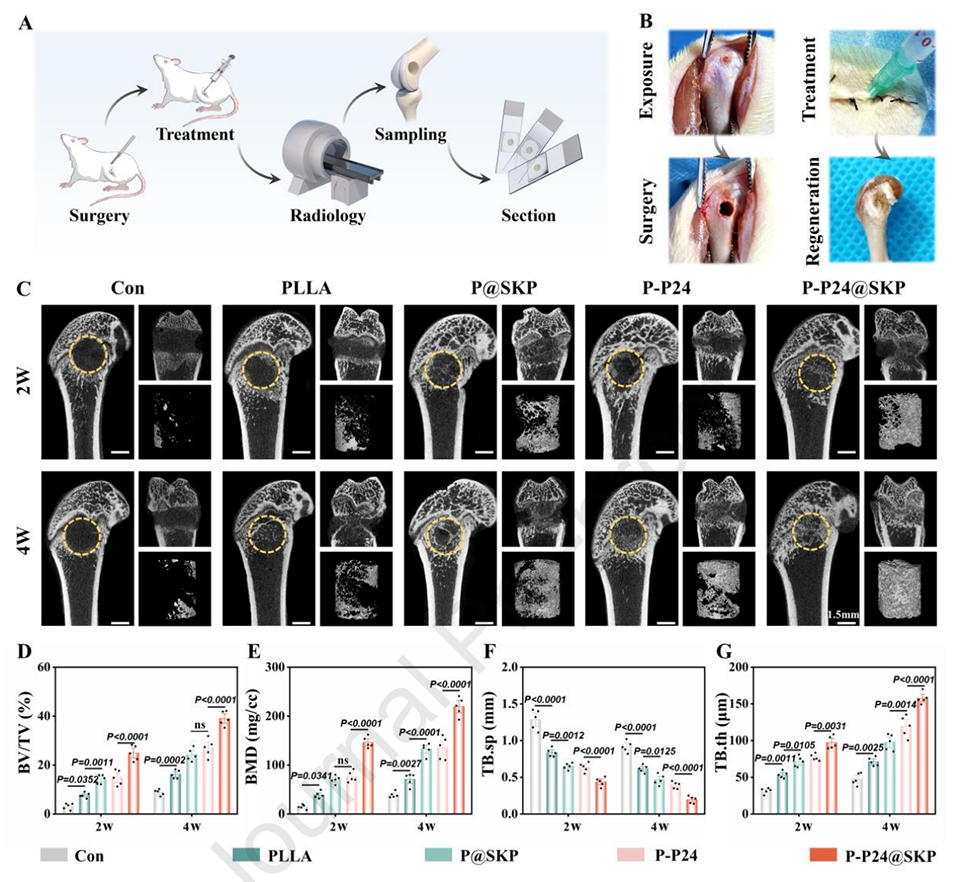
图6.微球治疗和新骨形成的形态学评估。
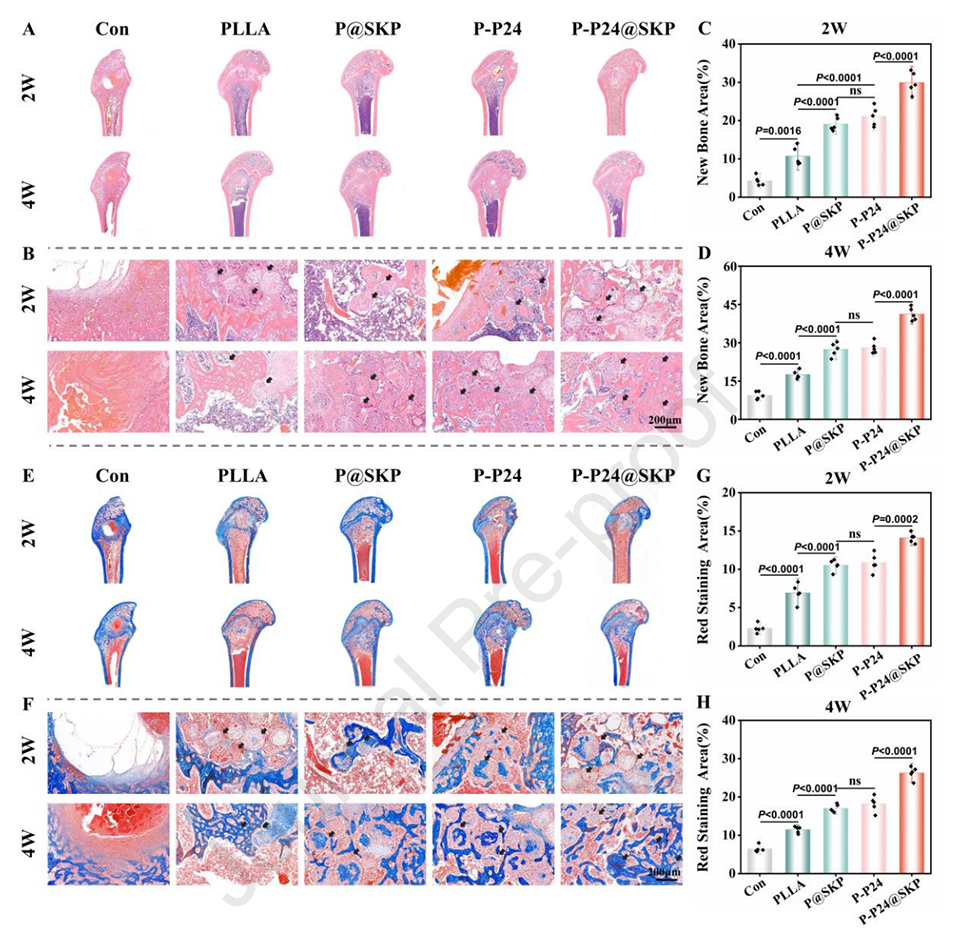
图7.组织学分析。
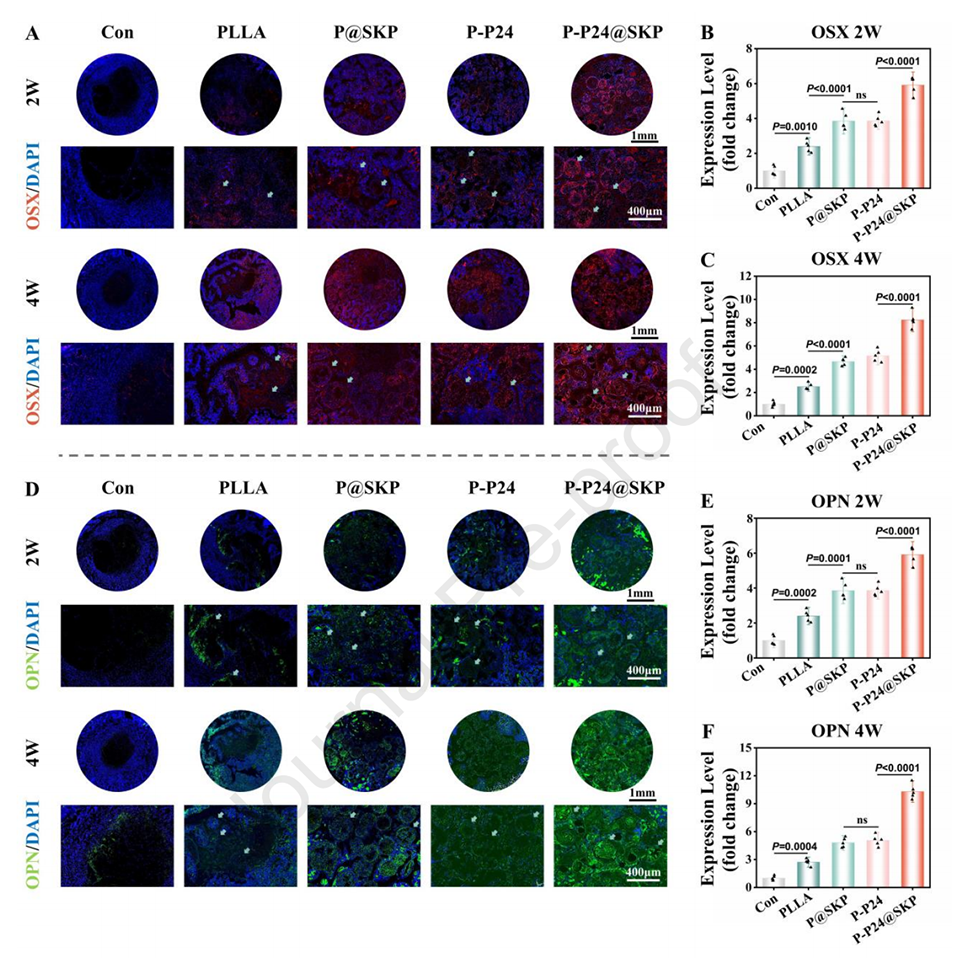
图8.免疫荧光染色。
论文链接:https://doi.org/10.1016/j.biomaterials.2024.122974














