在核酸治疗领域,如何有效递送大分子和不稳定的核酸药物(如mRNA和pDNA)一直是一个挑战。脂质纳米颗粒(LNPs)作为一种有效的递送系统,广泛应用于核酸药物的输送。然而,传统的微流控技术在LNP制备中存在设备昂贵、操作复杂等问题,限制了其广泛应用。

近期,复旦大学戚建平教授、杨金龙博士等人开发了一种基于深共熔溶剂(DES)的即用型脂质纳米颗粒(RULNP)技术,通过物理混合和水合实现纳米颗粒的快速自组装,克服了传统微流控技术的高成本和复杂性,同时实现了与传统脂质纳米颗粒相当的递送效率。相关研究以“Developing a Ready-to-Use Lipid Nanoparticle Technology for Nucleic Acid Delivery Based on Deep Eutectic Solvents”为题目,发表在期刊《Nano Letters》上。
本文要点:
1、本研究开发了一种基于深共熔溶剂(DES)的即用型脂质纳米颗粒(RULNP)技术,用于核酸递送。
2、DES由果糖和甘油组成,能够溶解脂质和核酸,通过简单的物理混合和水合形成RULNP,避免了与微流体方法相关的高成本和有机溶剂。
3、RULNP在物理化学性质和质粒DNA(pDNA)或RNA递送效率方面与传统脂质纳米颗粒(LNP)相当。
4、机制研究表明,尽管RULNP的内含体逃逸能力有限,但其细胞摄取能力优于LNP。
5、总之,基于DES的RULNP系统提供了一种快速、简便的脂质纳米颗粒生产方法,有望彻底改变核酸药物输送。
使用深共熔溶剂(DES)制备脂质纳米颗粒(LNPs)的具体步骤如下:
1、选择和制备DES:选择合适的深共熔溶剂,通常由氢键供体(如果糖)和氢键受体(如甘油)组成,形成稳定的液体。
2、溶解脂质和核酸:将脂质和核酸(如质粒DNA或RNA)溶解在DES中,形成核酸-脂质-DES(NLDES)复合物。此过程依赖于氢键的相互作用。
3、自组装过程:
直接水合:通过简单的物理混合和水合过程,将NLDES与水混合,促进纳米颗粒的自组装。
超声或涡旋处理:使用超声波或涡旋搅拌来促进自组装,确保形成均匀的纳米颗粒。
4、去除多余水分:在制备过程中,可以添加水以降低DES的粘度,随后通过真空干燥去除多余的水分,确保最终水分含量低于10%,以保护DES的结构并避免核酸水解。
5、表征和优化:通过动态光散射(DLS)等方法分析纳米颗粒的粒径和聚合度,优化DES与脂质和核酸的比例,以获得最佳的纳米颗粒特性。
6、储存和运输:根据需要,可以选择共制备或分开制备的方法,以适应不同的应用场景,确保在储存和运输过程中保持纳米颗粒的稳定性和有效性。
通过以上步骤,可以有效地利用DES制备出具有良好生物相容性和药物递送能力的脂质纳米颗粒。
使用DES制备脂质纳米颗粒的关键优势包括:
1、成本效益:基于DES的制备过程简单且使用的材料通常较为廉价,避免了微流控技术中所需的昂贵设备和有机溶剂,从而降低了生产和维护成本。
2、环境友好:DES主要由无毒材料(如糖、醇和氨基酸)组成,具有生物降解性,符合可持续发展的要求。
3、增强溶解性:DES通过与脂质和核酸形成氢键,对其进行有效溶解,提高药物的溶解度和细胞摄取效率。这种机制有助于保护核酸免受降解,并促进其在体内的有效传递。
4、灵活性:为了满足不同的应用场景,RULNPs可以通过共制备或分开制备的方法进行制备,便于储存和运输。
5、较好的细胞摄取能力:尽管RULNPs在内含体逃逸能力上有限,但其细胞摄取能力优于传统LNPs,确保了有效的核酸递送。
综上所述,DES为脂质纳米颗粒的制备提供了一种简便、经济且有效的替代方案,具有广泛的应用潜力。
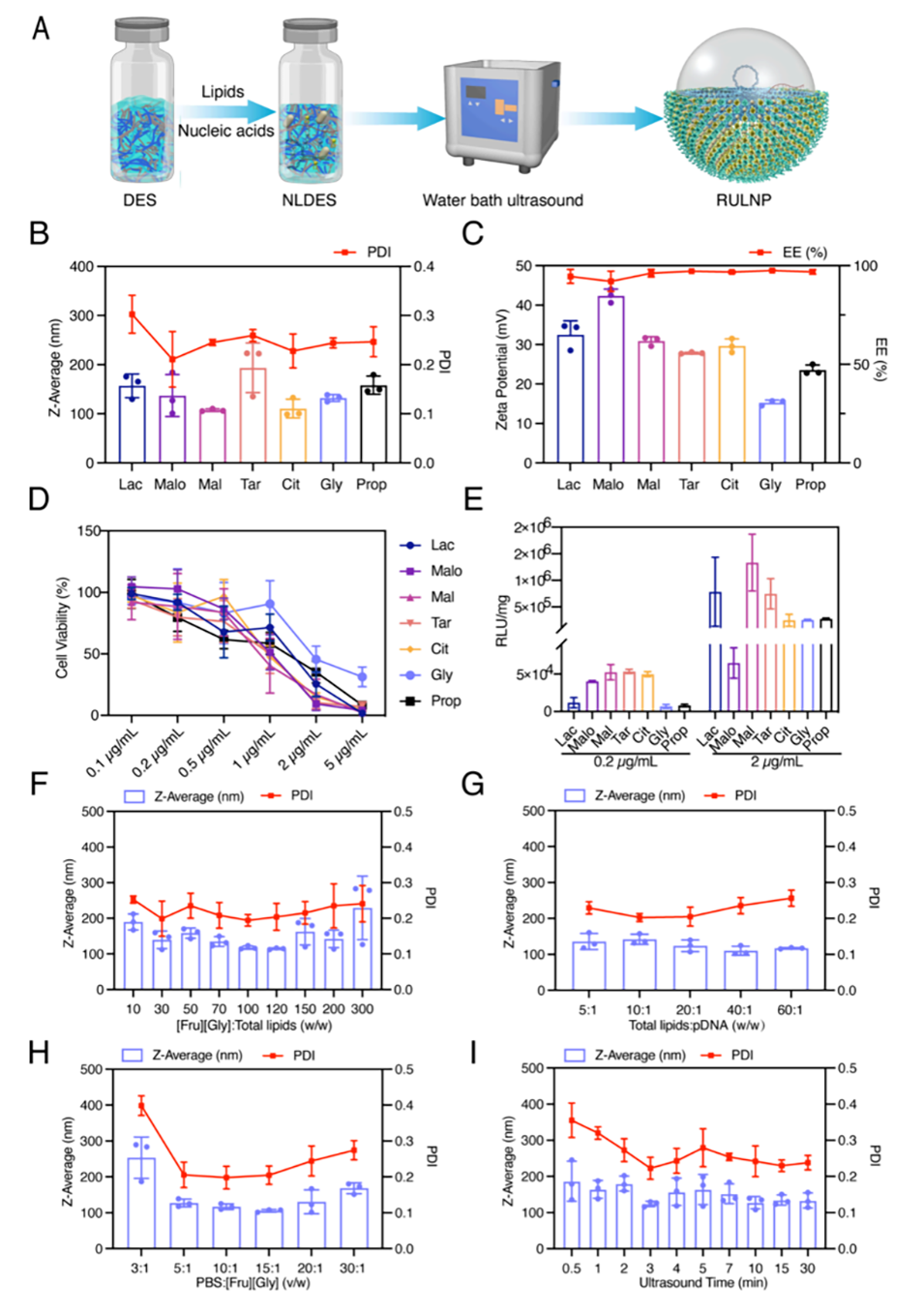
图1.负载pDNA的阳离子RULNPs的工艺过程开发。
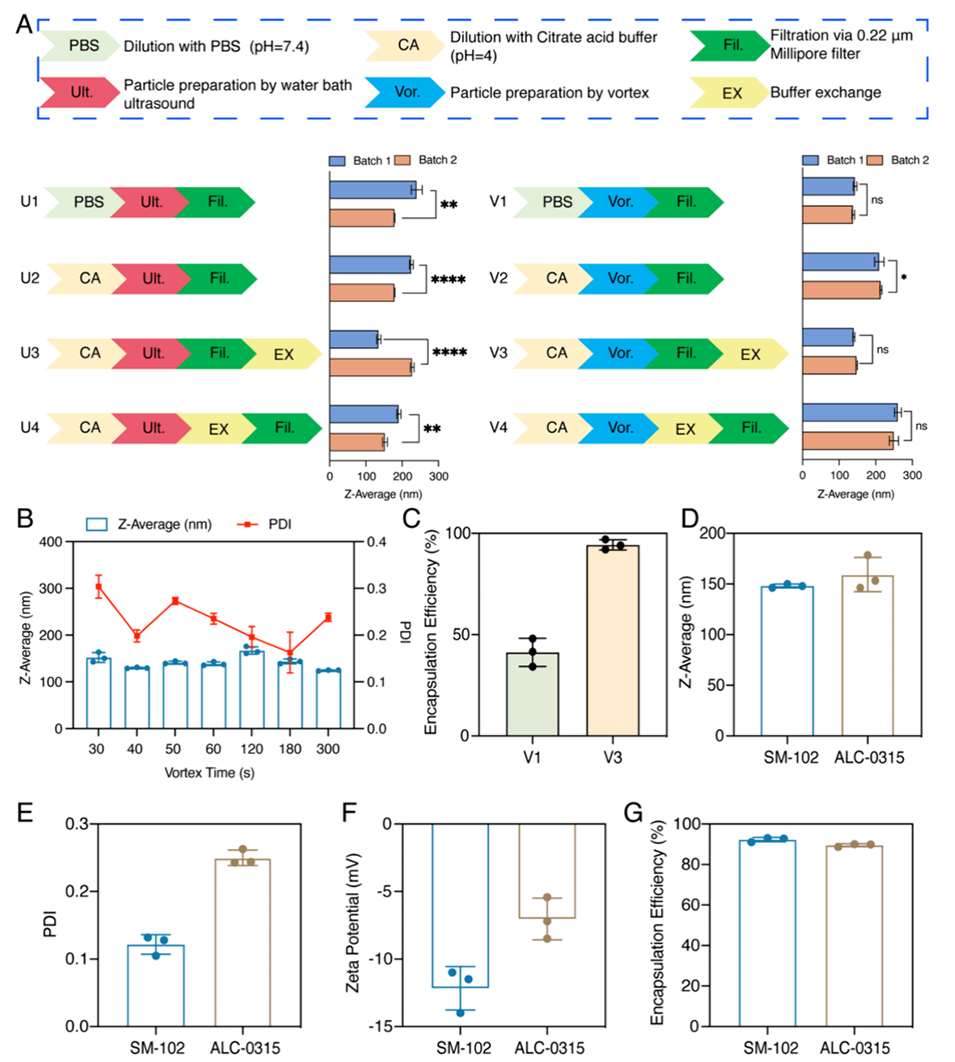
图2.负载pDNA的可电离RULNPs的工艺过程开发。
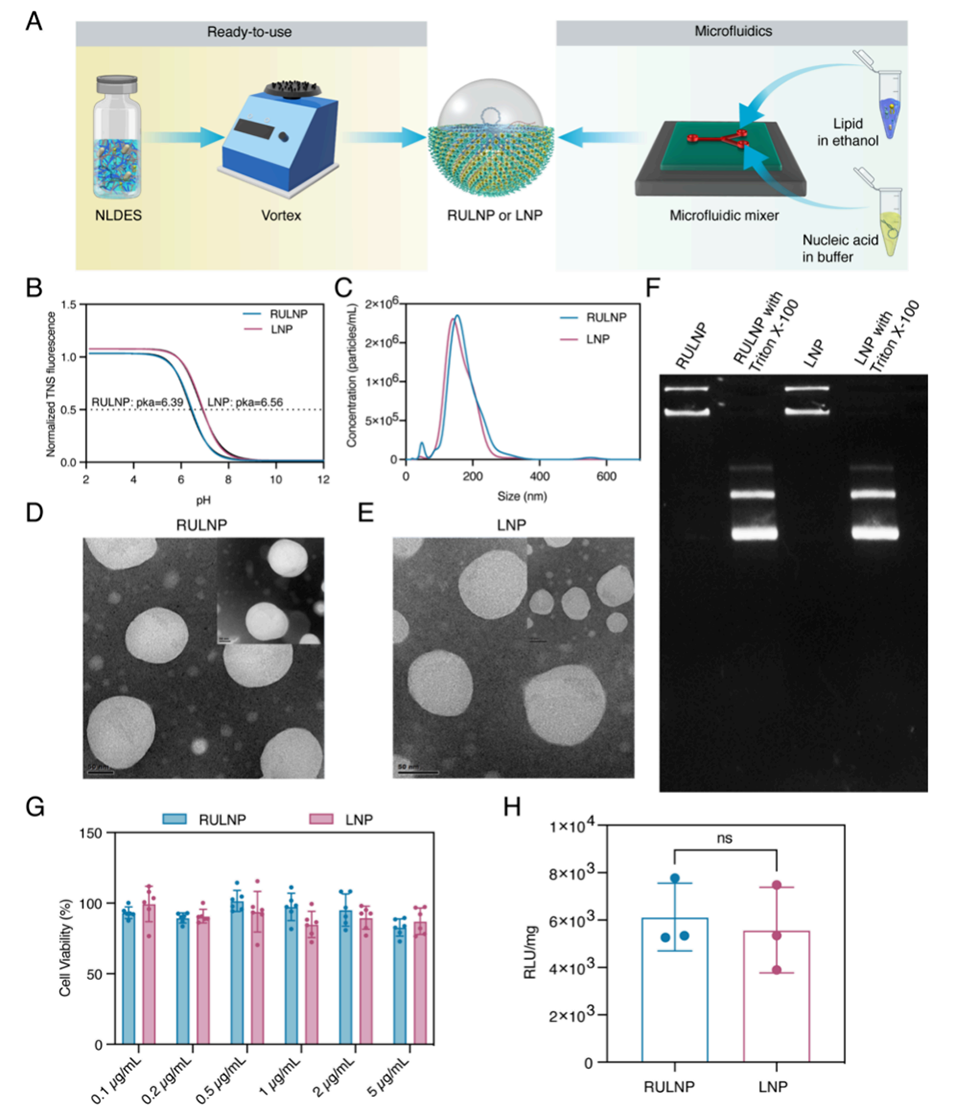
图3.RULNPs和LNPs的比较。
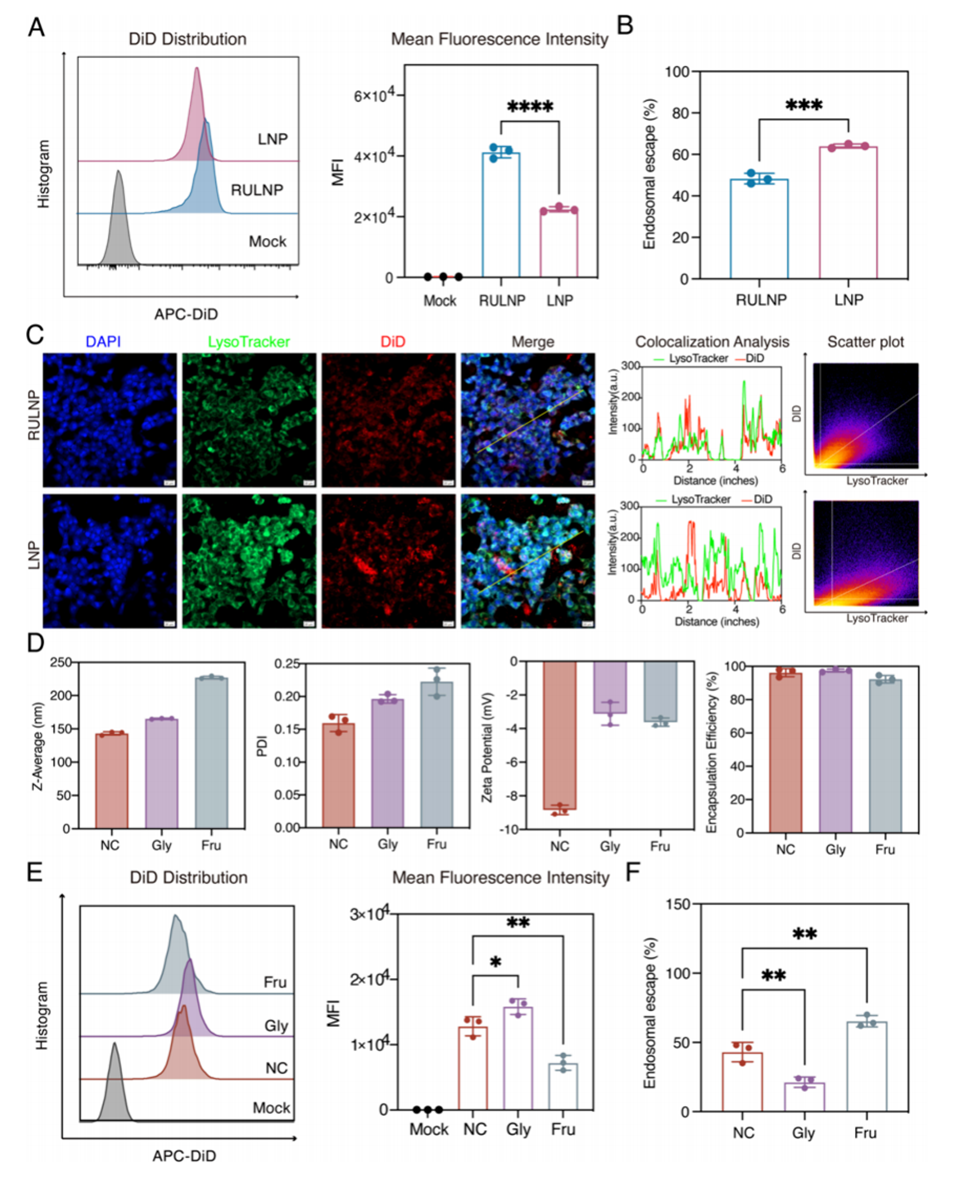
图4.RULNPs在细胞摄取和内含体逃逸中的机制研究。
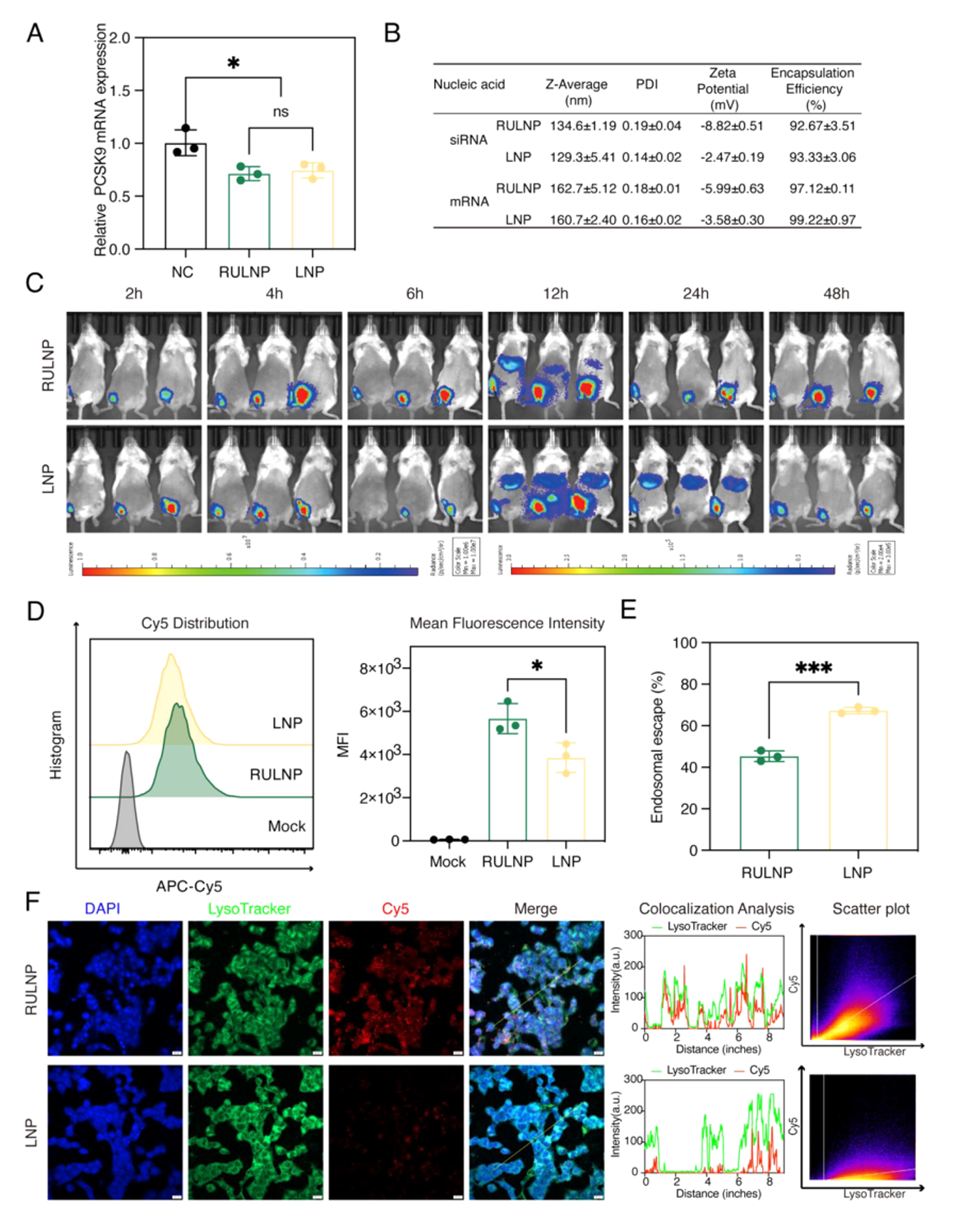
图5.RULNPs在RNA递送中的应用。
论文链接:https://doi.org/10.1021/acs.nanolett.4c04665














