
导读:
由于肌腱固有的再生能力有限,其损伤修复仍具挑战。近期,四川大学华西医院解慧琪教授、张晖教授团队开发了一种基于小肠黏膜下层水凝胶(SIS)与海藻酸钠微球(SA)的双相缓释复合材料,通过分阶段释放SDF-1α和BMP-12,有效招募肌腱源性干细胞并促进其成腱分化。该材料在体内外实验中展现出显著的免疫调节功能、胶原有序沉积及力学性能恢复,为解决肌腱再生中细胞募集不足与分化失控的难题提供了创新策略。相关研究以“SDF-1α/BMP-12 loaded biphasic sustained-release SIS hydrogel/SA microspheres composite for tendon regeneration”为题目,发表在期刊《Biomaterials》上。
本文要点:
1、本研究开发了一种负载基质细胞衍生因子-1α(SDF-1α)和骨形态发生蛋白-12(BMP-12)的小肠黏膜下层水凝胶/海藻酸钠微球(SIS/SA)复合材料,用于分阶段调控肌腱再生。
2、采用微流控技术制备BMP-12负载的SA微球,并将其嵌入SDF-1α负载的SIS水凝胶中,以实现可控的时空释放,模拟自然愈合过程。
3、复合材料在炎症阶段快速释放SDF-1α,招募肌腱干细胞(TDSCs)至损伤部位,而SIS则充当细胞粘附支架,释放生长因子以刺激血管生成并抑制巨噬细胞的M1过度极化。
4、在增殖阶段,持续的SDF-1α释放增强细胞增殖,BMP-12促进肌腱分化,SIS衍生的III型胶原支持早期修复。
5、在随后的重塑阶段,SIS衍生的I型胶原促进组织重塑,BMP-12调控I型胶原的合成并诱导巨噬细胞M2型极化,以维持ECM稳态,减少瘢痕形成。
6、体内外实验结果表明,该复合材料通过免疫调节、血管生成和细胞外基质合成等多种途径加速再生过程,为肌腱再生治疗提供了具有显著临床潜力的转化策略。
SDF-1α/BMP-12负载双相缓释SIS水凝胶/SA微球复合体系的制备过程如下:
1、采用微流控技术制备均匀的SA微球,并封装BMP-12
溶液配制:将BMP-12溶解于含Ca-EDTA的SA水溶液中(SA浓度2%-4%),作为水相。油相为氟化油(含2%表面活性剂)。
微流控生成微球:通过微流控芯片(通道宽度50-100 μm)控制水相与油相的流速比(通常为1:5),生成单分散液滴。
交联固化:液滴在流动过程中与Ca2+接触(通过外置CaCl2溶液扩散),形成交联的SA微球(粒径100-200 μm)。
纯化与保存:收集微球,用PBS洗涤去除残留油相,冷冻干燥后储存于4°C。
2、基于脱细胞SIS制备可注射水凝胶,并负载SDF-1α
SIS脱细胞处理:机械刮取猪小肠黏膜下层,依次用0.1% SDS和1% Triton X-100脱细胞,冻干后研磨成粉末。
酶解与凝胶化:将SIS粉末用胃蛋白酶(1 mg/mL,0.1 M HCl)在37°C下消化24小时,形成预凝胶溶液。
负载SDF-1α:将SDF-1α(100 ng/mL)加入预凝胶溶液中,混合均匀。
pH调节与成型:用NaOH调节pH至中性(7.4),诱导SIS分子自组装形成水凝胶(凝胶时间约10分钟)。
3、将SA微球嵌入SIS水凝胶中,形成双相缓释系统
微球分散:将冷冻干燥的BMP-12负载SA微球重新悬浮于PBS中,超声处理确保分散均匀。
复合混合:将BMP-12负载SA微球悬浮液与SIS/SDF-1α预凝胶溶液按比例混合(微球质量占比5%-10%)。
原位凝胶化:调节混合液pH至中性,注入模具或直接注射至损伤部位,37°C下静置10分钟完成凝胶化。
4、关键参数与质量控制
微球粒径控制:通过微流控芯片流速调节(水相0.1 mL/h,油相0.5 mL/h),确保粒径均一性(CV <5%)。
生长因子活性保留:SA微球交联时间≤30秒,避免BMP-12变性;SIS水凝胶低温(4°C)保存以减少SDF-1α降解。
复合均匀性验证:通过SEM观察微球在水凝胶中的分布,确保无聚集(间距50-100 μm)。
技术优势
时空控释:SDF-1α通过水凝胶快速释放(5天内释放80%),BMP-12通过微球缓释(>30天)。
仿生微环境:SIS提供天然ECM成分(I/III型胶原、生长因子),支持细胞黏附与迁移。
临床适配性:可注射特性适用于微创手术,原位凝胶化确保与损伤部位紧密贴合。
该合成流程通过精准的材料设计与工艺控制,实现了生长因子的分阶段释放,为肌腱再生提供了高效的“Cell-Free”治疗策略。
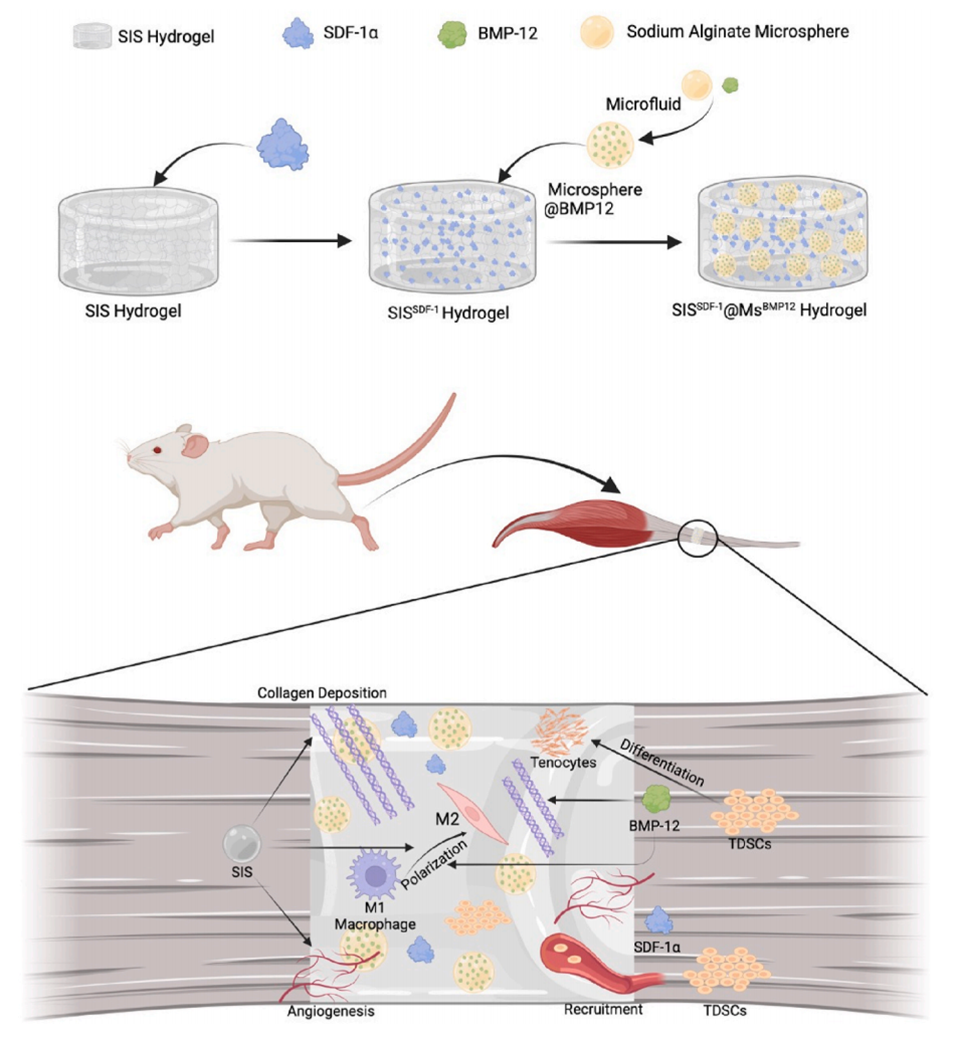
Scheme 1.SISSDF-1@MsBMP12复合体系的合成和功能示意图。
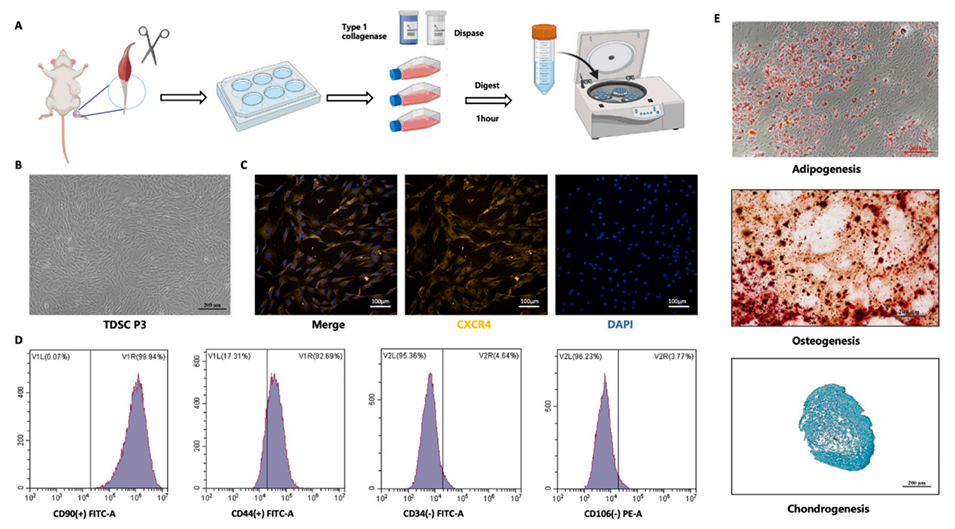
图1.TDSCs的分离、培养和鉴定。
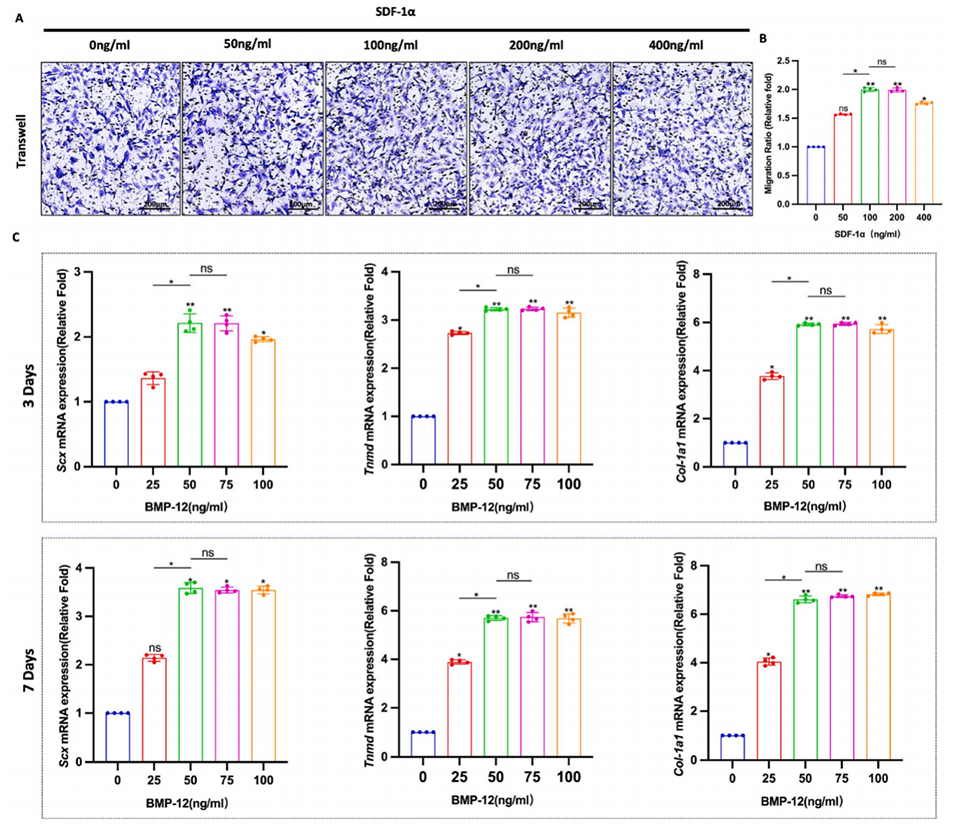
图2.SDF-1α和BMP-12的最佳浓度。
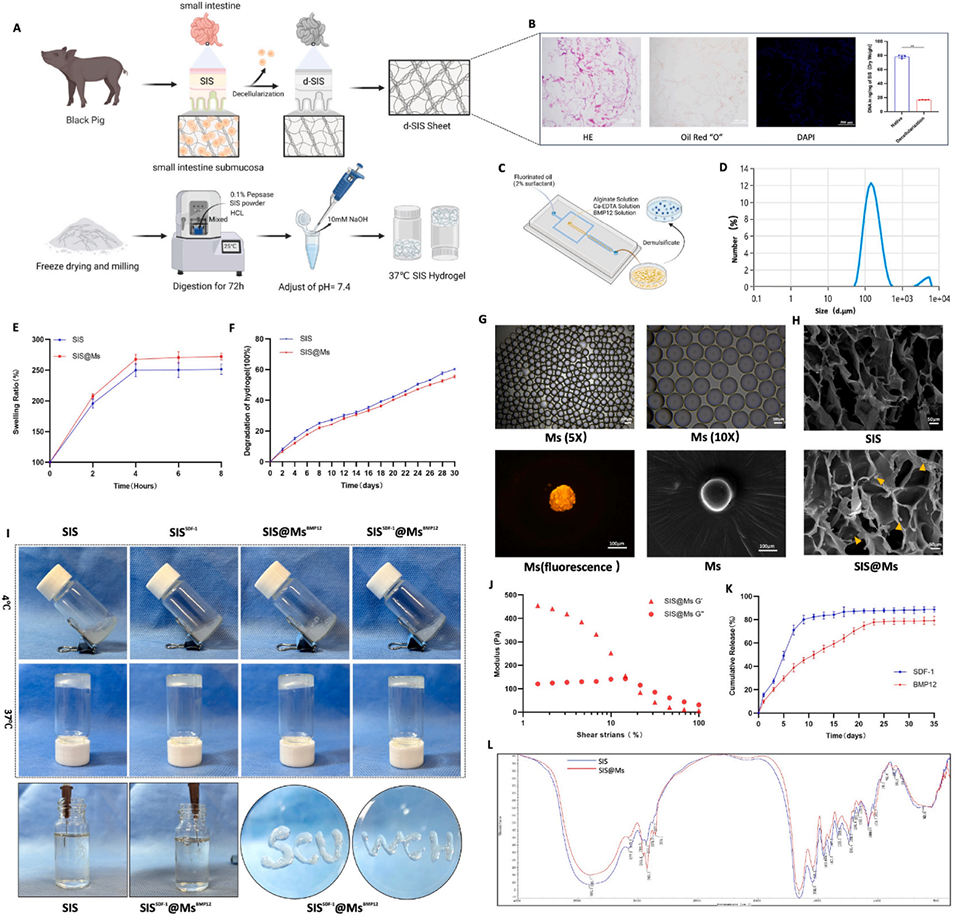
图3.复合材料的制备和表征。
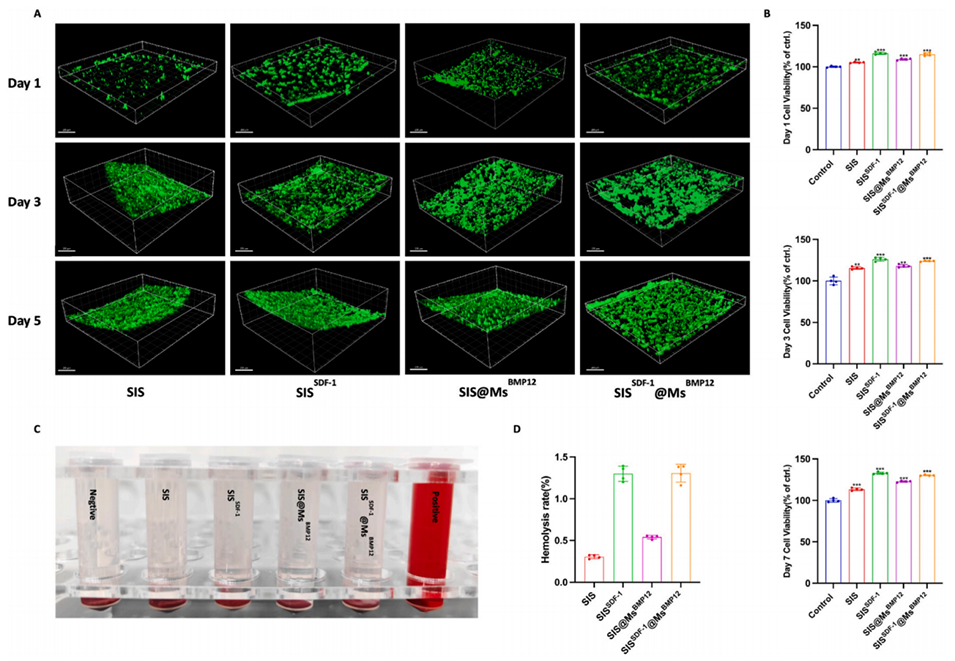
图4.复合材料的生物相容性。
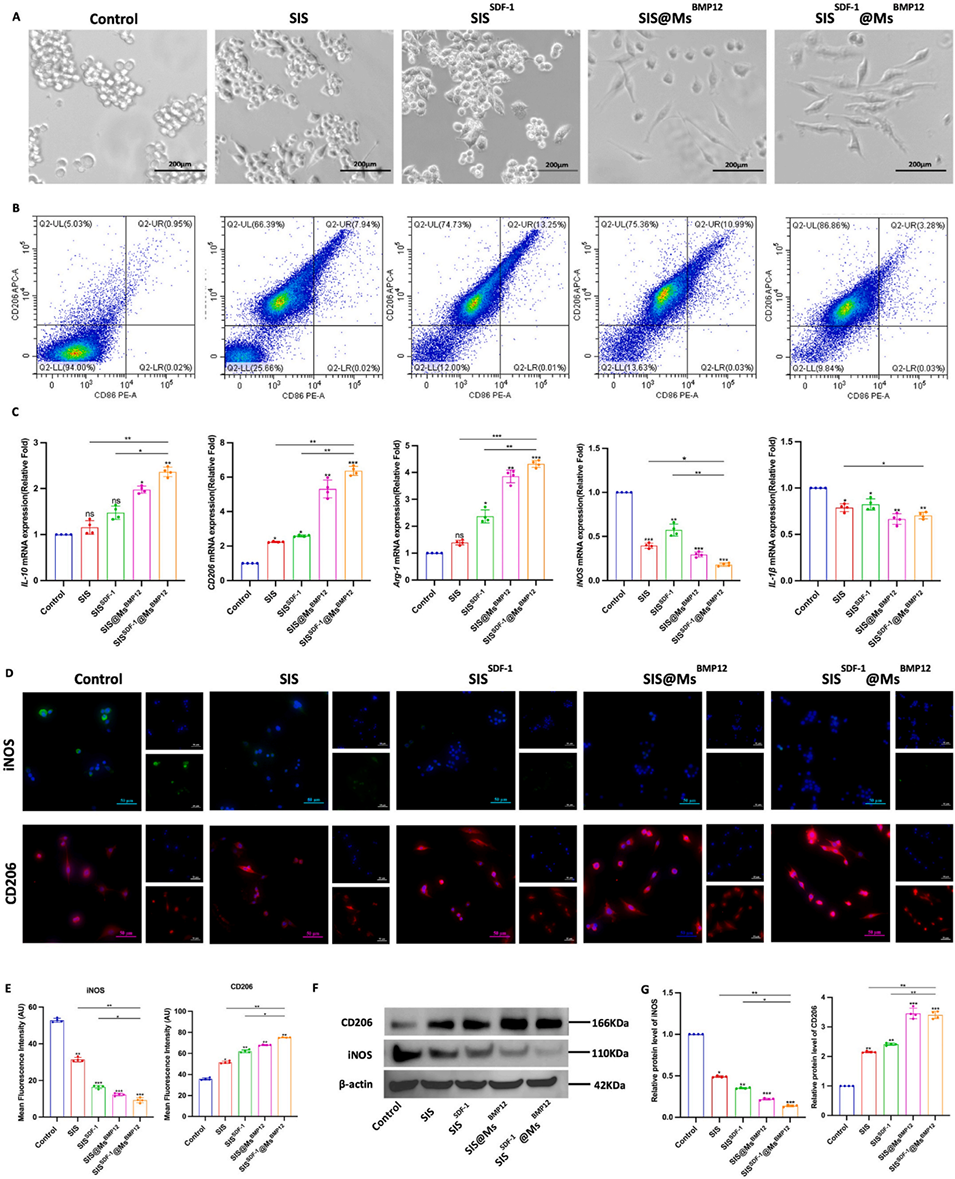
图5.RAW264.7 M2体外极化。
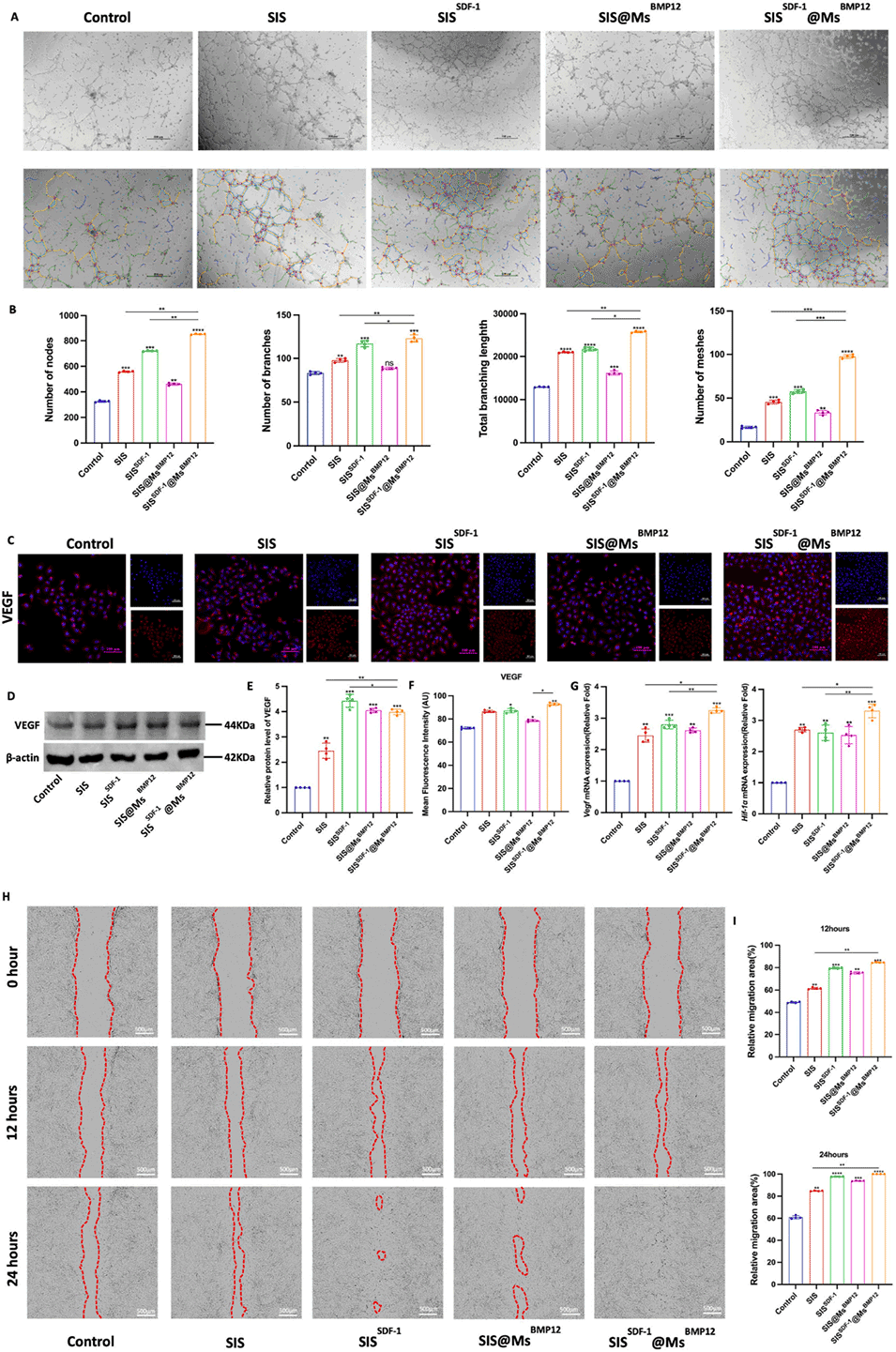
图6.体外血管生成和细胞迁移。
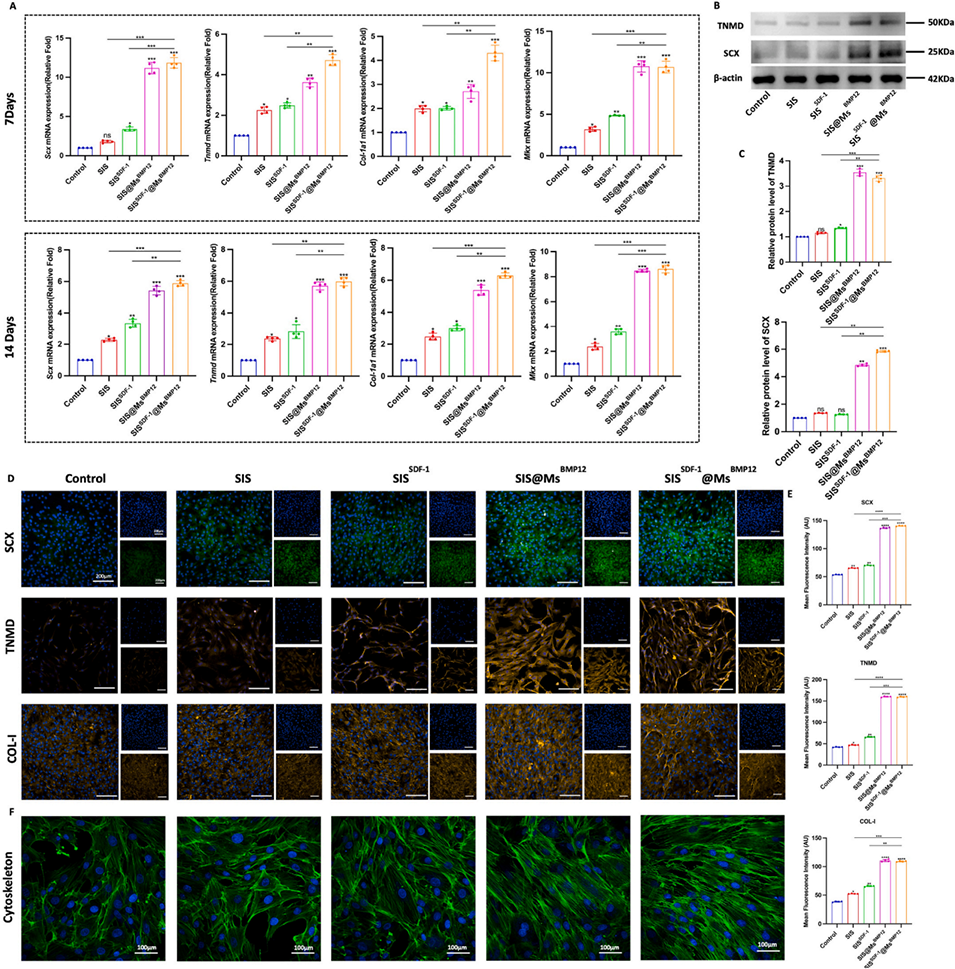
图7.TDSCs体外肌腱分化。
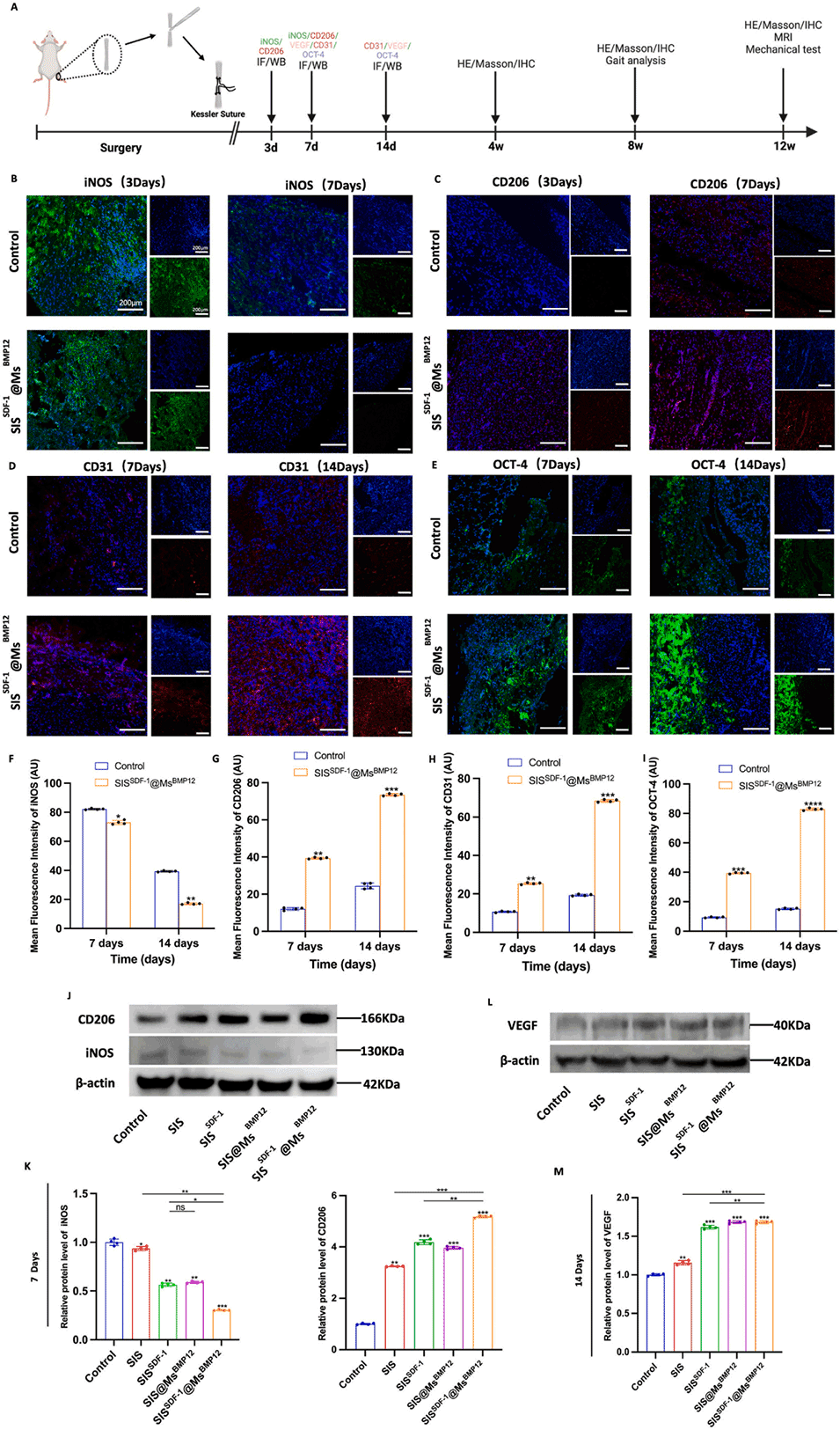
图8.体内免疫调节、血管生成和干细胞募集。
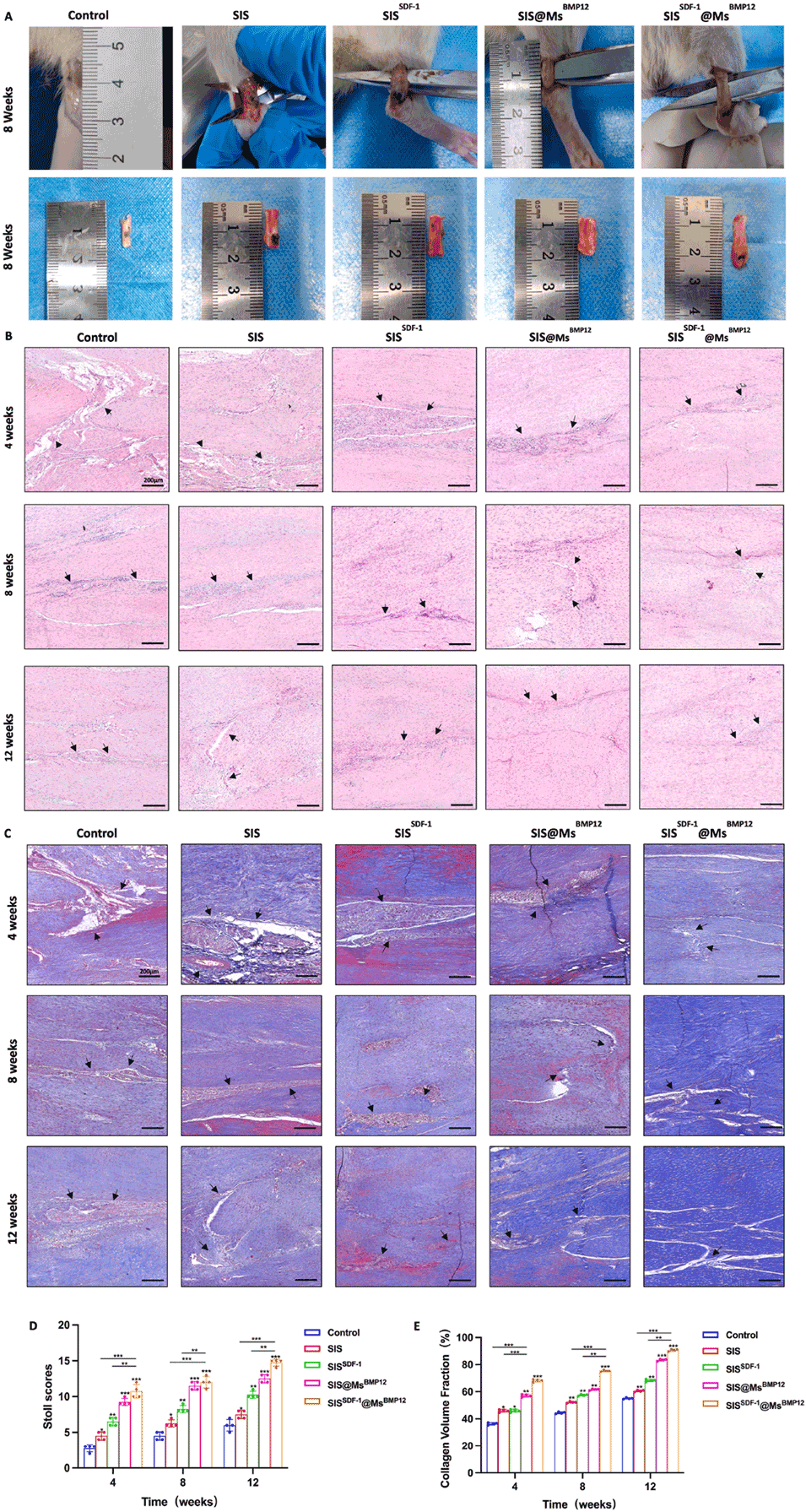
图9.体内细胞浸润和胶原沉积。
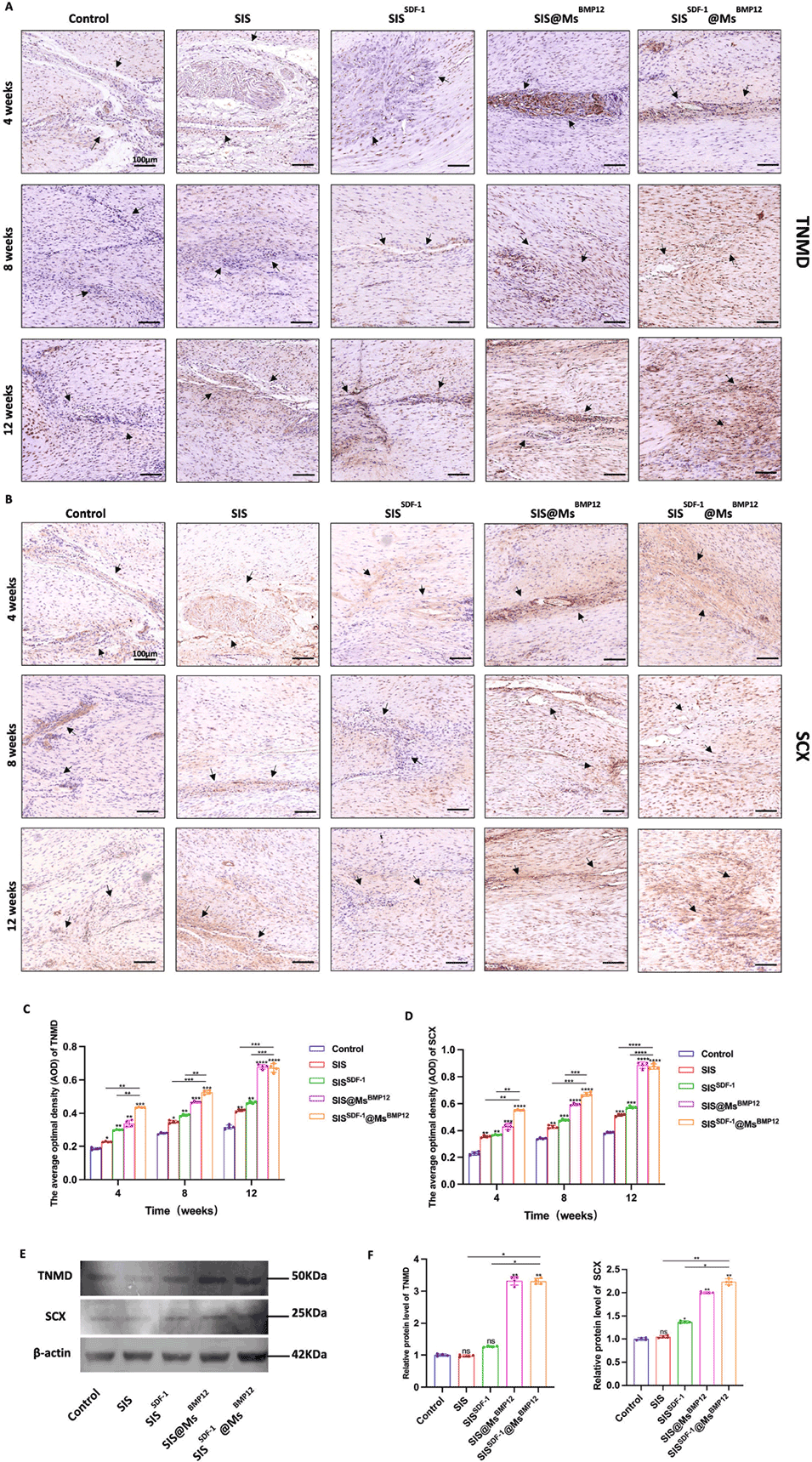
图10.体内肌腱生成。
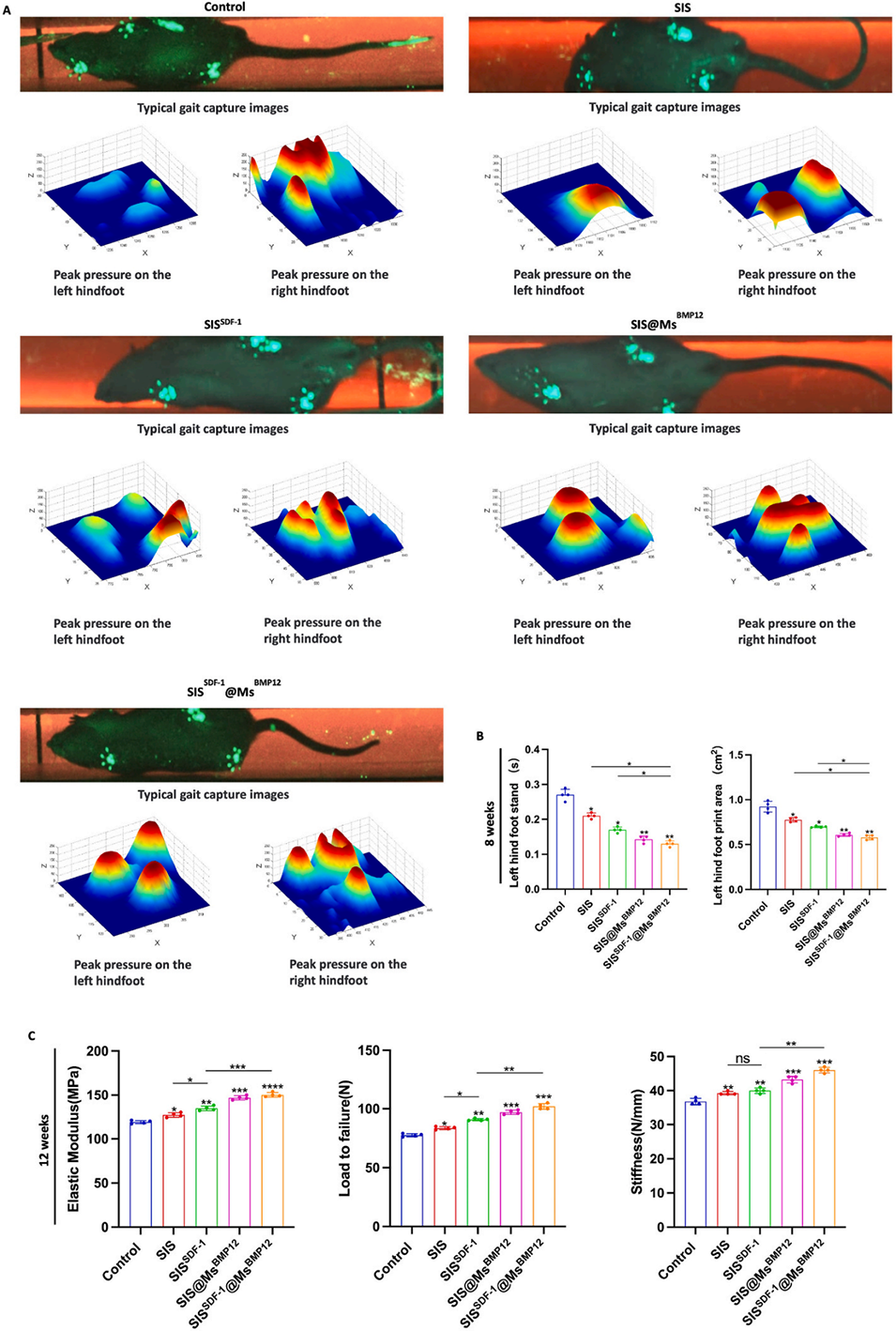
图11.跟腱的功能再生。

图12.体内生物相容性。
论文链接:https://doi.org/10.1016/j.biomaterials.2025.123246














