随着组织工程和再生医学的快速发展,开发具有良好生物相容性、机械性能和可注射性的支架材料成为研究热点。传统的水凝胶支架虽然具有良好的生物相容性,但在机械性能、注射性能以及复杂组织几何形状的适应性方面存在局限。相比之下,冷冻凝胶(Cryogel)作为一种大孔水凝胶,通过冷冻状态下的聚合反应形成,具有高弹性、形状记忆特性以及良好的物质传输能力,显示出在组织再生中的巨大潜力。然而,现有的冷冻凝胶系统多为块状或预成型模具铸造,限制了其可扩展性、再现性和复杂组织几何形状的适应性。

针对传统冷冻凝胶在再生医学应用中的规模化、适配性和微创递送等瓶颈,首尔国立大学的Nathaniel S. Hwang团队开发了一种微流控冷冻凝胶微珠(MCB)平台。该平台融合微流控技术的精准调控优势与冷冻凝胶的多孔结构、力学弹性特性,实现了可定制化、高再现性的微珠制备,并通过整合不同生物活性成分,成功应用于血管、皮肤、骨等多组织类型的再生修复,为临床转化提供了新型微创递送支架方案。相关研究以“A Versatile Microfluidic Cryogel Microbead Platform for Modular Biofabrication and Tissue Regeneration”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、该研究打造了一种多功能的微流控冷冻凝胶微珠(MCB)平台,适用于模块化生物制造与组织再生。此平台结合了冷冻凝胶的优势与微流控技术的特点,能规模化生产单分散、多孔且可注射的微珠。
2、MCB具备良好的机械弹性与形状记忆功能,可通过细至31G的注射器针头注射,且注射后能保持结构完整性。其多孔结构有利于营养物质交换与细胞浸润,还能根据不同组织需求,灵活整合脱细胞基质(如皮肤来源的sdECM)、生物陶瓷(如白磷钙石纳米颗粒nWH)等生物活性成分,实现定制化设计。
3、在实验验证方面,MCB表现出优异的细胞相容性,负载内皮细胞后,在肢体缺血模型中可促进血管再生;整合sdECM后,能加速皮肤伤口愈合;负载nWH后,可在体外诱导成骨分化,并在颅骨缺损模型中推动骨再生。同时,该平台还具有干燥储存、现场复水使用的便捷性,且生物相容性良好,溶血率低,体内植入后炎症反应轻微。
4、总之,该MCB平台具有广泛的组织再生应用潜力,为再生医学提供了一种灵活、高效且具有临床转化价值的新型支架工具。
MCB平台相比传统冷冻凝胶与水凝胶微珠在临床转化潜力上具有以下核心优势,同时也面临一些待解决的挑战:
一、MCB平台的临床转化优势
对比维度 | 传统冷冻凝胶(块状) | 传统水凝胶微珠(如MHBs) | MCB平台 |
注射性能 | 难以通过细针注射(易堵塞、破碎) | 可注射但易在细针中变形或破裂 | 可通过细至31G针头注射,保持结构完整与形状恢复 |
尺寸均一性 | 尺寸与孔隙分布不均,批次差异大 | 微流控制备可单分散,但结构致密 | 单分散微珠,尺寸可控(约240 μm干态),批次一致性强 |
力学适应性 | 弹性好但尺寸大,难以微创植入 | 硬度低,注射后易发生塑性变形 | 高弹性模量(~1 MPa),具形状记忆,耐剪切与压缩 |
孔隙结构 | 大孔连通,利于细胞浸润 | 孔隙小(平均<2 μm),扩散受限 | 连通大孔(~42 μm),支持细胞迁移、营养交换与血管化 |
功能模块化 | 成分难调控,不易实现组织特异性 | 可负载活性成分,但结构易受化学交联影响 | 可灵活整合dECM、陶瓷颗粒、细胞等,不改变核心制备工艺 |
存储与使用便利性 | 常需湿态保存,运输不便 | 多需湿态或低温保存 | 可冻干存储,现场再水合,无需冷链,适合临床即时使用 |
细胞兼容性 | 细胞可在孔隙中生长,但注射时易流失 | 细胞封装时常暴露于化学交联剂,存活率低 | 细胞后加载,避免毒性暴露,注射后细胞保留率高(26G >84%) |
治疗标准化 | 剂量与形状难以统一 | 微珠大小一致,但注射性能差 | 单分散+可注射,支持精确剂量控制,适合标准化临床给药 |
二、MCB平台仍面临的挑战
1、细胞保留率与超细针头的矛盾
问题:使用极细针头(如31G)注射时,细胞保留率显著下降(仅15.5%),因高剪切力导致细胞脱落。
解决方向:需优化微珠表面化学(如动态共价键、ECM涂层)或促进细胞在孔隙内的锚定。
2、活性成分释放动力学未精准控制
问题:虽可整合dECM、whitlockite等成分,但其释放动力学、降解行为与局部微环境互作尚未系统量化。
解决方向:需结合蛋白质组学、离子释放监测等手段,建立“成分 释放 疗效”关系模型。
3、力学性能在负重组织中的局限性
问题:MCB刚度(~1 MPa)较低,适用于软组织与非负重骨缺损,但难以直接用于承重骨或关节。
解决方向:可复合更高模量材料(如高分子纤维、高浓度陶瓷),或作为“注射式填充剂”配合支撑结构使用。
4、规模化生产与质控体系尚未完善
问题:微流控设备通量虽高,但放大生产时可能面临芯片堵塞、液滴融合等问题。
解决方向:需开发多通道并行系统、自动化监测与分选装置,建立GMP级别生产流程。
5、长期安全性与免疫应答需进一步验证
问题:目前仅进行7天皮下植入实验,更长周期(数月 数年)的体内降解、免疫应答与组织整合数据尚缺。
解决方向:需开展大型动物长期实验,评估慢性炎症、纤维包裹及材料残留风险。
6、多细胞共负载与空间组织化的复杂性
问题:MCB目前以单细胞类型或单一活性成分为主,构建血管化组织需多细胞空间有序组装。
解决方向:可开发多层微流控系统制备异质微珠,或利用微珠自组装实现多细胞微环境构建。
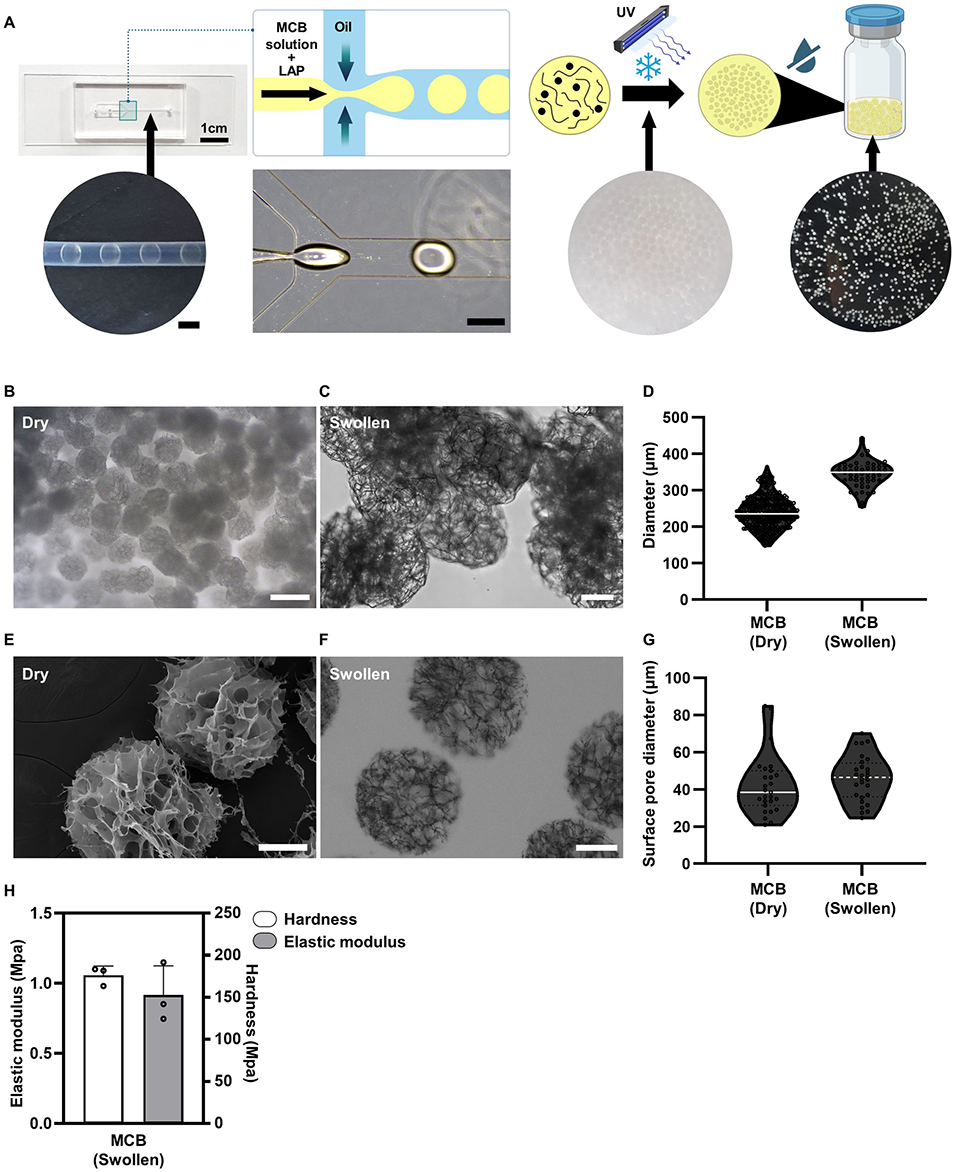
图1 微流控冷冻凝胶微珠(MCB)的制备及形态学表征
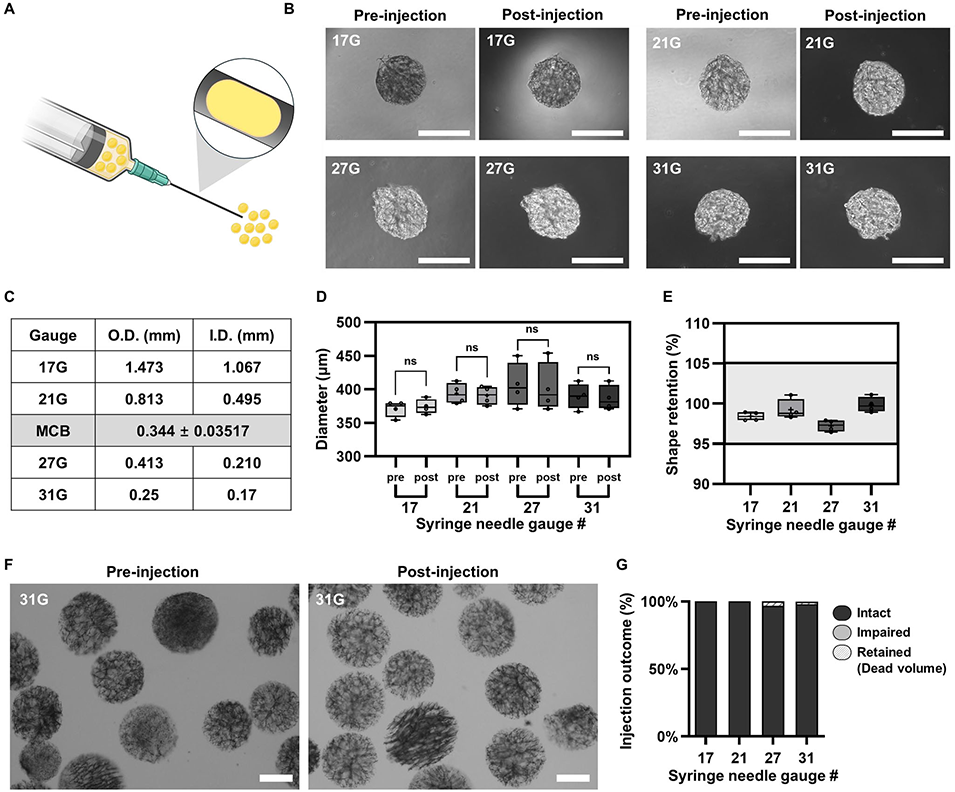
图2 溶胀MCB经注射器注射后的机械韧性与几何完整性
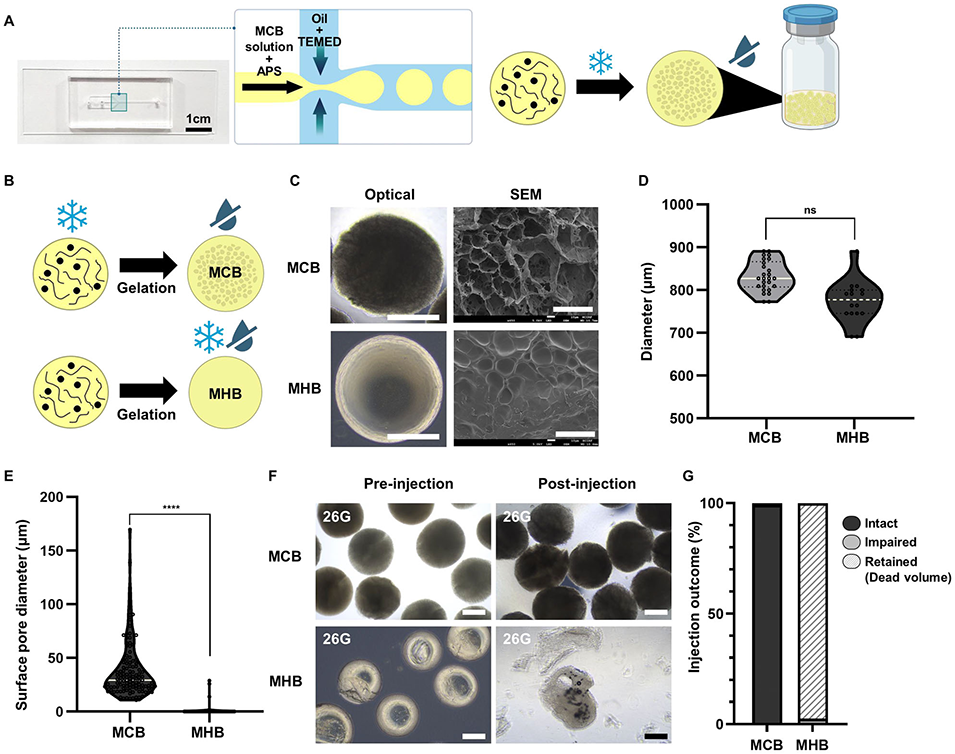
图3 MCB与水凝胶微珠(MHB)的形态学表征及注射性能对比
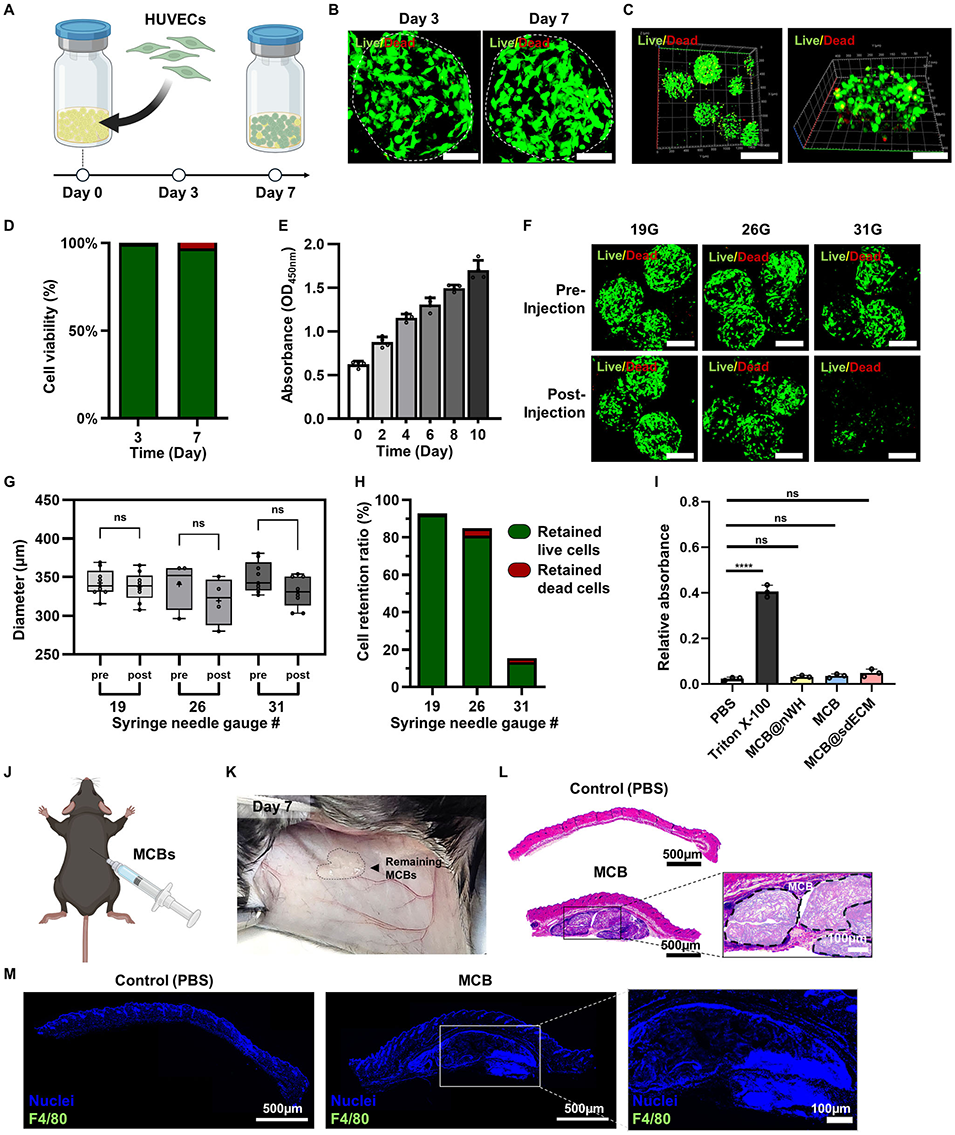
图4 载细胞MCB的细胞相容性与注射性能
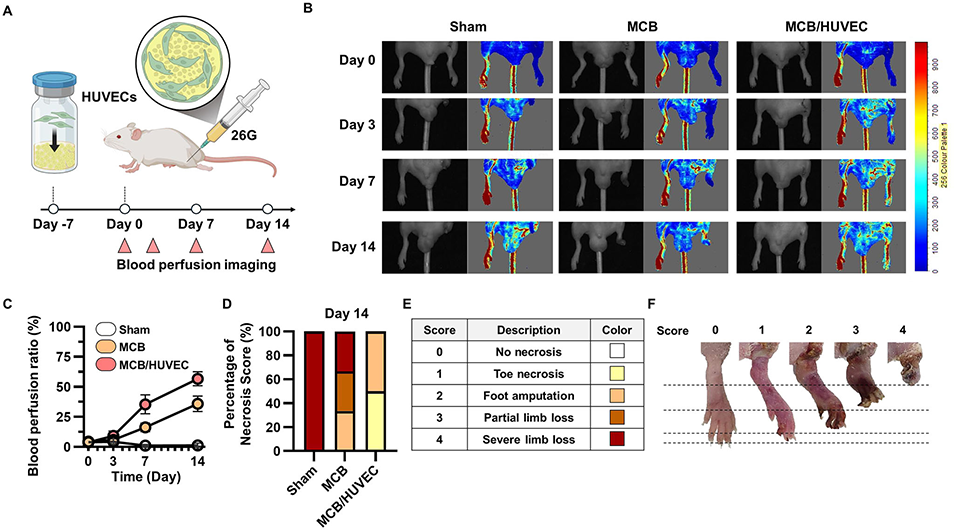
图5 载HUVEC MCB在小鼠后肢缺血模型中的应用
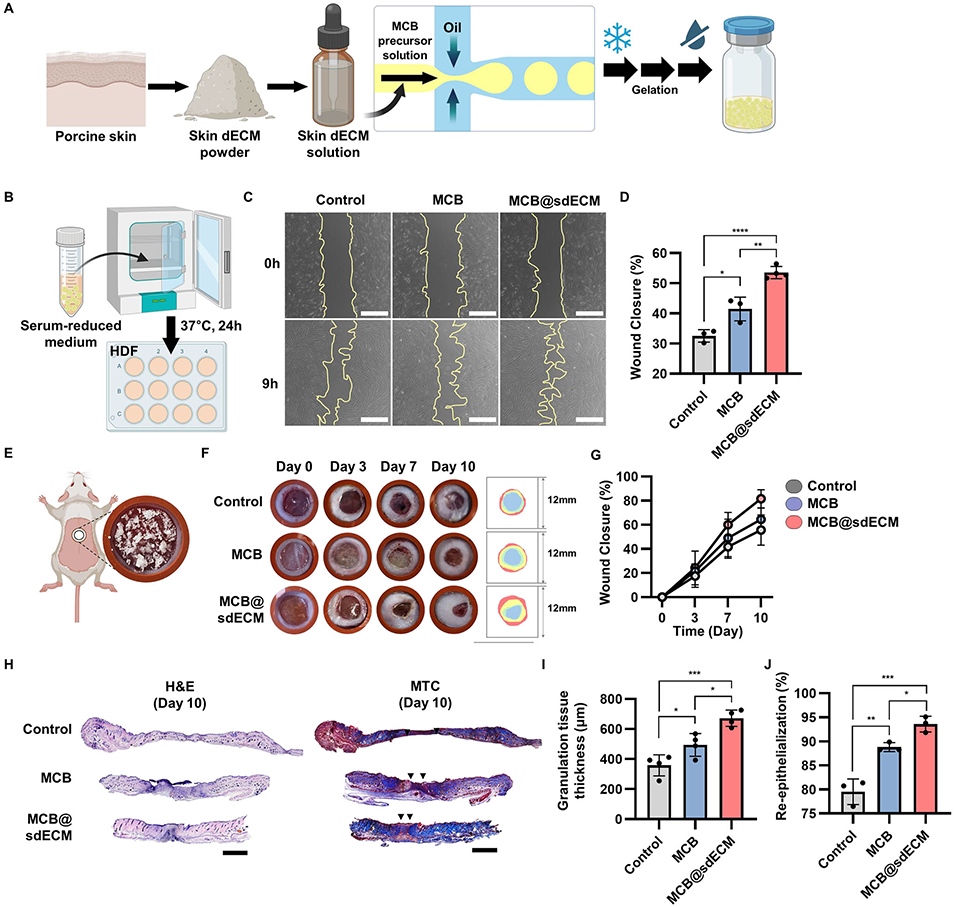
图6 脱细胞基质(dECM)整合MCB在体外及体内皮肤伤口愈合中的促进作用
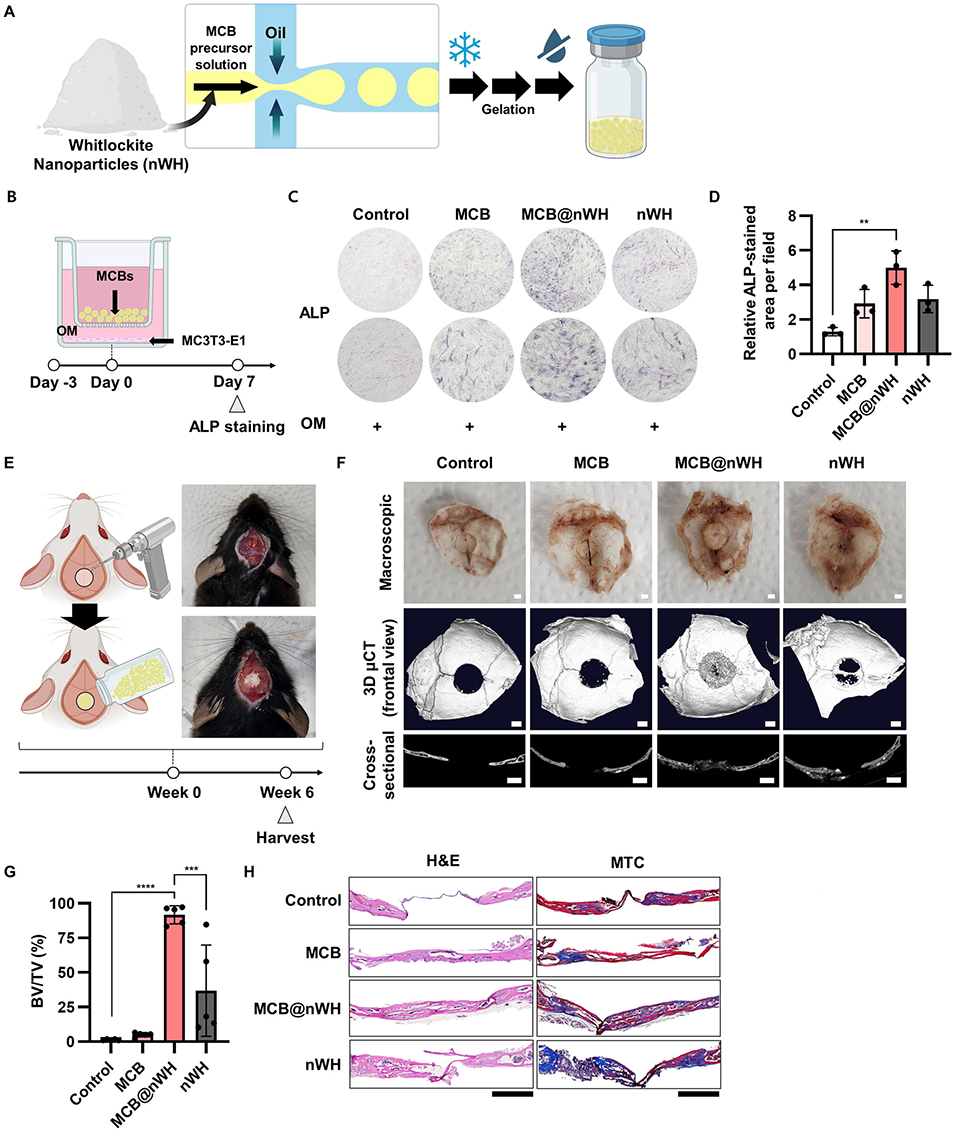
图7 生物陶瓷功能化MCB在骨组织工程中的应用
论文链接:https://doi.org/10.1002/adhm.202503505
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)
下一篇:暂无














