在药物研发的漫长征程中,药物筛选作为关键环节,其效率和准确性直接影响着新药问世的速度与质量。微流控技术为体外药物筛选提供了一种极具前景的方法,通过模拟细胞微环境的关键特征,实现了生理相关性、高通量且经济高效的分析。人工智能(AI)与微流控技术的协同集成是生物医学分析领域的一项关键突破。二者的融合促进了自动化数据分析、复杂模式识别和智能实验控制,从而加速药物筛选进程并提升筛选精准度。

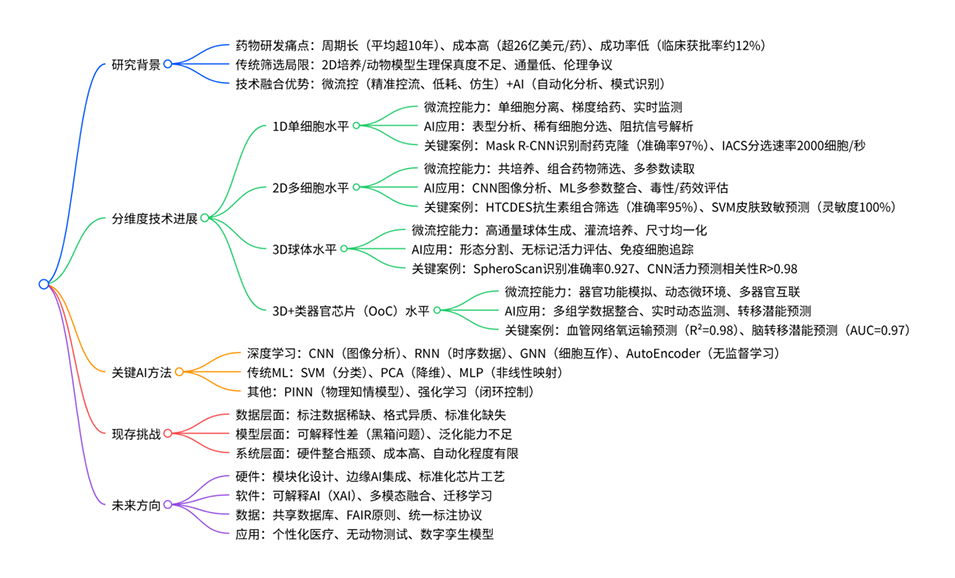
本综述系统探讨了AI与微流控技术协同融合在药物筛选中的应用进展,按生物复杂度从低到高(1D单细胞、2D多细胞阵列、3D球状体、3D+器官芯片)展开,详细阐述了不同维度下AI算法(如CNN、RNN、SVM等)如何提升筛选通量、灵敏度与生理相关性;同时剖析了该领域在硬件标准化、模型可解释性、数据管理、系统集成等方面的现存挑战,并展望了其未来方向和新兴趋势,旨在为精准药物发现和生物医学研究的持续发展指明方向。相关研究成果以“AI-integrated microfluidics for drug screening: From single cell to organ-on-a-chip”为题目,发表于期刊《Acta Pharmaceutica Sinica B》。
一张图读懂全文
关键AI方法及应用场景
AI方法 | 核心功能 | 典型应用场景 |
CNN | 空间特征提取、图像分割 | 细胞形态分析、球体识别、药物耐药分类 |
RNN/LSTM | 时序依赖捕捉、信号轨迹分析 | 药物响应动态监测、电信号解析 |
GNN | 图结构数据学习、关系建模 | 细胞间互作、化合物-靶点网络分析 |
SVM | 二分类/多分类、边界优化 | 药物毒性区分、细胞亚型分类 |
PCA | 数据降维、特征压缩 | 细胞响应聚类、多参数数据可视化 |
PINN | 物理规律整合、流体动力学建模 | 血流场量化、微环境力学分析 |
强化学习 | 闭环控制、参数优化 | 动态给药调整、培养条件优化 |
微流控技术在不同生物复杂性模型(1D-3D+)中,为药物筛选提供了哪些独特的技术支撑?
1D单细胞水平:实现单细胞精准分离、微尺度药物梯度生成,以及实时电信号/成像信号采集,同时通过液滴微流控等技术构建独立微反应单元,避免细胞间干扰,助力解析细胞异质性。
2D多细胞水平:支持多细胞共培养体系构建,通过多通道设计实现组合药物高通量筛选,同时精准调控营养梯度与流体剪切力,模拟体内细胞间相互作用微环境。
3D球体水平:借助灌流培养系统维持球体内部氧分压与营养平衡,减少传统静态培养导致的坏死核心问题;通过微结构阵列实现球体尺寸均一化生成,提升筛选重复性,且支持动态药物渗透过程监测。
3D+类器官芯片(OoC)水平:整合流体流动、机械力加载、血管化网络构建等功能,精准复现器官级生理微环境,同时实现多器官芯片互联,模拟药物在体内的吸收、分布、代谢与排泄(ADME)过程。
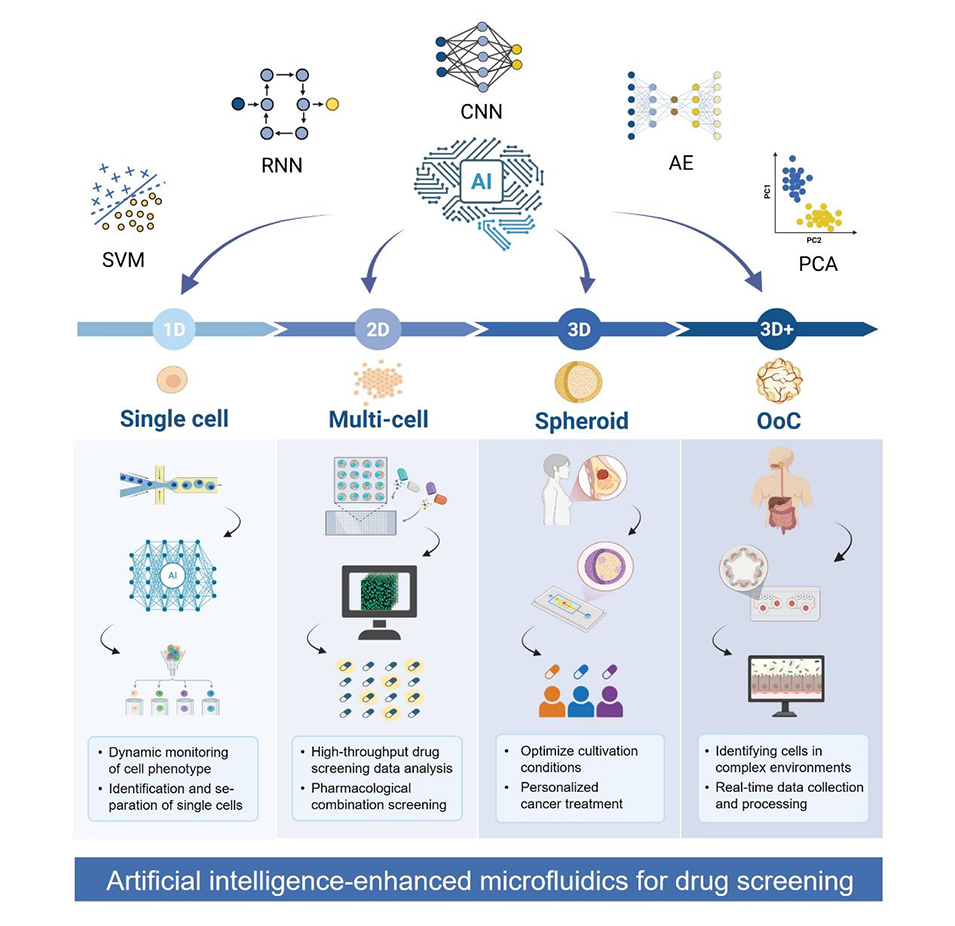
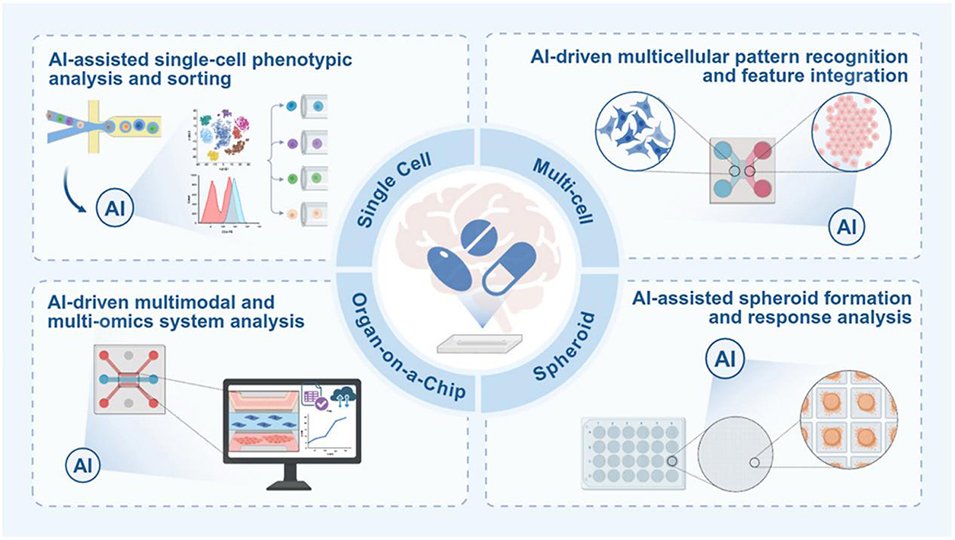
图1 不同生物维度下AI增强型微流控药物筛选的示意图概述
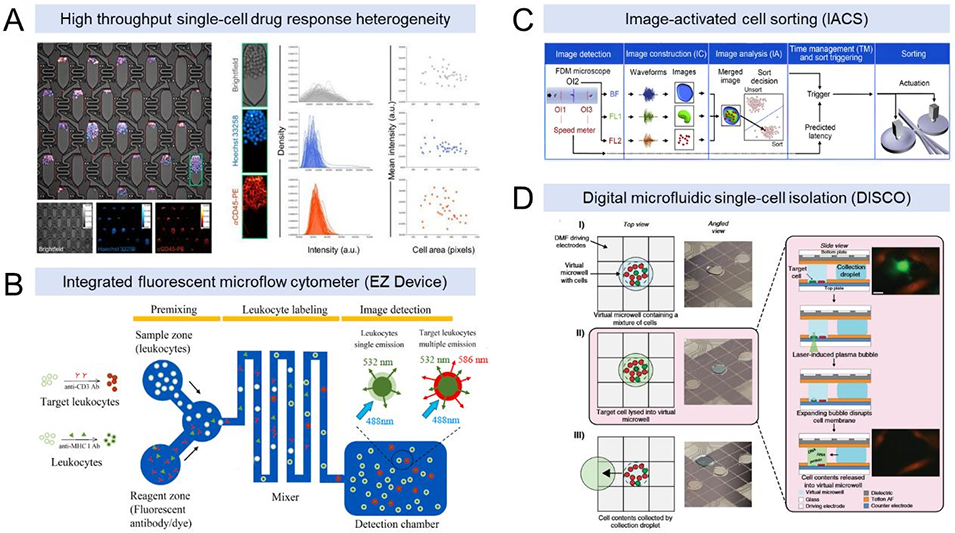
图2 单细胞水平(1D)下AI加速的微流控药物筛选
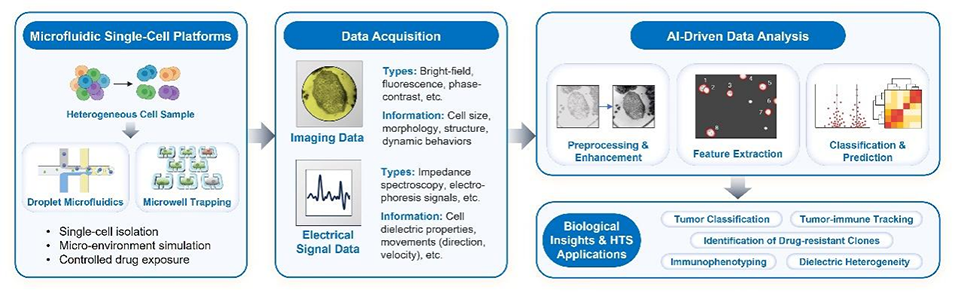
图3 AI加速的微流控平台用于单细胞表型分析的工作流程示意图
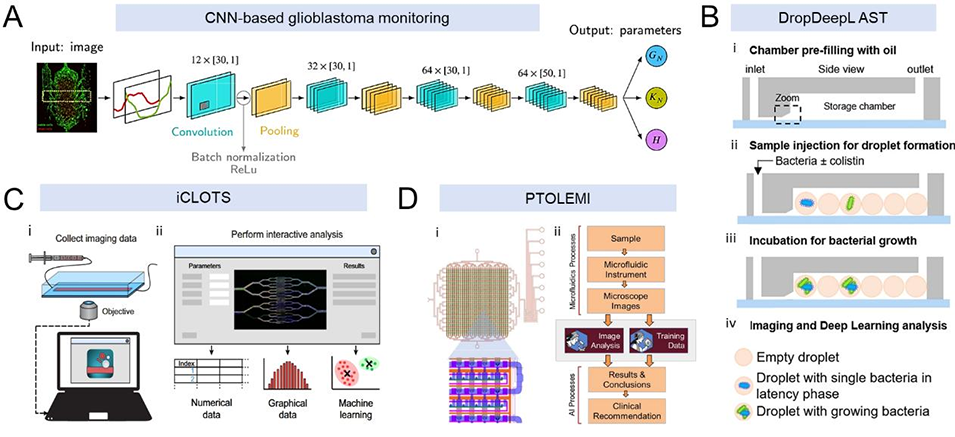
图4 2D多细胞模型中AI驱动的微流控药物筛选
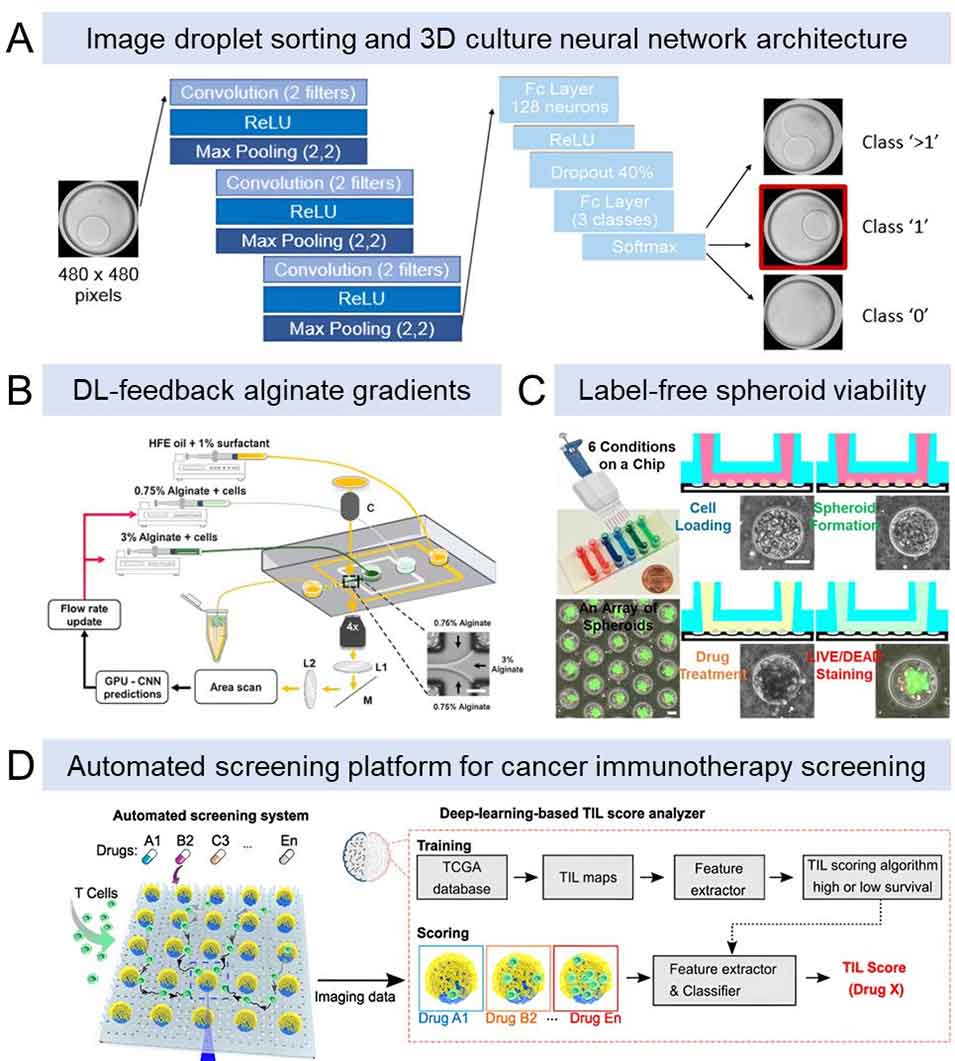
图5 用于3D细胞培养分析和筛选的AI集成微流控平台
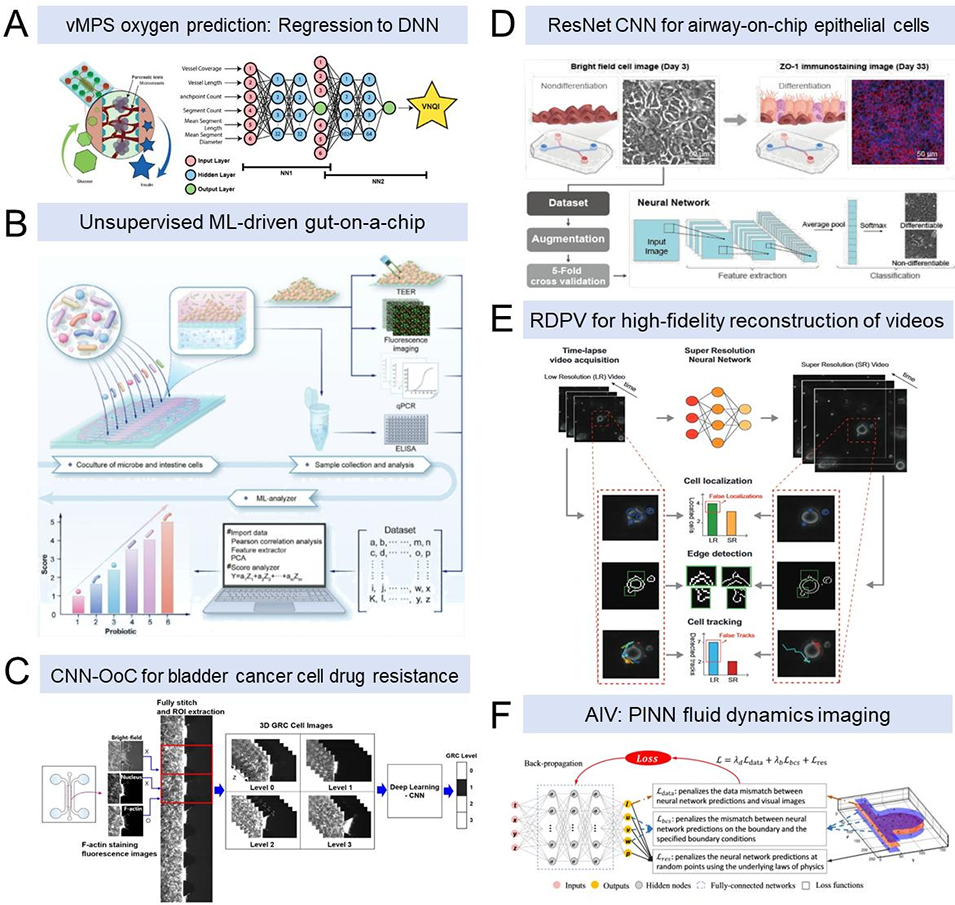
图6 AI增强型类器官芯片药物筛选
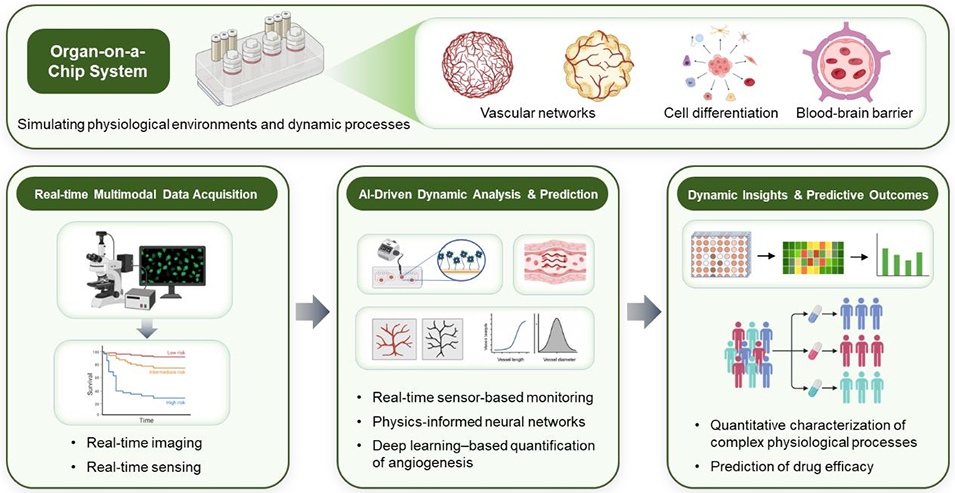
图7 类器官芯片高通量筛选系统中AI驱动的实时监测和动态评估工作流程示意图
论文链接:https://doi.org/10.1016/j.apsb.2026.01.001
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














