肝细胞癌(HCC)是全球范围内导致癌症相关死亡的主要原因之一,其特点是早期症状不明显、进展迅速且转移潜力高。尽管手术和放疗是潜在的治疗手段,但大多数患者在确诊时已处于晚期,无法进行根治性治疗。因此,局部治疗策略如经动脉栓塞术(TAE)和经动脉化疗栓塞术(TACE)成为HCC治疗的重要手段。然而,这些方法的疗效受限于肿瘤的免疫抑制微环境和抗原性不足。近年来,免疫疗法尤其是免疫检查点阻断(ICB)疗法在多种恶性肿瘤中展现出显著的临床效益,但在HCC中的疗效仍不理想,响应率仅为20%-30%。因此,开发能够同时消除癌细胞并逆转肿瘤免疫抑制微环境的有效治疗策略至关重要。

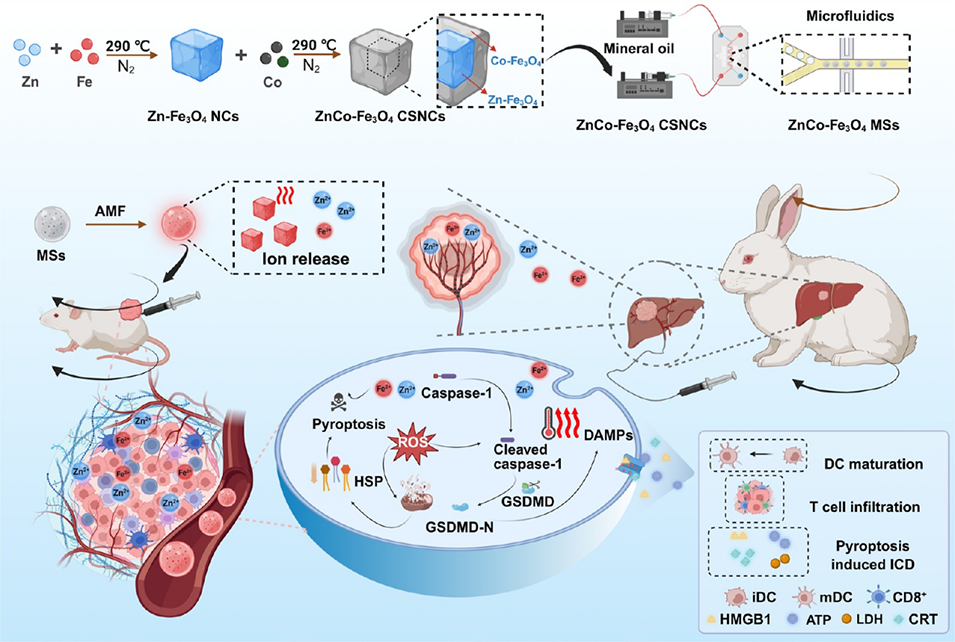
近期,苏州大学程亮、杨乃霖团队与靳勇、孙兴伟团队合作开发了一种创新的磁-金属-免疫治疗策略。通过成分与结构优化,合成磁热性能优异的ZnCo-Fe₃O₄核壳纳米立方体(CSNCs),经微流控技术组装为尺寸可调的磁性微球(MSs),其兼具经动脉栓塞(TAE)与磁热疗法(MHT)功能;在交变磁场作用下,该磁性微球的磁-金属-免疫调控能力显著诱导癌细胞焦亡,激活免疫反应,进一步增强TAE对肝癌的治疗效果。相关研究以“Engineered Nano-Micro Pyroptosis Generators: A Magnetic-Metallo-Immunotherapeutic Strategy to Reinforce Transarterial Embolization”为题目,发表于期刊《Journal of the American Chemical Society》。
本文要点:
1、该研究聚焦肝细胞癌(HCC)治疗难题,开发了一种新型磁-金属-免疫治疗平台。通过成分与结构优化,合成磁热性能优异的ZnCo-Fe₃O₄核壳纳米立方体(CSNCs),其饱和磁化强度(Ms)和矫顽力(Hc)显著提升,经微流控技术组装为尺寸可调的磁性微球(MSs),整合了经动脉栓塞(TAE)与磁热疗法(MHT)功能。
2、在交变磁场(AMF)作用下,ZnCo-Fe₃O₄ MSs实现温度依赖性离子释放、局部高温生成,同时通过代谢干扰抑制热休克蛋白(HSP)上调,协同触发肿瘤细胞焦亡,激活免疫应答(如树突状细胞成熟、CD8⁺T细胞浸润等),重塑免疫抑制性肿瘤微环境(TME)。
3、体外实验证实其能有效诱导肿瘤细胞焦亡并触发免疫原性细胞死亡(ICD)。体内实验(小鼠及兔肝癌模型)显示,该平台与免疫检查点阻断(ICB)疗法结合,可显著抑制原发和远处肿瘤进展,且TAE联合MHT的协同作用在兔模型中展现出优异的肿瘤抑制效果与良好安全性。
4、该研究为焦亡介导的磁-金属-免疫治疗提供了新方向,为晚期HCC治疗提供了创新的整合型策略。
该磁-金属-免疫治疗平台如何实现“栓塞-热疗-免疫激活”的协同作用?
1、栓塞作用:100μm尺寸的ZnCo-Fe₃O₄ MSs能选择性阻塞肿瘤的供血动脉,切断肿瘤的营养和氧气供应,引发肿瘤组织缺血应激,为后续治疗奠定基础。
2、热疗作用:在交变磁场的触发下,磁性微球会产生局部温热效应(温度控制在 45℃以内),既能直接损伤肿瘤细胞,又不会对周围正常组织造成热损伤。
3、离子释放:热疗过程会促进磁性微球释放Fe²⁺/Zn²⁺,这两种离子能抑制肿瘤细胞的三磷酸腺苷合成,下调热休克蛋白70和热休克蛋白90的表达,让肿瘤细胞对热疗的敏感性大幅提升。
4、焦亡诱导:Fe²⁺/Zn²⁺与热疗产生协同作用,激活半胱天冬酶-1,该酶会切割Gasdermin D蛋白,在肿瘤细胞膜上形成穿孔,最终诱导肿瘤细胞发生焦亡(一种具有炎症效应的程序性死亡)。
5、免疫激活:肿瘤细胞焦亡时,会释放出损伤相关分子模式(包括三磷酸腺苷、高迁移率族蛋白1、钙网蛋白),这些物质能促进树突状细胞成熟并高效呈递抗原,增强杀伤性T细胞向肿瘤组织的浸润,同时提高促炎型M1巨噬细胞的比例、减少髓源性抑制细胞,从而重塑原本抑制免疫的肿瘤微环境,激活全身性抗肿瘤免疫反应。
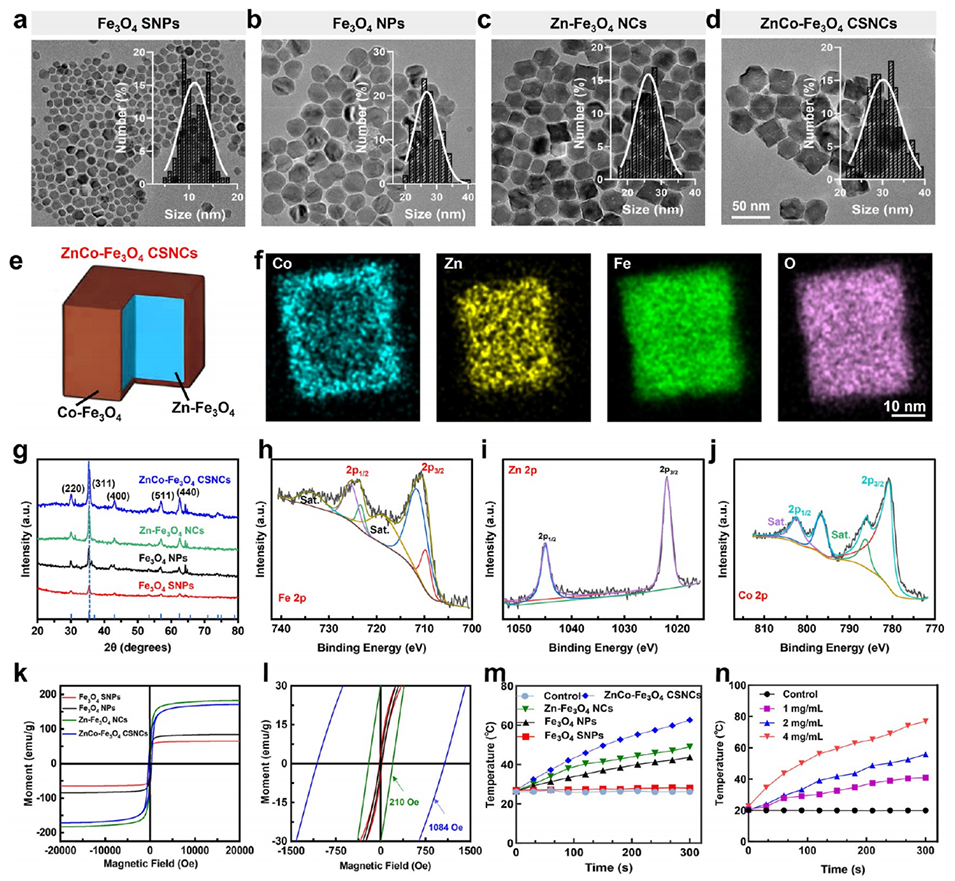
图1. ZnCo-Fe₃O₄核壳纳米立方体(CSNCs)的制备与表征。
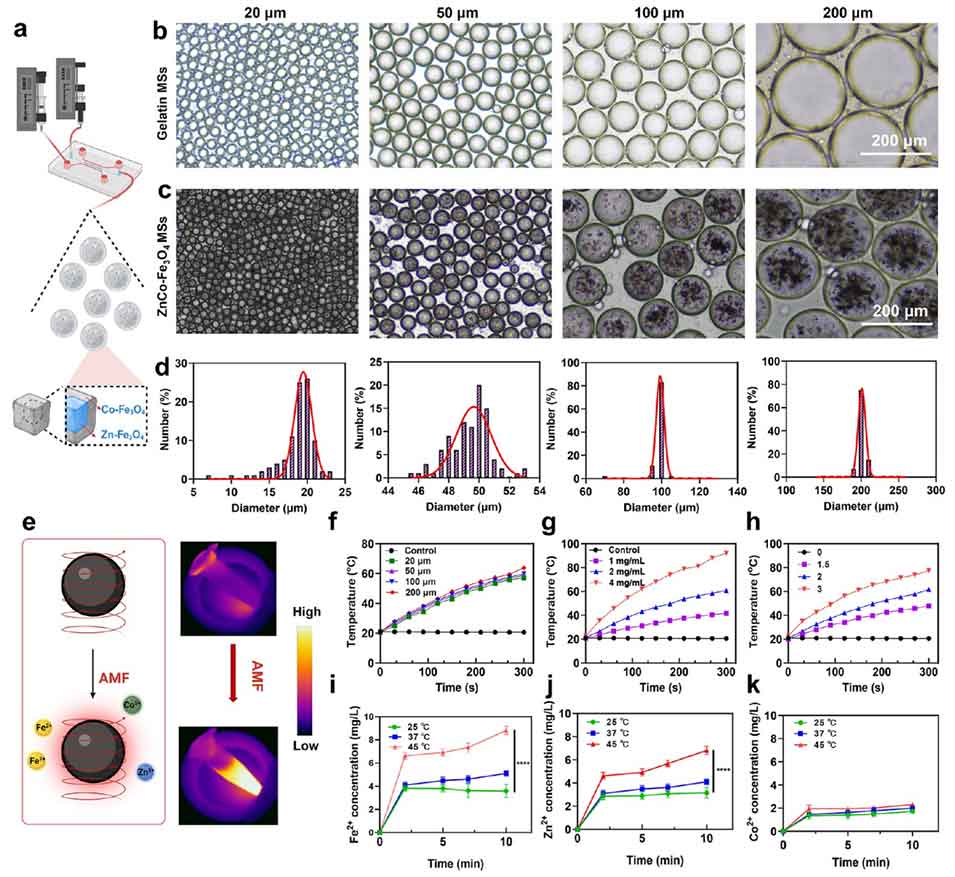
图2. ZnCo-Fe₃O₄磁性微球(MSs)的合成与表征。
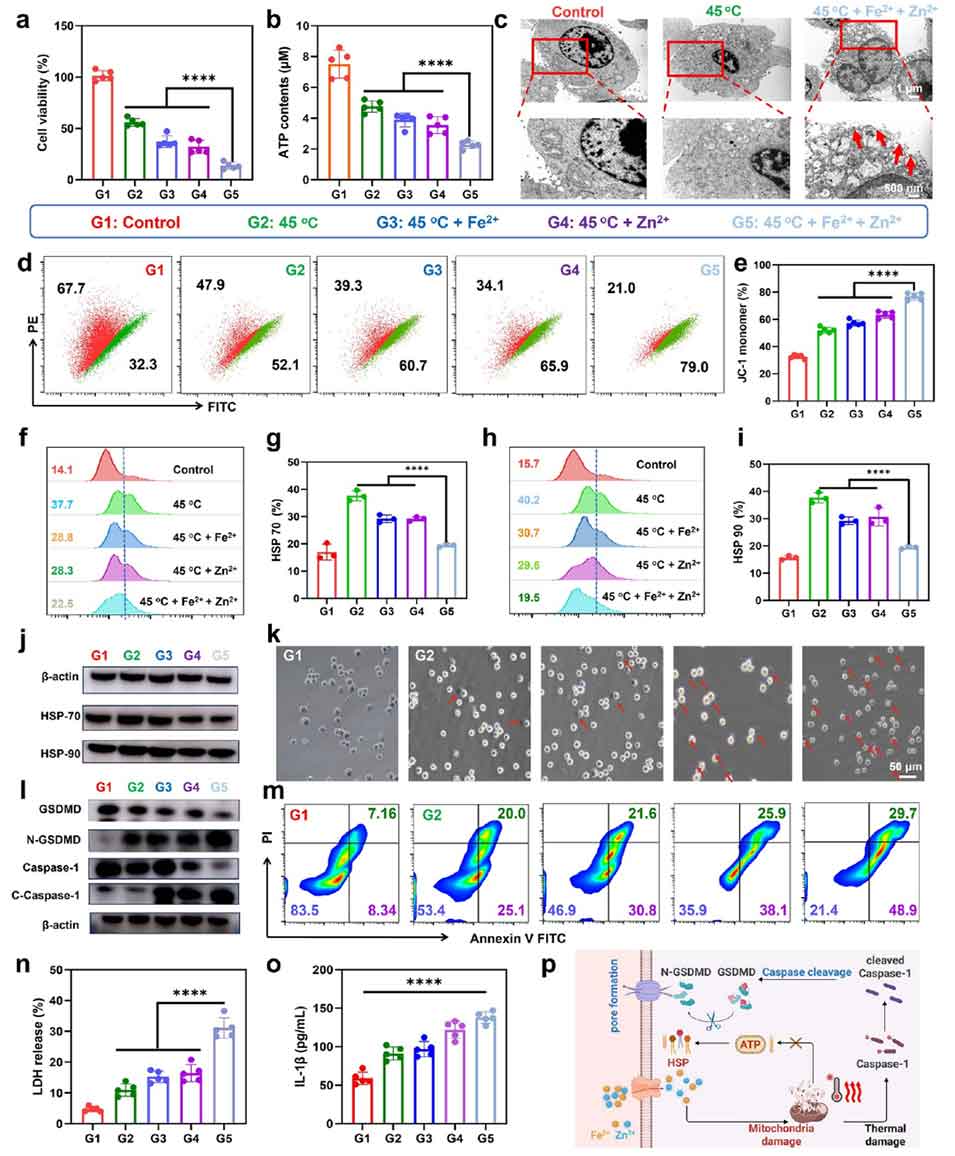
图3. 金属离子对热休克蛋白(HSP)表达的影响及热疗效果增强的研究。
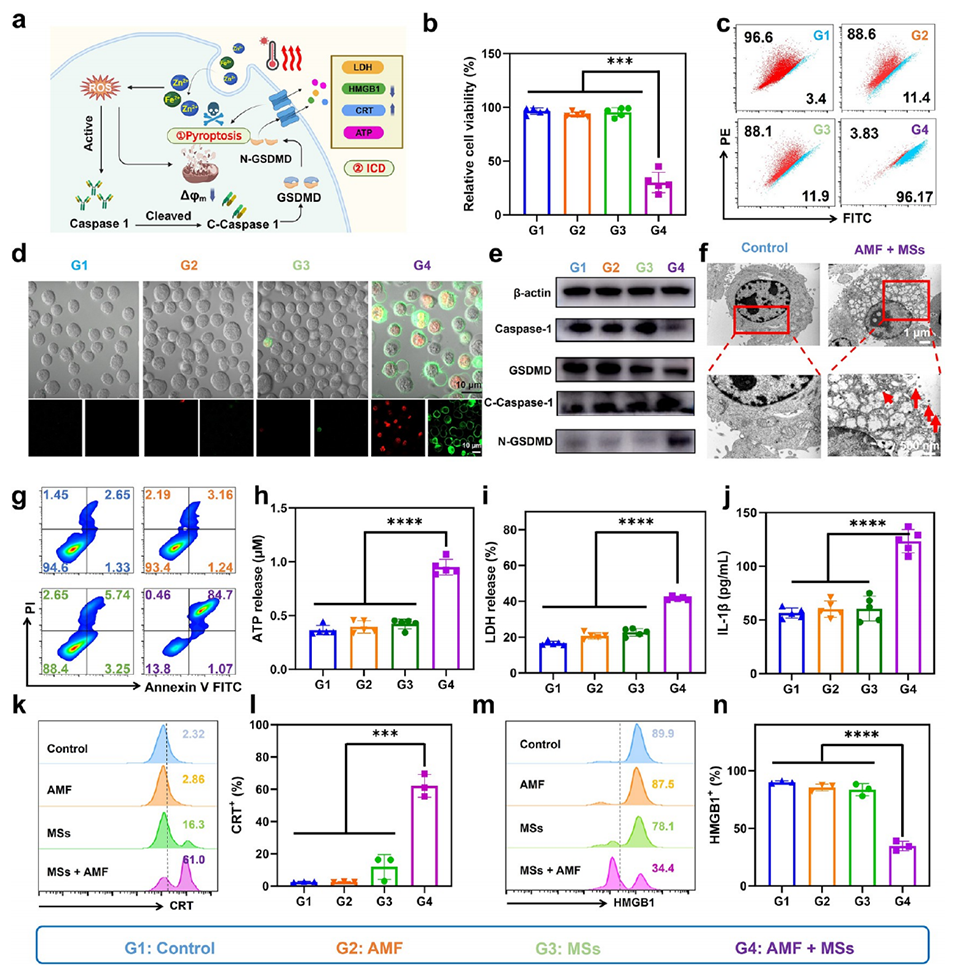
图4. ZnCo-Fe₃O₄磁性微球(MSs)的体外治疗效果。
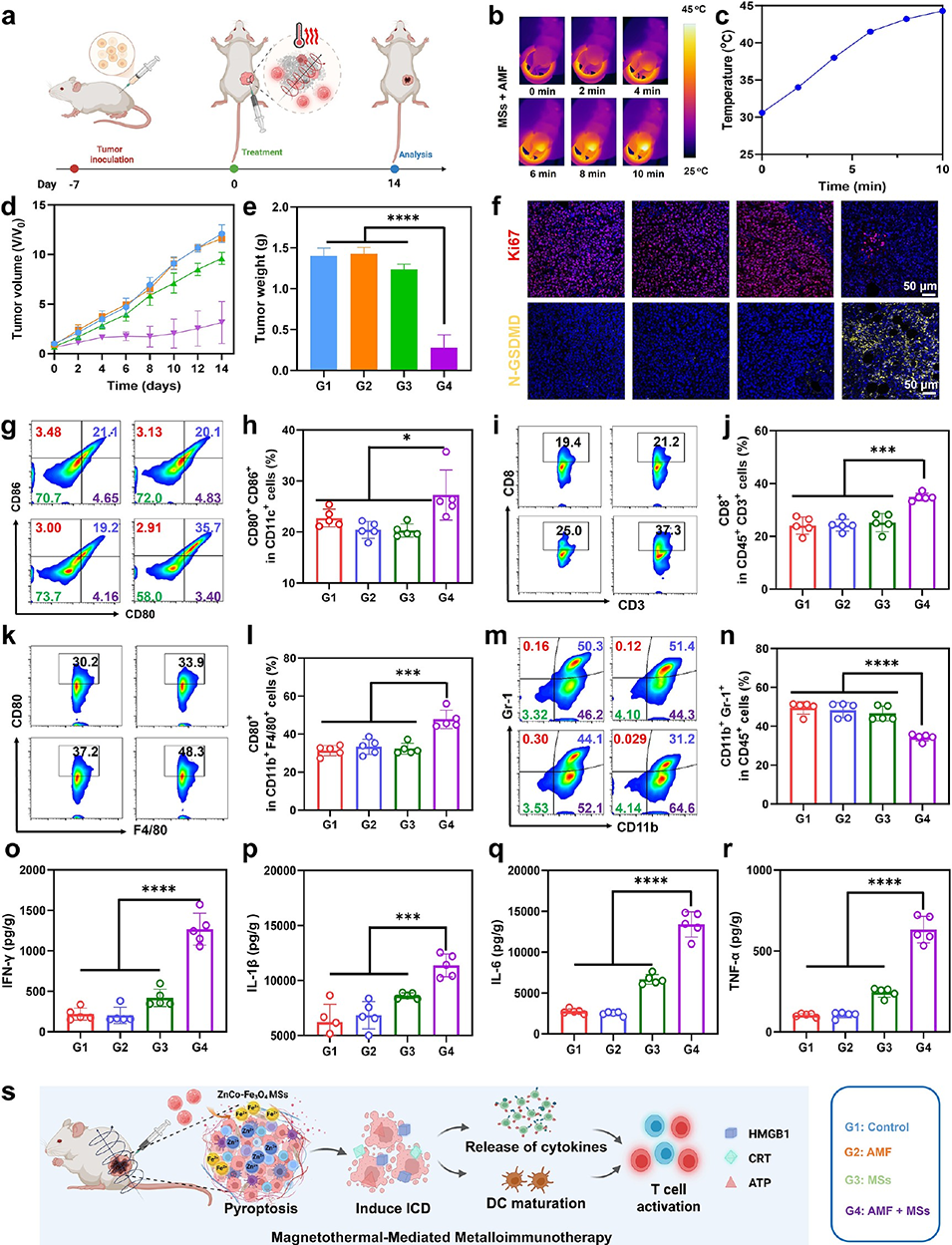
图5. 体内抗肿瘤效果及免疫应答。
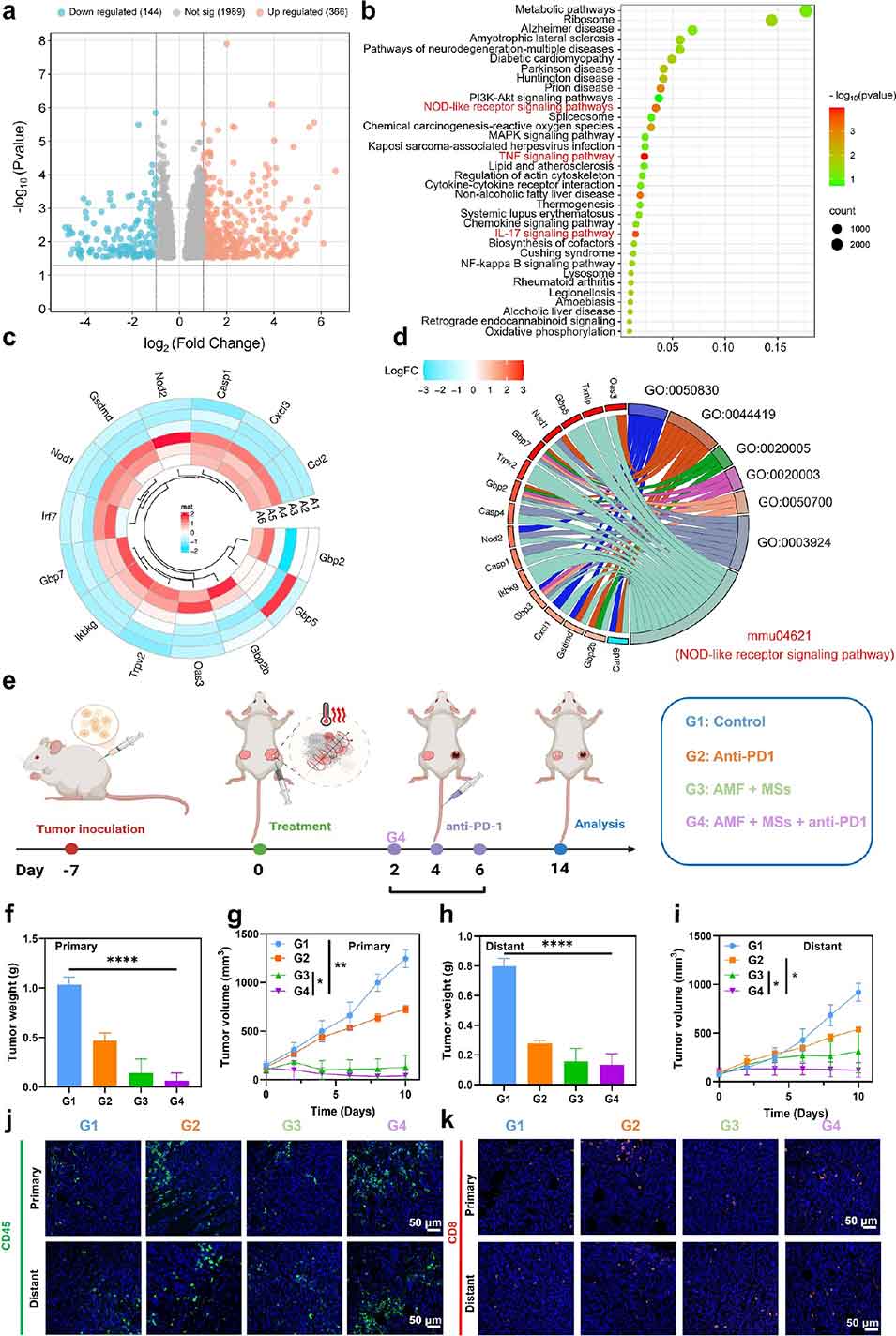
图6. 转录组测序(RNA sequencing)与磁-金属-免疫治疗的关联分析。
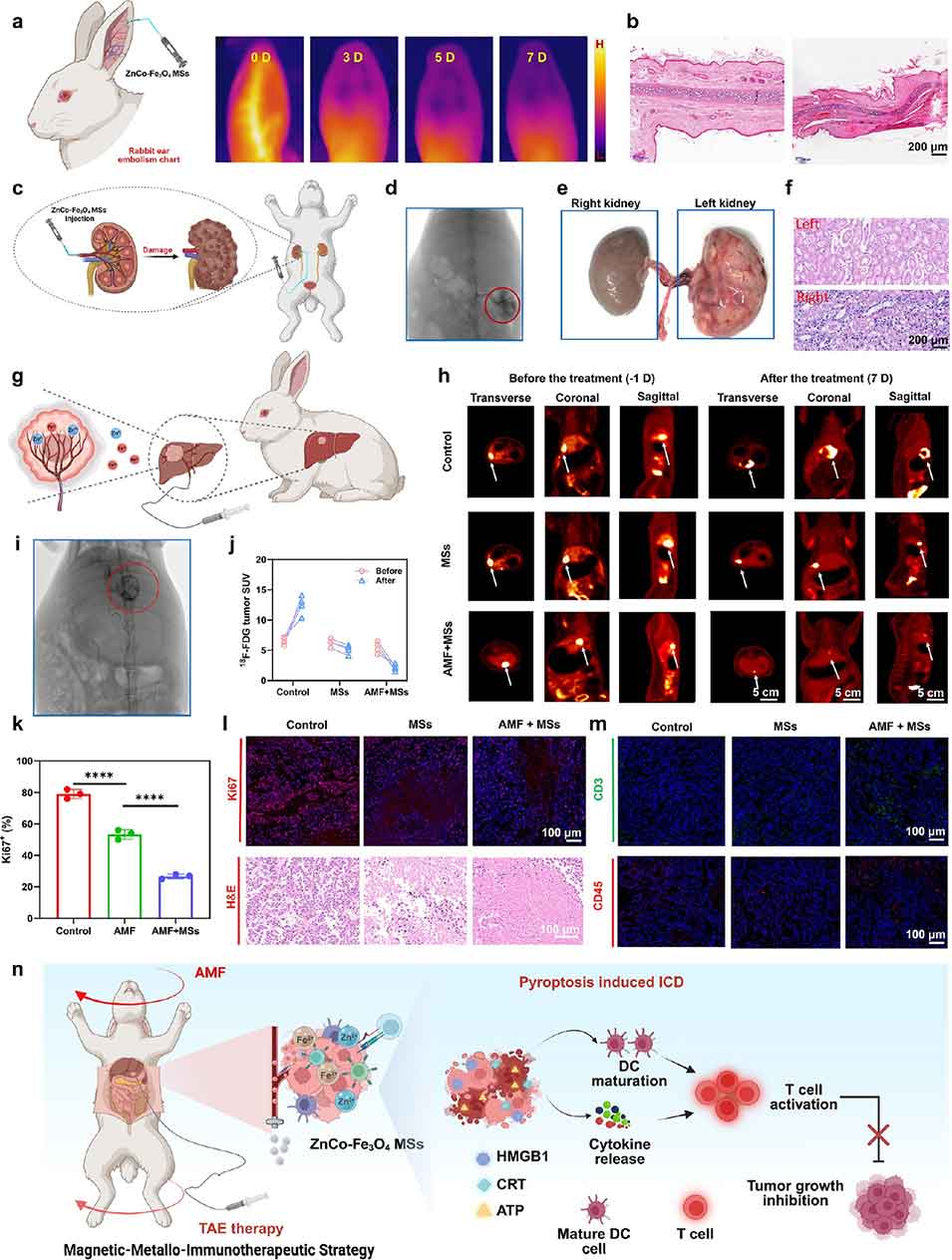
图7. ZnCo-Fe₃O₄磁性微球(MSs)在兔肝癌模型中的经动脉栓塞(TAE)-磁-免疫联合治疗研究。
论文链接:https://doi.org/10.1002/adfm.202532069
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














