小耳畸形是整形外科中常见的先天性畸形之一,表现为部分或完全缺失的外耳,严重影响患者的外貌和生活质量。当前临床重建方法主要依赖自体肋软骨移植或Medpor植入物。然而,自体肋软骨移植存在供区并发症和组织可用性不足的问题,而Medpor植入物则可能引发免疫排斥和长期并发症,难以同时实现安全性、功能性和持久性。因此,迫切需要替代策略。组织工程和再生医学作为有前景的方法,通过整合细胞、生物材料和生物活性因子来重建功能性软骨组织,但在弹性软骨再生领域仍面临临床转化的关键限制。

近期,联勤保障部队第九八八医院耳鼻喉科李谊教授联合深圳清华大学研究院生物智能制造和活体打印研发中心主任徐弢、副主任陈建伟等人创新性融合微流控技术与3D生物打印,构建出兼具结构保真度与生物活性的双相复合支架,成功在动物模型中实现接近天然耳廓软骨的再生效果。相关研究以“3D bioprinted Composite Scaffold Incorporating Microfluidics-Derived Chondrocyte Microspheroids Promotes Auricular Cartilage Regeneration”为题目,发表于期刊《Materials Today Bio》。
本文要点:
1、该研究提出一种融合微流控技术与3D生物打印的双相复合策略,用于耳廓软骨再生,以解决小耳畸形临床重建中自体肋软骨移植和合成植入物存在的诸多问题。
2、研究先通过微流控技术制备出两种软骨细胞微球(单通道GelMA微球sGMS和HAMA壳-鱼明胶核的核壳结构微球csFGMS),它们均具有均一尺寸和良好生物相容性,能维持软骨细胞表型并促进细胞外基质(ECM)分泌,且csFGMS性能更优。随后将这些微球与GelMA/CSMA/ColIIMA复合水凝胶混合制成生物墨水,通过挤压式3D生物打印构建网格状支架。
3、体外实验表明,复合水凝胶支架力学性能、降解性和细胞相容性良好,能支持软骨细胞增殖、迁移和软骨相关基因与蛋白表达。体内实验中,该支架在裸鼠皮下移植后,尤其是混合核壳微球的复合支架(H-csFGMS),可促进原位软骨再生和ECM沉积,再生组织在形态、组织学特征和力学强度上均接近天然耳廓软骨,还能调节免疫微环境、促进血管生成并减轻炎症反应。
4、该研究为小耳畸形重建提供了兼具结构保真度和生物功能的临床相关策略,后续需进一步优化解剖学适配的耳廓形态精准打印、组织长期重塑及力学成熟化等方面以推进临床转化。
本研究中两种软骨细胞微球(sGMS 和 csFGMS)在结构设计上存在明确区分,这一差异直接导致了二者软骨形成能力的不同:
sGMS 为单通道均质结构,由 15% GelMA+0.3% LAP 组成,直径 328±4μm;csFGMS 为核壳结构,外壳为 HAMA(甲基丙烯酰化透明质酸),核心为鱼明胶 + 细胞,直径 447±4.6μm。
软骨形成能力差异核心原因:csFGMS 的 HAMA 外壳模拟了天然软骨的细胞周基质,可缓冲打印和培养过程中的剪切力与渗透压扰动,调控溶质运输,暂时保留新生基质,为 SOX9 驱动的软骨形成程序提供稳定微环境,从而更有效地维持软骨细胞表型,促进 ECM 沉积;而 sGMS 缺乏该缓冲层,细胞微环境稳定性稍差,软骨形成相关标志物(Col2A1、ACAN 等)表达强度低于 csFGMS 组。
该支架在临床应用中还需要解决哪些问题?
1、解剖形态精准复刻:当前为简化的网格状支架,需进一步结合 CT/3D 扫描的耳廓模板,实现患者特异性解剖形态的精准打印,满足临床美学需求。
2、细胞来源与规模化:全尺寸人耳廓构建需大量软骨细胞,现有临床活检细胞产量有限,需优化细胞短期扩增方案或开发 iPSC 等规模化细胞来源。
3、长期稳定性验证:现有体内实验周期为 8 周,需延长观察时间,评估支架长期力学稳定性、降解速率与宿主组织的整合效果,避免结构塌陷或慢性炎症。
4、免疫相容性优化:虽在免疫缺陷小鼠中验证,临床应用需在免疫健全模型中评估免疫排斥风险,进一步优化材料和微球设计以降低免疫原性。
5、制造标准化与质控:需建立微球尺寸、生物墨水成分、打印参数的标准化流程,减少批次差异,满足临床监管要求。
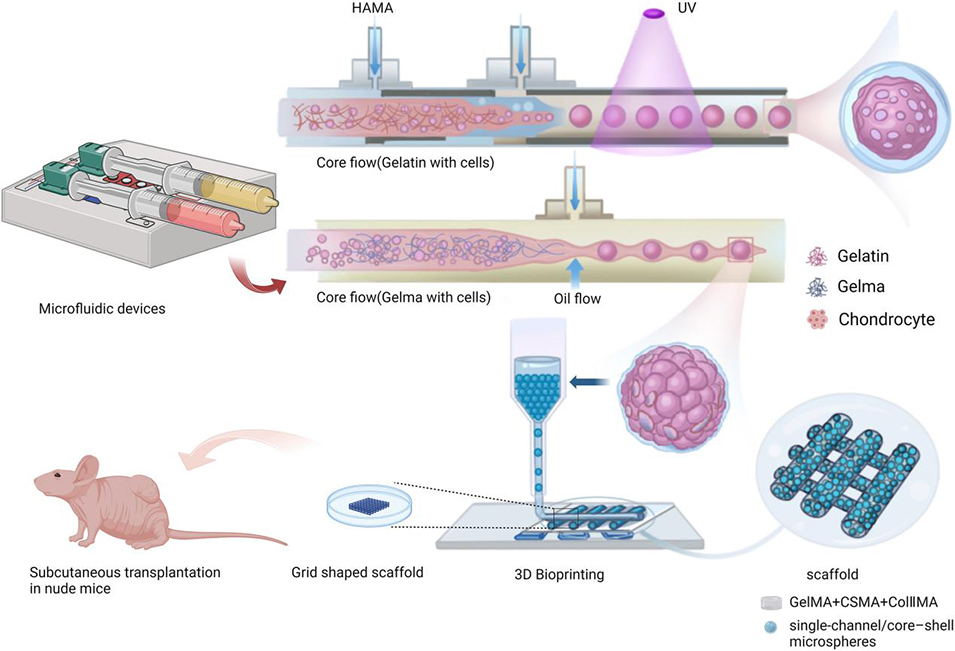
图1 微流控辅助制备负载软骨细胞的微球及 3D 生物打印网格状支架用于耳廓软骨再生的工艺示意图。毛细管微流控装置可生成两种形式的构建单元:(i)核壳结构微球,其甲基丙烯酰化透明质酸(HAMA)外壳包裹负载软骨细胞的明胶内核,并在 405nm 紫外光下光交联;(ii)单通道微球,由甲基丙烯酰化明胶(GelMA)- 软骨细胞内核流经油相剪切形成。随后,这些生物活性微球与 GelMA/CSMA/ColIIMA 光交联水凝胶基质混合,配制复合生物墨水,通过挤出式 3D 生物打印沉积为网格状支架,随后皮下植入裸鼠体内。
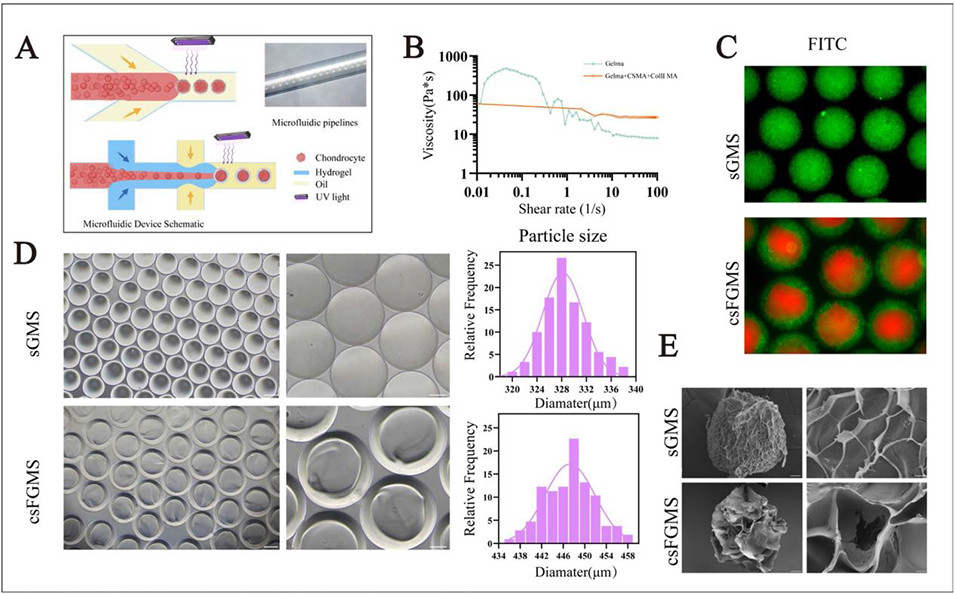
图2 基于 GelMA 和 HAMA 的软骨细胞微球制备与表征。
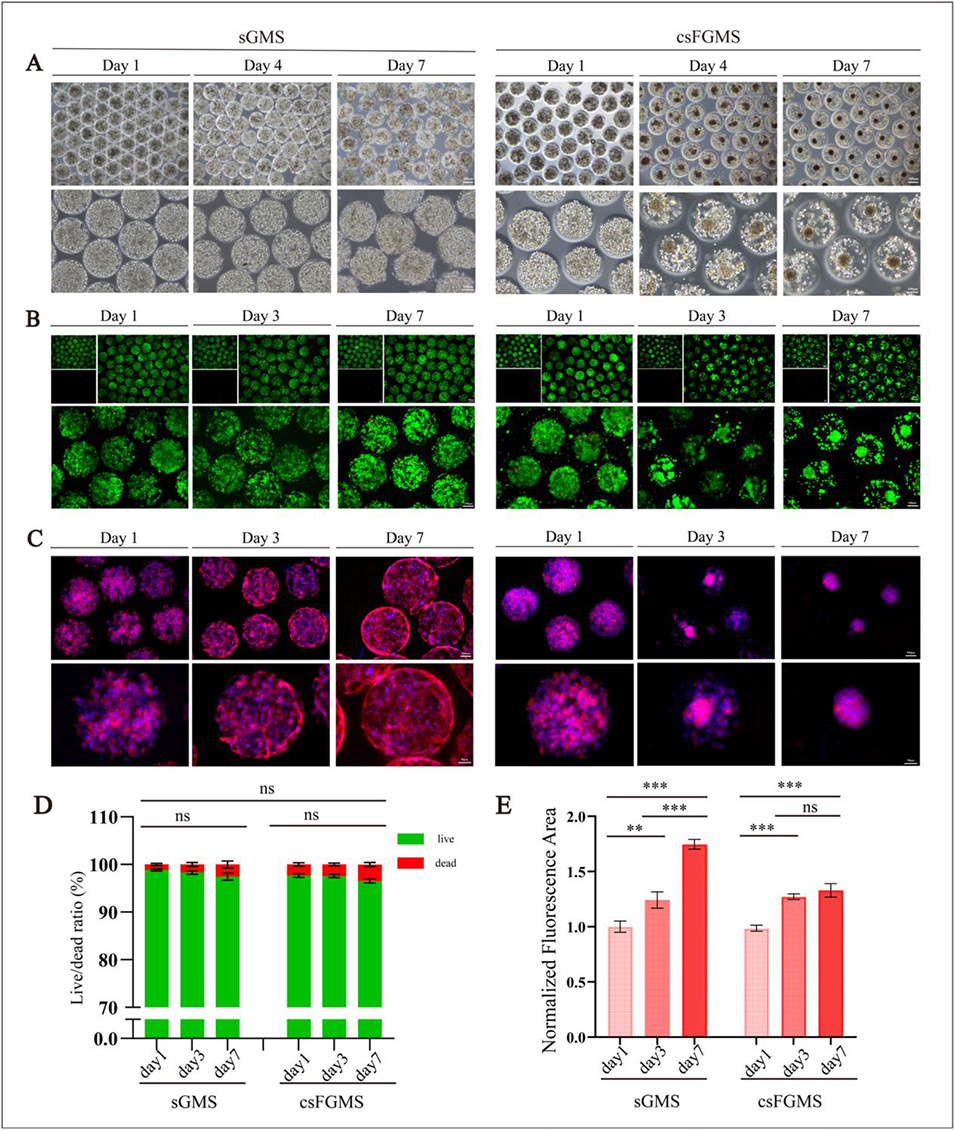
图3 负载软骨细胞的水凝胶微球体外生物相容性评估。
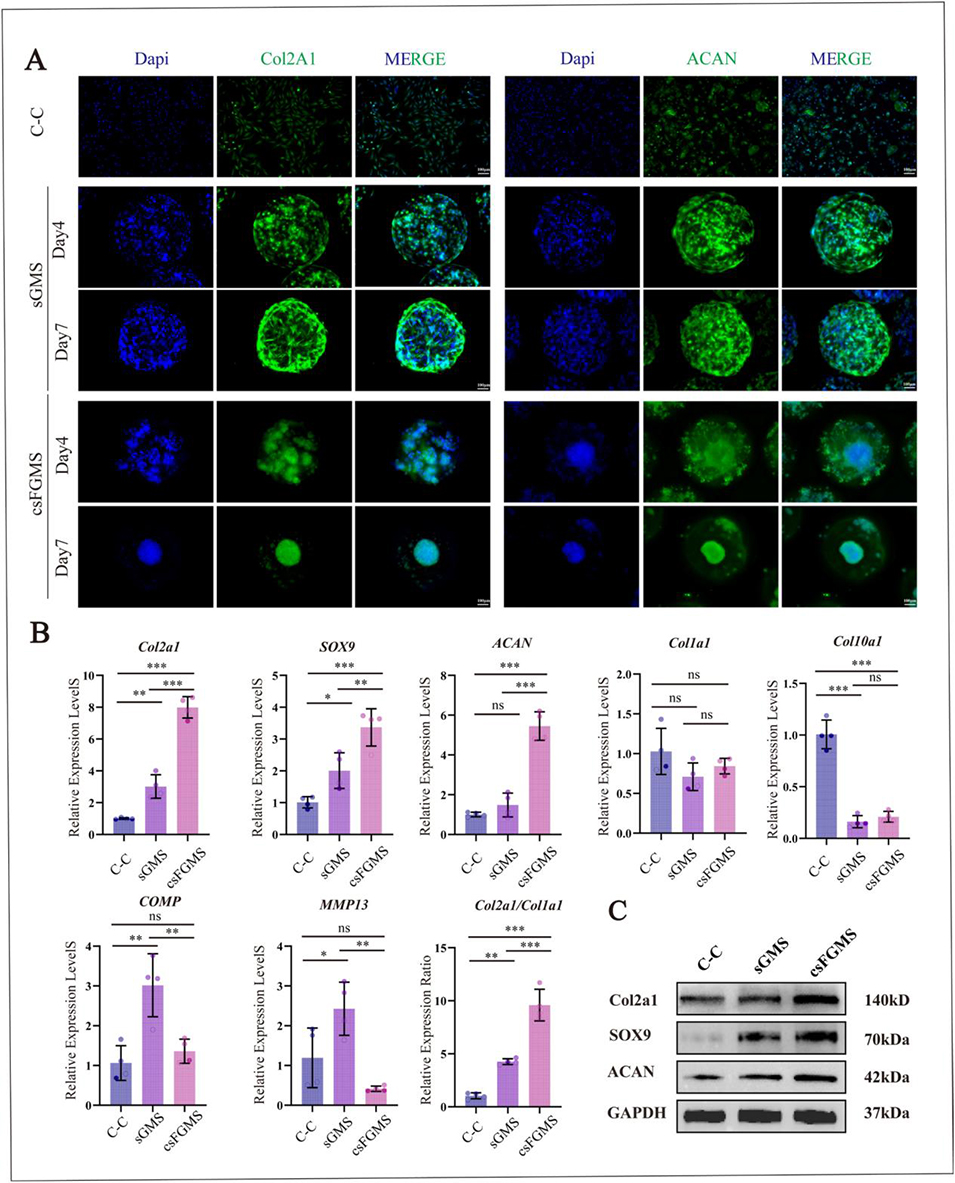
图4 微球微环境中软骨形成标志物的表达及分子谱分析。
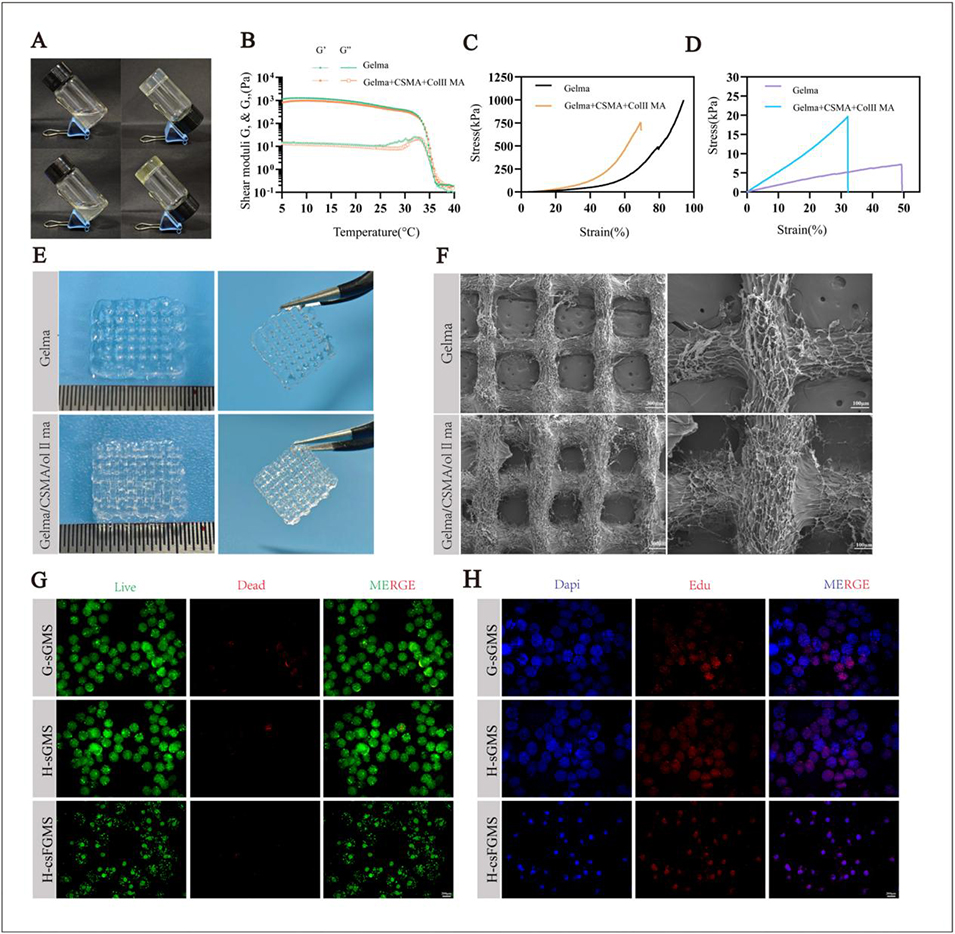
图5 (A)紫外光交联后的构建体照片,显示其高形状保真度。(B)温度扫描流变学结果(5-40℃,升温速率 1.75℃/min):储能模量/损耗模量及凝胶点。(C-D)压缩和拉伸应力-应变曲线及模量(GelMA:压缩模量 0.126MPa,拉伸模量 0.0154MPa;复合水凝胶:压缩模量 0.298MPa,拉伸模量 0.0559MPa)。(E)打印的网格状构建体,显示丝束完整性和可操作性。(F)SEM显微照片,显示相互连通的多孔结构。(G)培养后打印的 G-sGMS、H-sGMS 和 H-csFGMS 网格中软骨细胞的活/死染色结果,显示绝大多数细胞存活,仅少数碘化丙啶阳性细胞。(H)相同构建体的 5 - 乙炔基 - 2'- 脱氧尿苷(EdU)染色结果,显示打印丝束中增殖的软骨细胞。柱形图表示平均值 ± 标准差,n=3 个生物学重复;采用单因素方差分析结合杜凯氏事后检验,图中标注显著性(*p<0.05,**p<0.01,***p<0.001)。比例尺:(F 左图)300μm;(F 右图)100μm;(G、H)200μm。
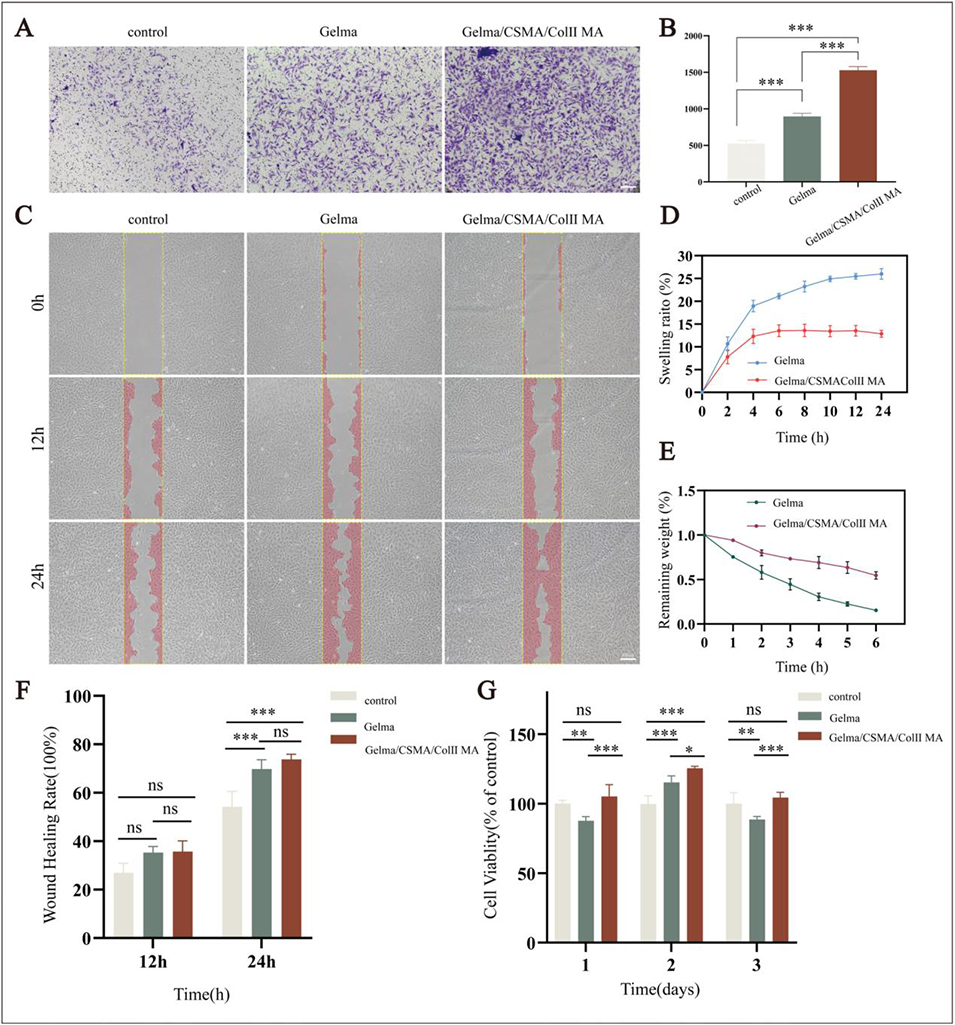
图6 (A)不同条件下软骨细胞的 Transwell 迁移实验结果。(B)迁移细胞定量分析。(C)0、12 和 24 小时的代表性划痕愈合实验图像。(D)溶胀比动力学曲线。(E)在胶原蛋白酶/透明质酸酶中酶解的剩余质量随时间变化曲线。(F)划痕愈合率定量分析。(G)1-3 天的细胞计数试剂盒 - 8(CCK-8)增殖检测结果。柱形图表示平均值 ± 标准差,n=3 个生物学重复;采用单因素方差分析结合杜凯氏事后检验,图中标注显著性(*p<0.05,**p<0.01,***p<0.001)。比例尺:(A)100μm;(C)100μm。
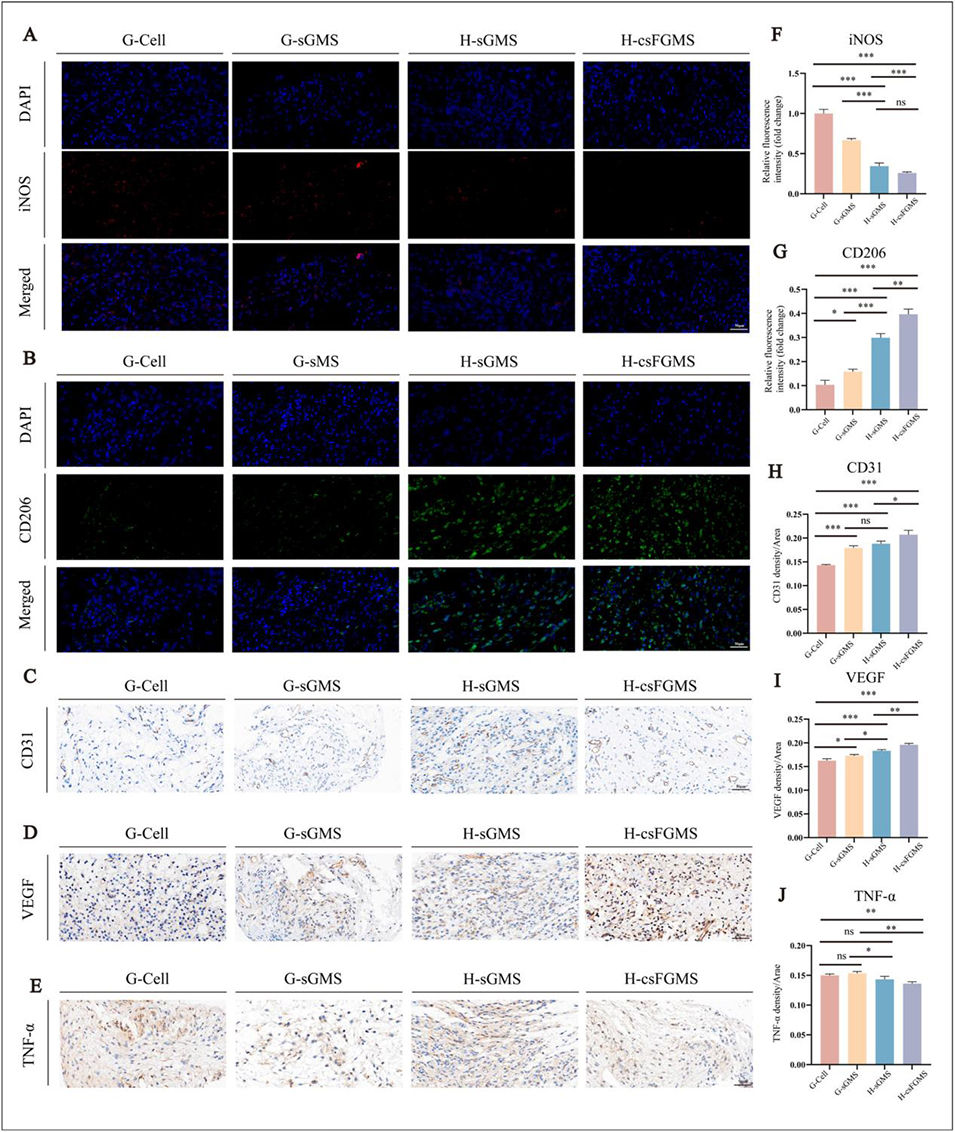
图7 不同生物墨水和微球结构的打印构建体在体内的免疫调节和血管生成作用。
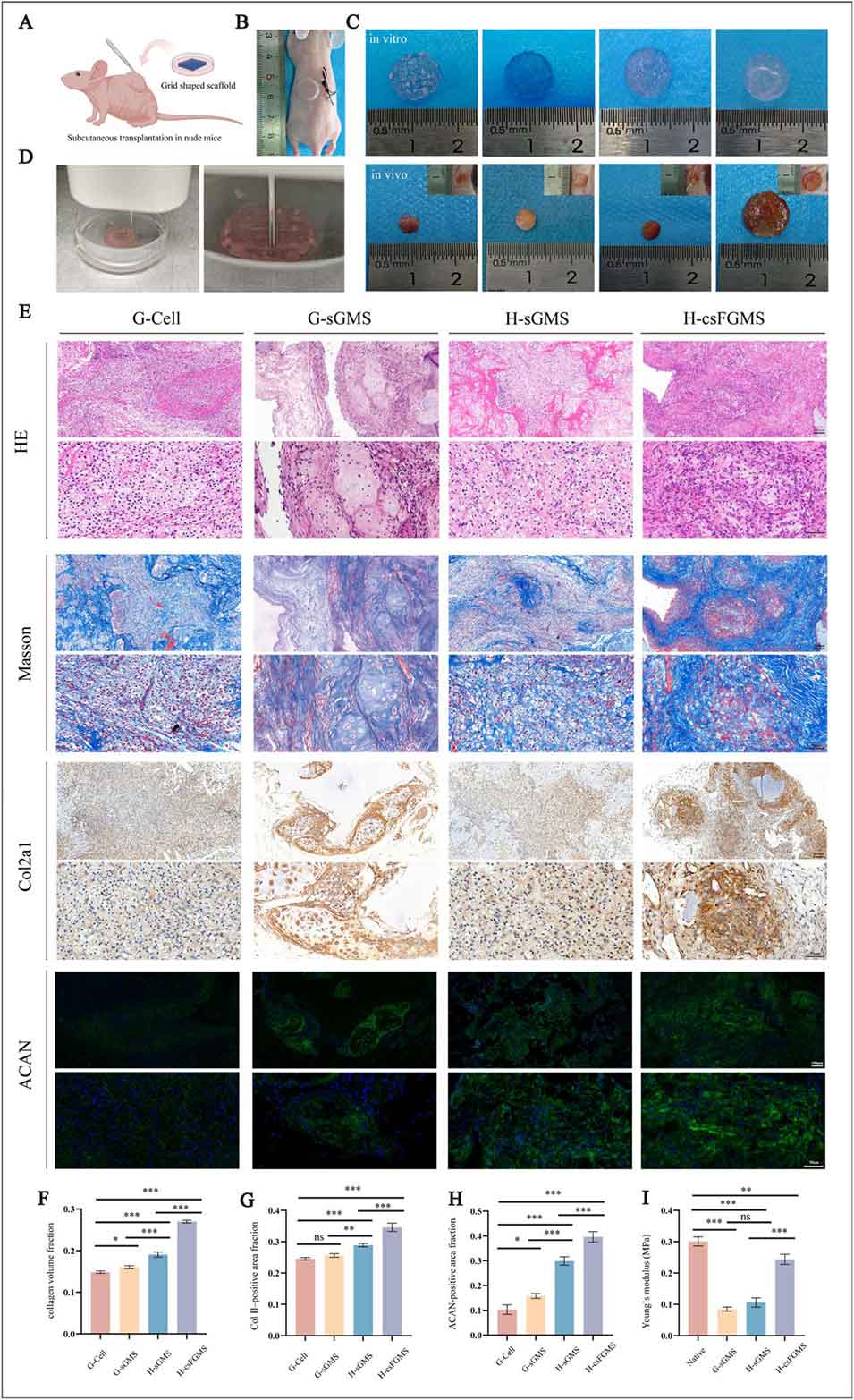
图8 不同生物墨水和微球结构的打印构建体在体内的评估结果。
论文链接:https://doi.org/10.1016/j.mtbio.2026.102826
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














