研究背景:
心血管疾病是全球死亡的主要原因之一,因此发展体外心血管模型对疾病建模和药物实验至关重要。微流控技术可以创建具有生理相关性的培养模型,模拟体内血管微环境的特征。然而,目前的微流控技术存在局限性,主要表现为矩形截面和单一或非同步的机械刺激,限制了其在模拟真实血管环境方面的应用。

导读:
近期,香港城市大学孙东教授&于欣格教授提出了一种新策略,通过创建圆形可变形软微流道作为体外人工血管,开发具有血管生理力学微环境的体外模型。相关研究成果以“Artificial Vascular with Pressure‐Responsive Property based on Deformable Microfluidic Channels”为题目,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、本研究提出了一种新策略,利用圆形可变形软微流控通道创建体外人工血管模型,以重建体内血管的生理力学环境。2、通过在软微通道中培养内皮细胞,评估了重建的生理力学微环境对内皮细胞的影响。
3、利用压力响应性材料构建了多种形状的微通道,包括曲线、狭窄和分叉通道。
4、设计了循环性压力刺激的圆形狭窄模型,以模拟动脉粥样硬化病理流动。
5、软微通道可以集成到传统的微流控器件中,形成复杂的多功能系统,用于模拟气体交换和物质转运。
全文总结/概括:
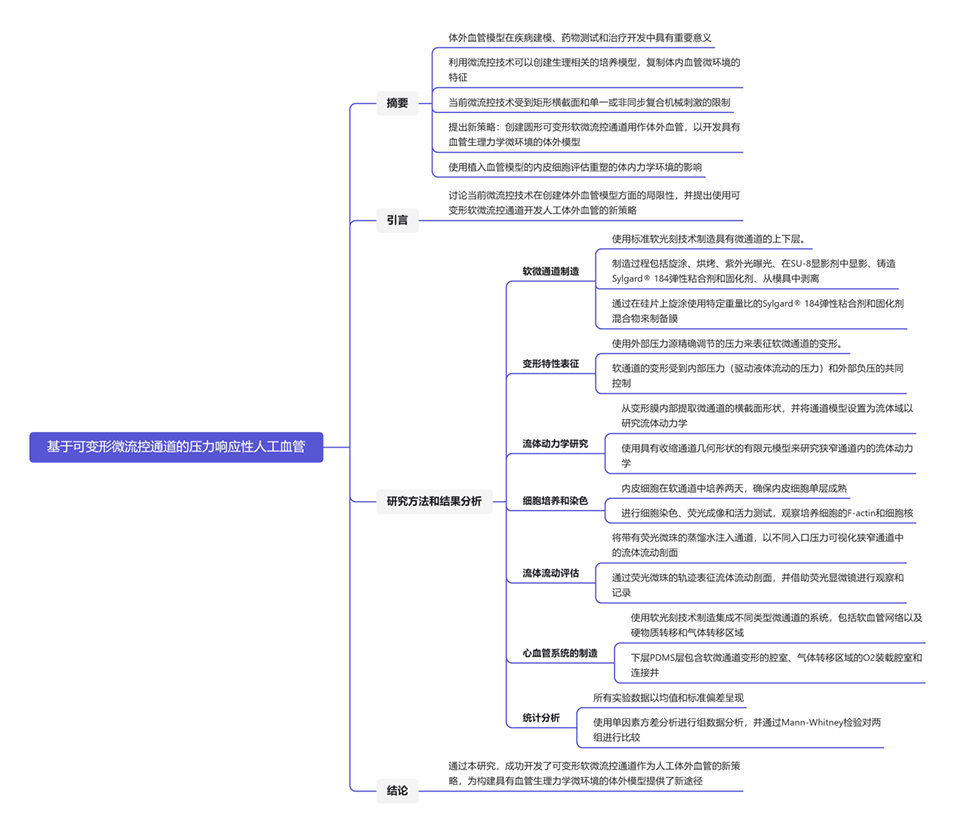
当前微流控技术在构建体外血管模型方面存在以下限制:
1.几何形态限制:常见的微流控通道具有矩形横截面,难以准确模拟复杂血管的几何形态,此外,该矩形截面形态往往会导致剪切力分布不均匀,影响模型的真实性和准确性。
2.制造方法限制:常用的光刻技术通常只能产生矩形横截面的光刻图案,无法满足复杂血管形态的要求。三维打印技术虽然可以制造圆形或半圆形横截面的微通道,但存在分辨率不足、表面粗糙和打印材料生物相容性等问题。
3.复杂几何形态挑战:制造具有复杂几何形态的通道,如闭环、回流和高轴向偏转,仍然具有挑战性,难以实现脱模和精确复制。
4.血管壁可变形挑战:制造可变形血管壁的接口有一定的难度,传统的硅橡胶或水凝胶形成的血管模型通常硬度较高,难以实现真实的变形模拟。
5.生理条件模拟不足:外部驱动的血管拉伸模拟与生理条件存在显著差异,忽略了脉压和流量的动态和时间耦合,影响模型的生物相似性。
6.生物打印技术限制:生物打印作为新兴技术,虽然有望解决复杂血管模型制造问题,但仍需进一步发展和完善,包括材料选择、打印精度和生物相容性等方面的挑战。
基于可变形微流控通道构建人工血管具有以下优势:
1.更接近生理环境:可变形微流控通道可以模拟血管内复杂的生物物理环境,包括血液流动、血压变化和血管壁的变形,使得人工血管模型更接近真实生理条件。
2.复杂几何形态:可变形微流控通道设计灵活,可以实现复杂的几何形态,如闭环、回流和高轴向偏转,更好地模拟真实血管结构,提高模型的准确性和生物相似性。
3.多功能性:可变形微流控通道可以集成到传统微流控系统中,实现多功能复合系统,为研究提供更多可能性,如模拟不同疾病状态或药物效应等。
4.简化制造过程:相比传统制造方法,可变形微流控通道的制造方法更简便,避免了光刻和三维打印技术存在的问题,如分辨率不足和生物相容性等挑战,提高了制造效率和可控性。
5.更好的细胞反应:在可变形微流控通道中培养内皮细胞等细胞可以更好地模拟生物力学环境,促进细胞的生长、分化和功能表达,有助于探究血管疾病的发病机制以及评估药物的疗效。
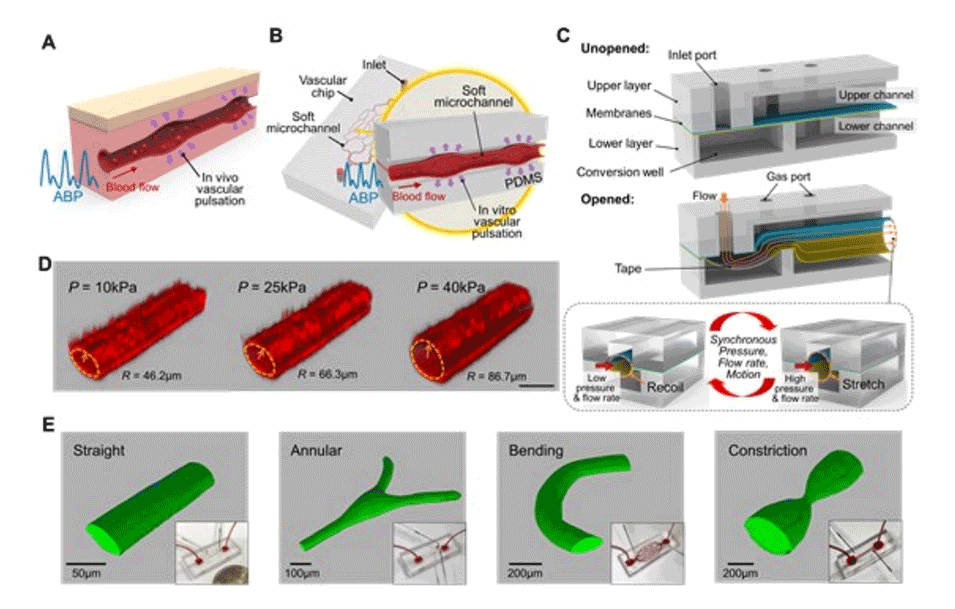
图1.微流控人造动脉芯片示意图
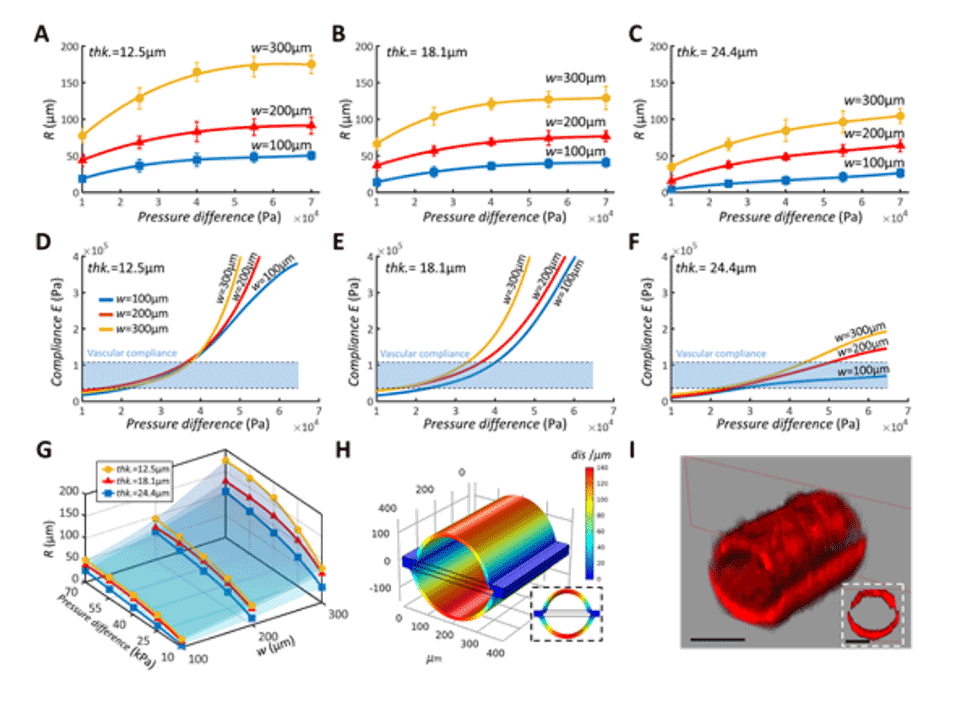
图2.软微通道变形的表征
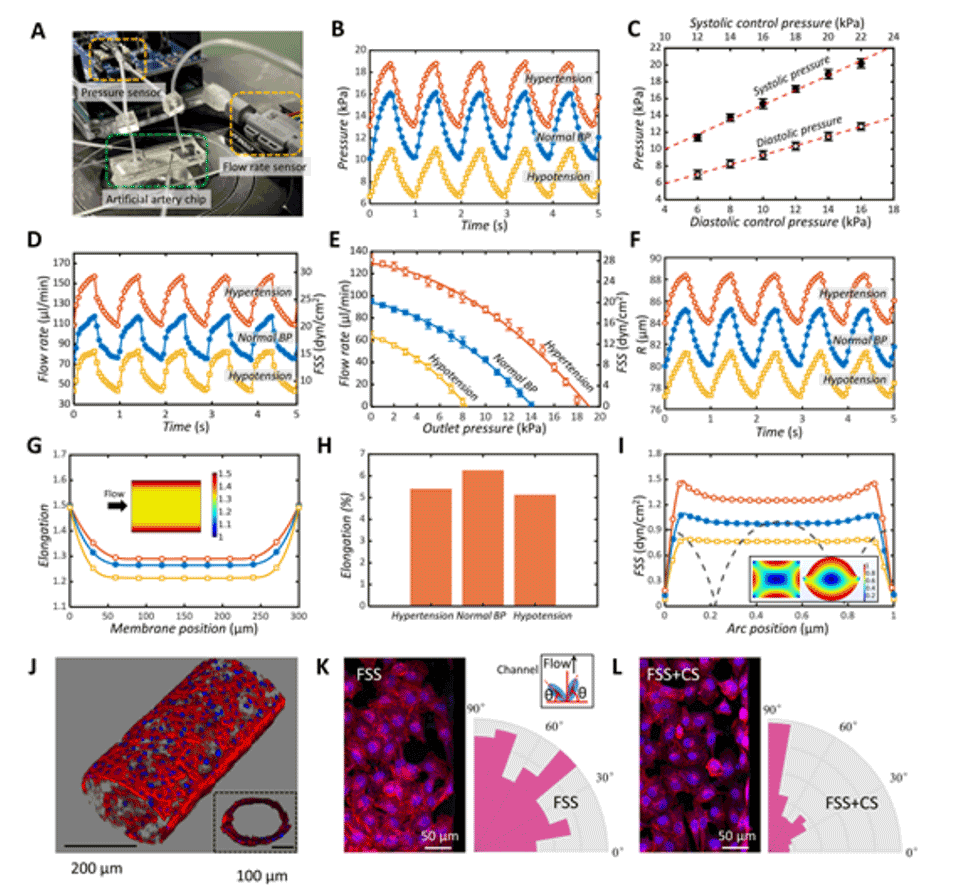
图3.人造动脉芯片中的脉动机械力
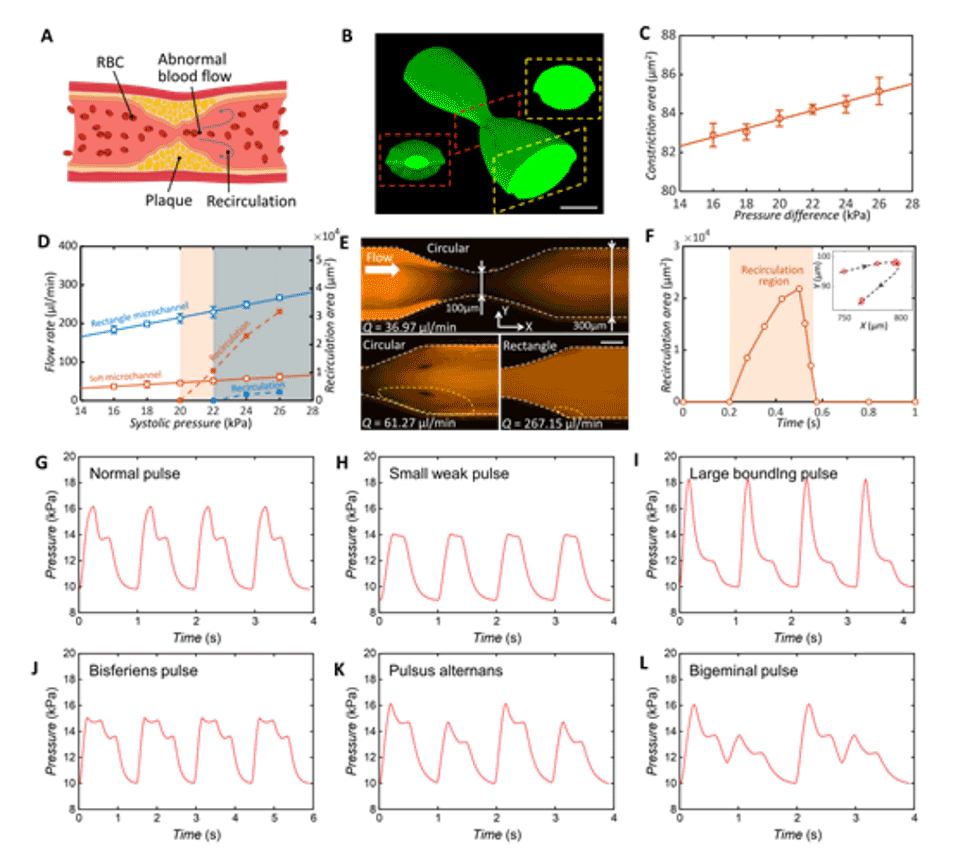
图4.模拟血管狭窄的狭窄通道研究
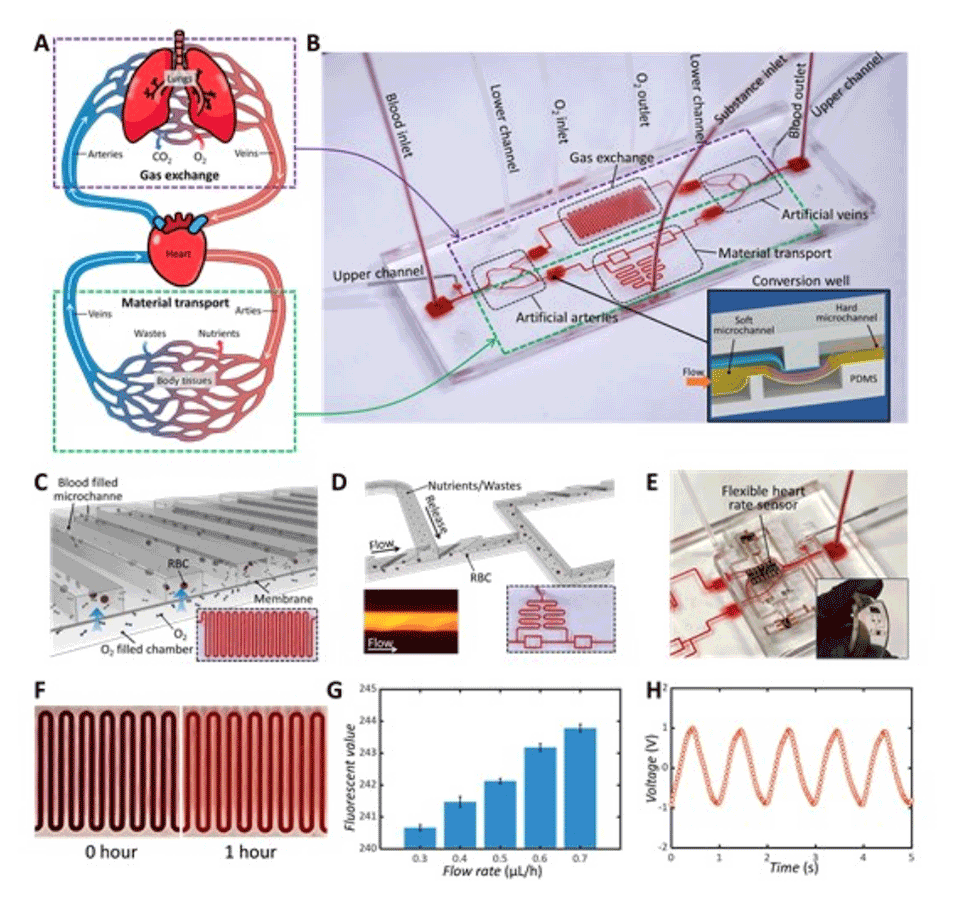
图5.由扩展的软微通道和硬质微流控设备组成的心血管系统
论文链接:https://doi.org/10.1002/adhm.202304532














