
导读:
近期,中国农业大学林建涵教授团队成功开发了一种基于壳聚糖修饰的PDMS核酸纯化通道和RAA-T7-CRISPR/Cas13a核酸定量系统的新型离心微流控平台,用于食源性病原体的快速检测。相关研究以“A centrifugal microfluidic platform for rapid detection of pathogens based on chitosan nucleic acid extraction and RAA-T7-CRISPR/Cas13a nucleic acid detection”为题目发表于期刊《Sensors and Actuators B: Chemical》。
本文要点:
1、本研究开发了一种新型细菌检测平台,利用壳聚糖进行核酸提取、RAA-T7-CRISPR/Cas13a系统进行核酸定量,并结合离心微流控芯片实现全自动操作。
2、通过壳聚糖静电吸附捕获细菌样品中的核酸,然后经乙酸钠缓冲液洗涤和Tris-HCl缓冲液洗脱,最终在RAA-T7-CRISPR/Cas13a系统中等温扩增并实时检测产生的荧光信号。
3、该离心微流控芯片设计精巧,包括壳聚糖修饰通道、八个功能腔室和三个虹吸阀,实现了核酸的自动捕获、洗涤、洗脱、扩增和检测。
4、该平台可在1小时内自动检测沙门氏菌,在最佳使用条件下,该平台对鸡上清液的检测限为10CFU/mL,平均回收率为106.9%,标准差为6.4%。
5、这一创新平台具有扩展至多目标检测的潜力,通过利用不同的RAA引物和crRNA,可适用于多种目标的同时检测,从而提高其在各种环境中的通用性和实用性。
全文总结/概括:
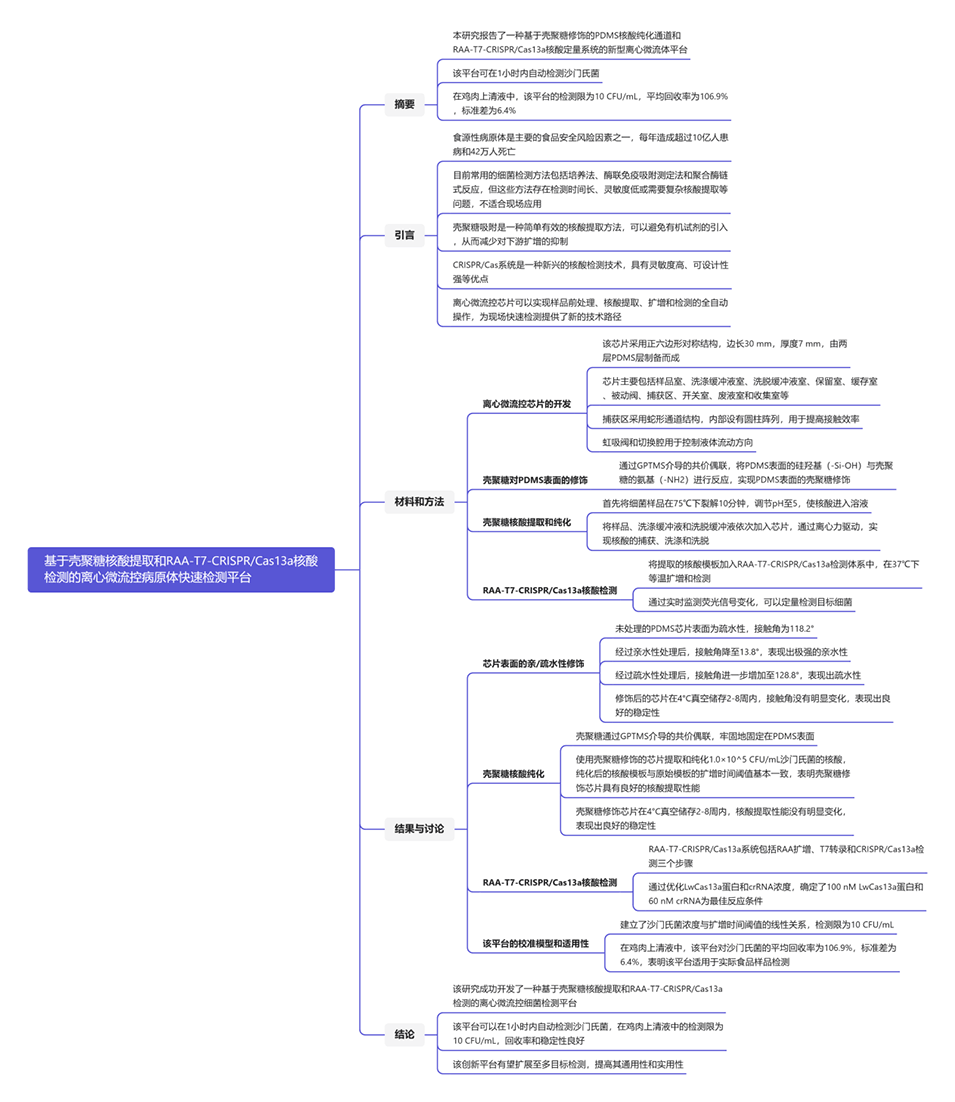
该细菌检测平台的关键组成部分包括:
1、离心微流控芯片:
设计有壳聚糖修饰的PDMS通道、8个功能腔室和3个虹吸阀。
实现了核酸捕获、洗涤、洗脱、扩增和检测等自动化样品处理。
2、基于壳聚糖的核酸纯化:
通过GPTMS介导将壳聚糖共价固定在PDMS表面。
利用静电吸附作用从细菌样品中高效捕获和纯化核酸。
3、RAA-T7-CRISPR/Cas13a核酸检测:
结合了重组酶辅助扩增(RAA)、T7体外转录和CRISPR/Cas13a系统。
实现了等温扩增和实时荧光检测目标细菌DNA。
使用CRISPR/Cas13a系统进行核酸检测具有以下优势:
1、高灵敏度:
CRISPR/Cas13a系统可以检测到aM水平的核酸,具有极高的灵敏度。
这使得该平台能够检测到极低浓度的细菌样品。
2、高特异性:
通过设计特异性的crRNA序列,CRISPR/Cas13a系统能够精确识别目标核酸序列。
这确保了该平台对目标细菌具有很高的特异性,不会受到其他细菌的干扰。
3、等温检测:
CRISPR/Cas13a系统可以在37℃下进行等温扩增和检测,无需复杂的温控设备。
这简化了检测流程,有利于实现现场快速检测。
4、自动化:
将CRISPR/Cas13a系统集成到离心微流控芯片上,实现了全自动的核酸检测。
大大提高了检测效率,降低了人工操作错误的风险。
综上所述,CRISPR/Cas13a系统的高灵敏度、高特异性、等温性和可自动化等特点,使其非常适合与该离心微流控平台集成,以实现快速、灵敏和自动的细菌检测。
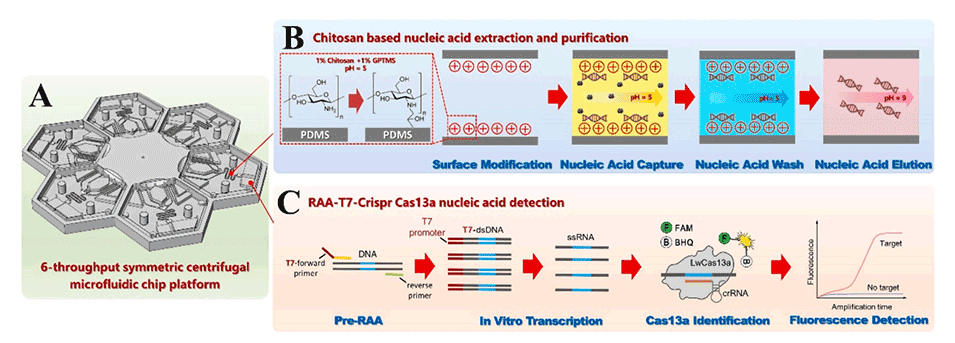
图1.该细菌检测平台的工作原理。
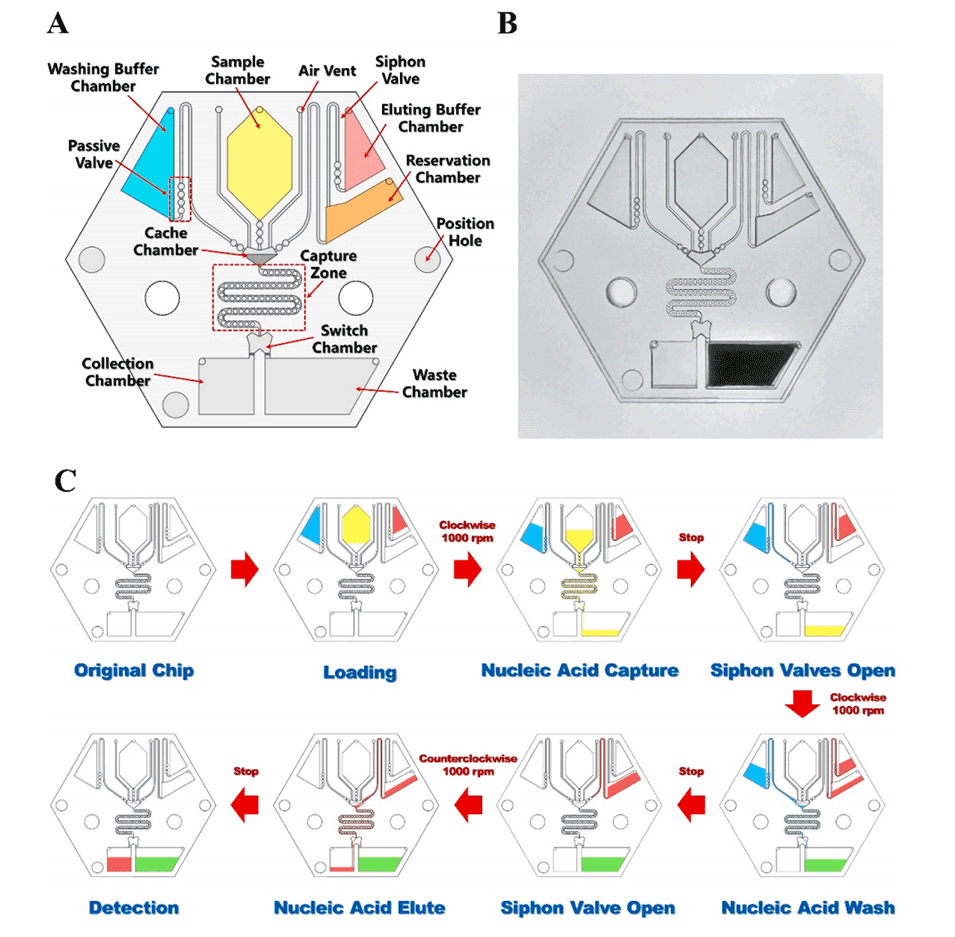
图2.离心式微流控芯片的设计和工作流程。
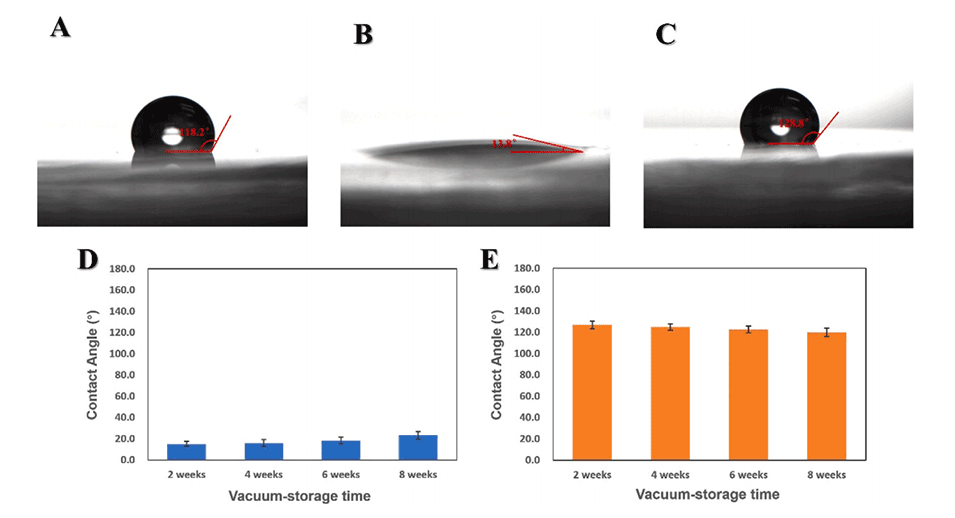
图3.微流控芯片的表面修饰。
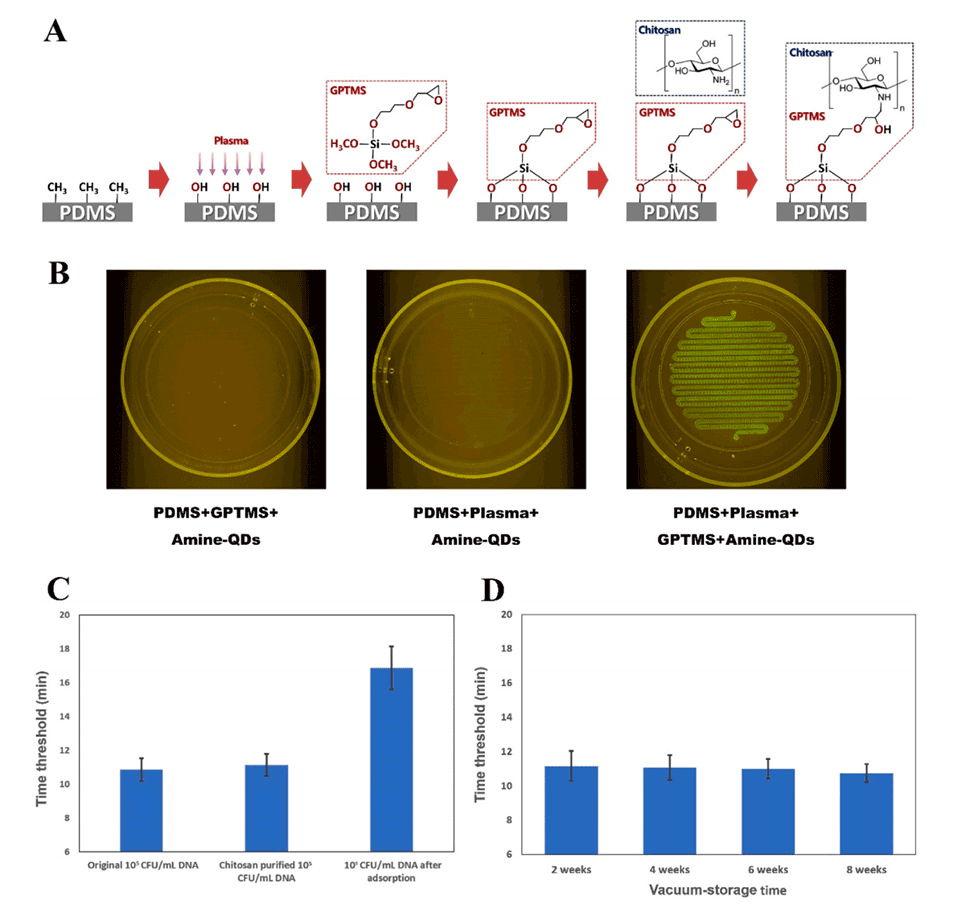
图4.基于壳聚糖的PDMS表面修饰用于核酸纯化:(A)壳聚糖修饰PDMS表面的原理。(B)荧光胺量子点修饰的验证。(C)基于壳聚糖的核酸纯化效果验证(N=3)。(D)基于壳聚糖的核酸纯化随时间的稳定性验证(N=3)。
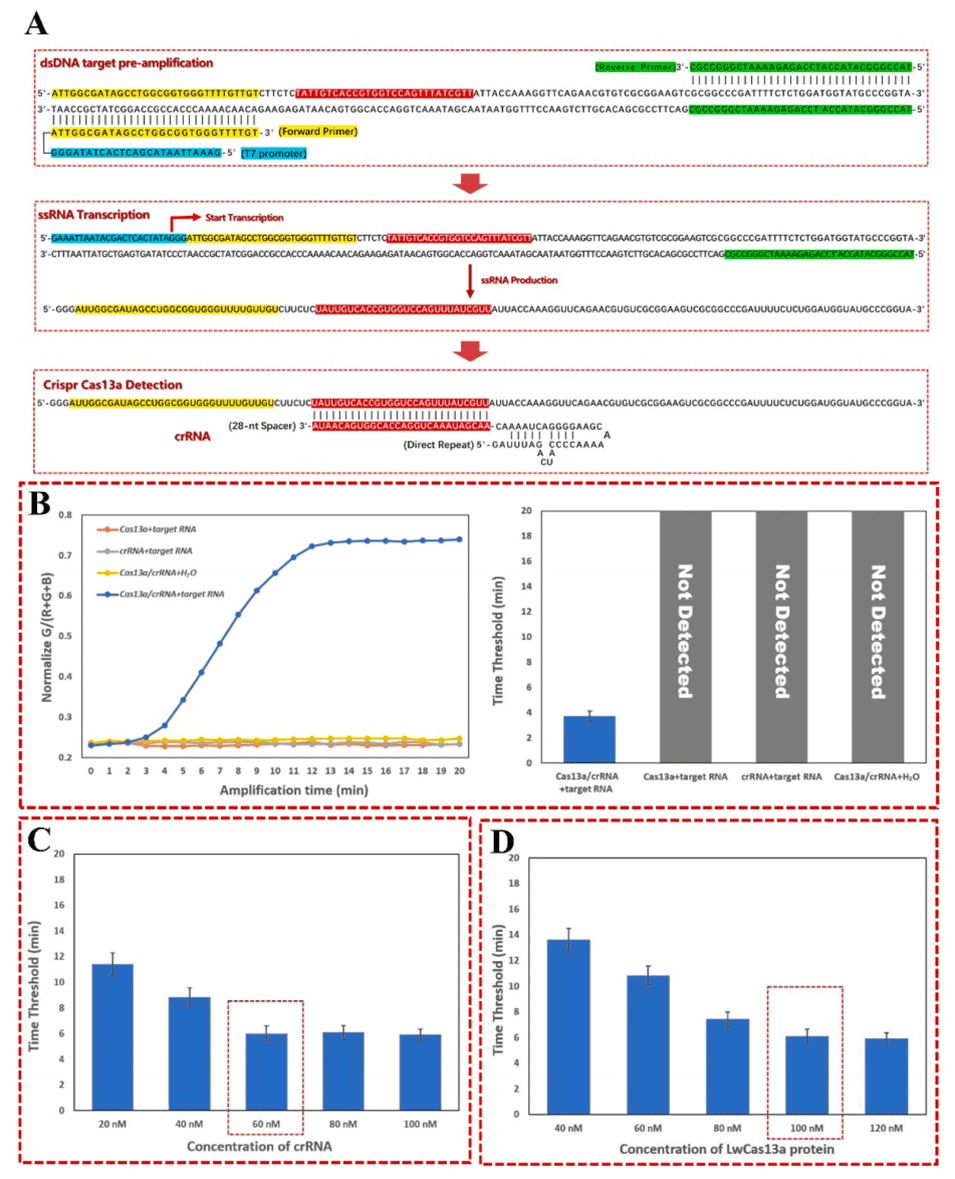
图5.RAA-T7-CRISPR/Cas13a的原理及优化。
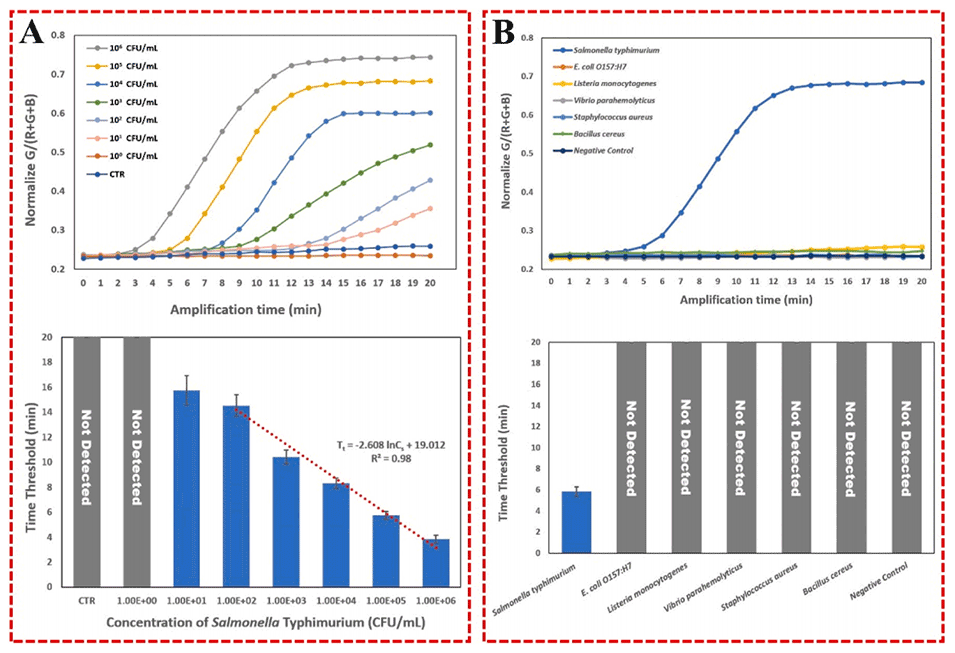
图6.(A)该离心平台的校准曲线(N=3);(B)该离心平台的特异性(N=3)。
原文链接:https://doi.org/10.1016/j.snb.2023.134223














