联合药物疗法是治疗某些耐药和难治癌症病例的有效策略。然而,由于患者肿瘤的克隆多样性以及缺乏快速药物敏感性评估方法,确定最佳药物组合和剂量是相当具有挑战性的。微流控技术为克服这一挑战提供了潜在的解决途径。

近期,南京大学许丹科教授团队提出了一种集成了稀释、处理和检测等所有过程的多功能微流控芯片平台,用于体外药物敏感性测定。相关研究以“A versatile dilution-treatment-detection microfluidic chip platform for rapid In vitro lung cancer drug combination sensitivity evaluation”为题目,发表于期刊《Talanta》。
本文要点:
1、本研究提出了一种多功能微流控芯片平台,可集成稀释、处理和检测等所有过程,用于体外药物敏感性评估。
2、该平台创新性地集成了多个模块,包括自动离散药物对数浓度生成、芯片上细胞灌流培养以及癌细胞模型的并行药物处理。
3、此外,它还与微孔板读取器或高内涵成像系统兼容,可进行快速检测和自动监测,简化了芯片上的药物评估。
4、通过评估顺铂和依托泊苷这两种药物在单药和联合治疗条件下对肺腺癌A549细胞系的效力,证明了该平台的可行性。
5、研究结果表明,与传统的微孔板静态培养方法相比,这种芯片上自动灌注生物测定方法可获得相似的IC50值,且变异性更低,药物制备时间缩短了50%。
6、这种多功能稀释-处理-检测微流控平台为快速、精确的药物评估提供了一种前景广阔的工具,有助于个性化癌症化疗中的体外药物敏感性评估。
全文总结/概括:
微流控芯片平台在肺癌药物敏感性评估中有哪些关键优势?
1、快速评估能力:该平台能够快速进行体外药物敏感性评估,加速了药物组合效果的测试过程。
2、集成化设计:集成了稀释、处理和检测等多个步骤,简化了实验流程,减少了操作复杂性。
3、自动化操作:自动化的药物对数浓度生成和细胞灌注培养减少了人为误差,提高了实验的重复性和可靠性。
4、药物组合测试:能够评估不同药物组合的效果,为个性化药物治疗提供重要信息。
5、减少资源消耗:与传统的微孔板方法相比,该平台减少了药物和试剂的用量,降低了研究成本。
该微流控芯片平台如何确保在整个培养期间细胞培养孔中的稳定药物浓度?
1、连续灌注培养模式:
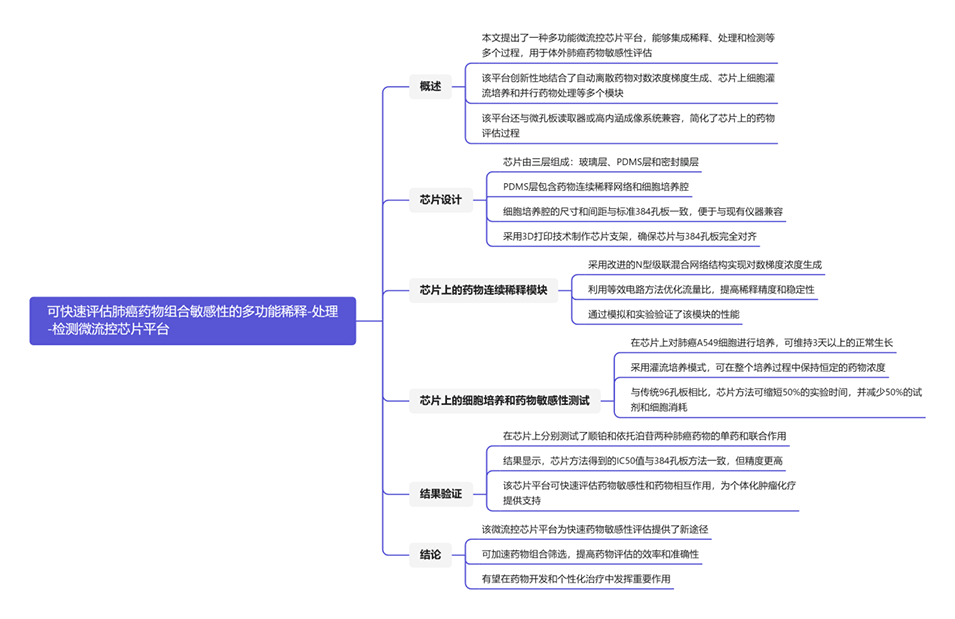
芯片设计中包含两个注射泵,分别用于输送药物溶液和稀释液(培养基)。
持续的灌注模式保证了培养孔中药物浓度的稳定,避免了传统静态培养模式下药物浓度随时间逐渐降低的问题。
2、优化微流道网络设计:
采用N型级联混合结构,可以精确生成对数浓度梯度,确保每个培养孔中的药物浓度分布均匀。
通过等效电路法计算各通道的流阻,进一步优化流速控制,确保每个培养孔中的药物浓度一致。
3、3D打印制造培养孔:
3D打印技术可以精确控制每个培养孔的尺寸,确保体积一致。
统一的培养孔体积有利于维持每个培养孔中的药物浓度稳定。
4、密封性设计:
芯片采用密封设计,防止药物溶液和培养基的挥发和泄漏,确保药物浓度的稳定性。
5、兼容性设计:
芯片与微孔板读取器兼容,方便进行快速、自动化的信号检测,避免人工操作带来的误差,进一步提高了药物浓度的稳定性。
通过以上措施,该微流控芯片平台有效地确保了在整个培养期间细胞培养孔中的药物浓度稳定,为后续的药物敏感性评估提供了可靠的保障。
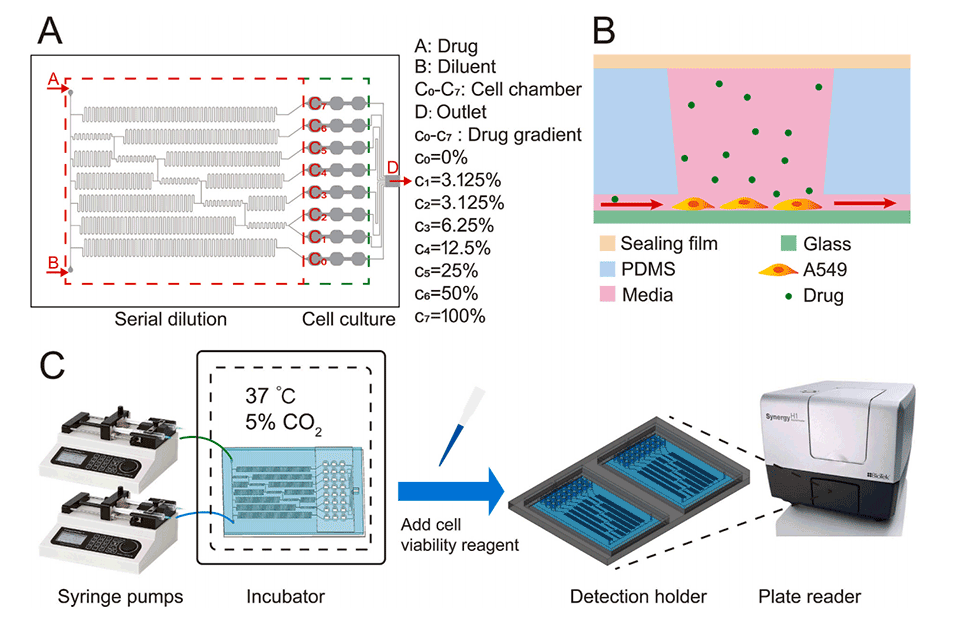
图1.稀释-处理-检测微流控芯片平台的结构。
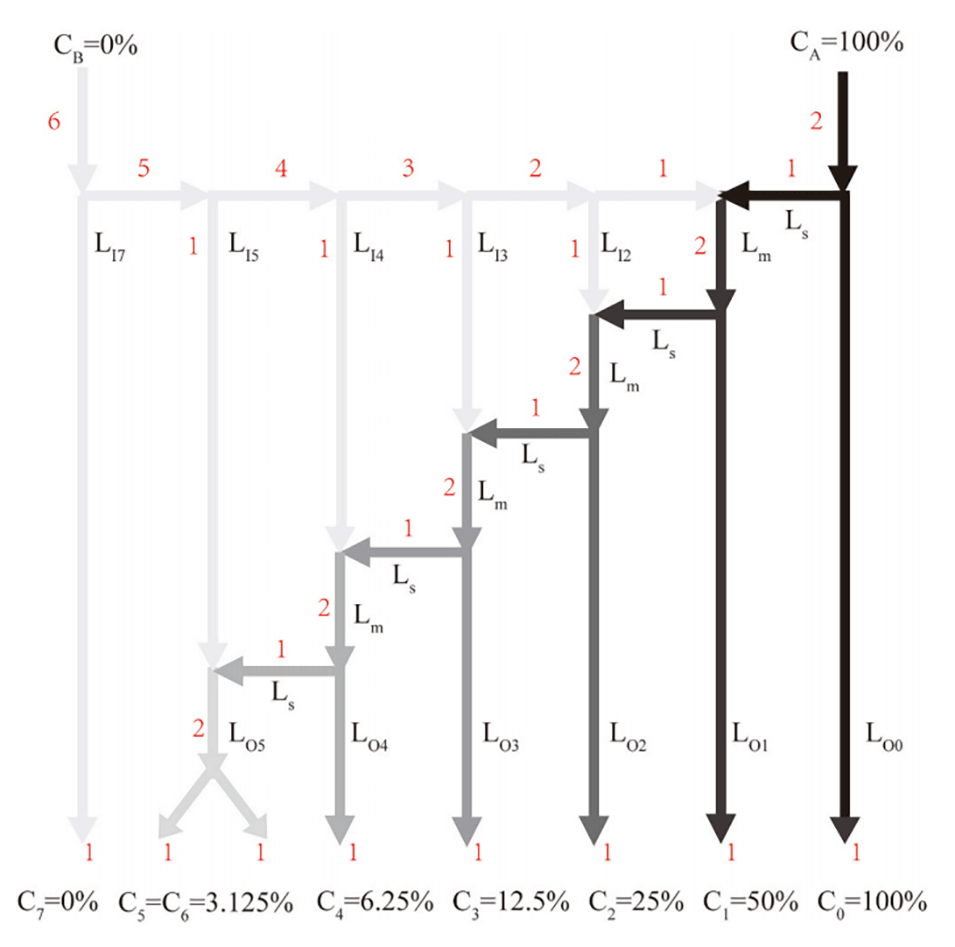
图2.1:2连续稀释微流控网络的电子类比结构。每个通道的流速用红色表示。CA、CB、C0-7表示药物浓度梯度。混合通道的长度用Lm表示,LO0-LO5和LI1-LI7表示其余通道的长度。
图3.COMSOL Multiphysics 5.4模拟的片上连续稀释模块的浓度分布。0.31mM(0.1mg/mL)的亚甲基蓝溶液和水分别用作原液和稀释液。稀释剂和药物的入口流速分别为3μL/min:1μL/min。每个细胞室和混合通道中的溶液浓度用色条表示(mM),其中红色和蓝色分别表示100%浓度和0%浓度的原始亚甲基蓝溶液。
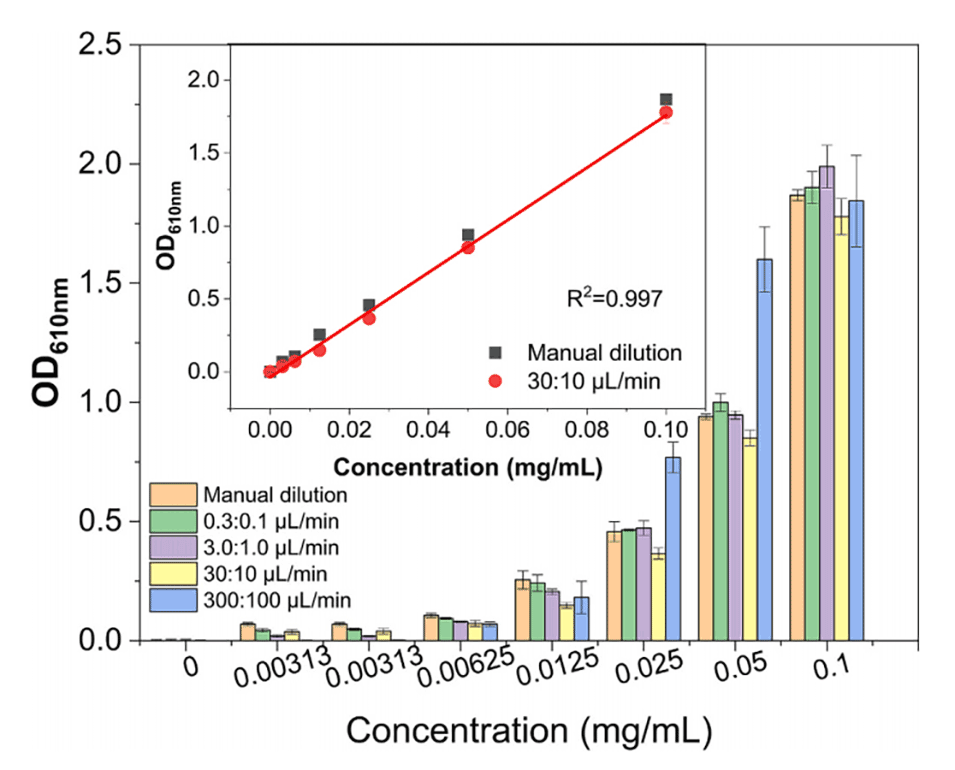
图4.微流控芯片出口处的浓度准确性。在不同的入口流速(即300μL/min:100μL/min、30μL/min:10μL/min、3μL/min:1μL/min和0.3μL/min:0.1μL/min)下,对芯片上连续稀释0.1mg/mL亚甲基蓝的浓度梯度进行了评估。内嵌图表说明了片上稀释和手动稀释方法的光密度(OD)与浓度的线性相关关系。
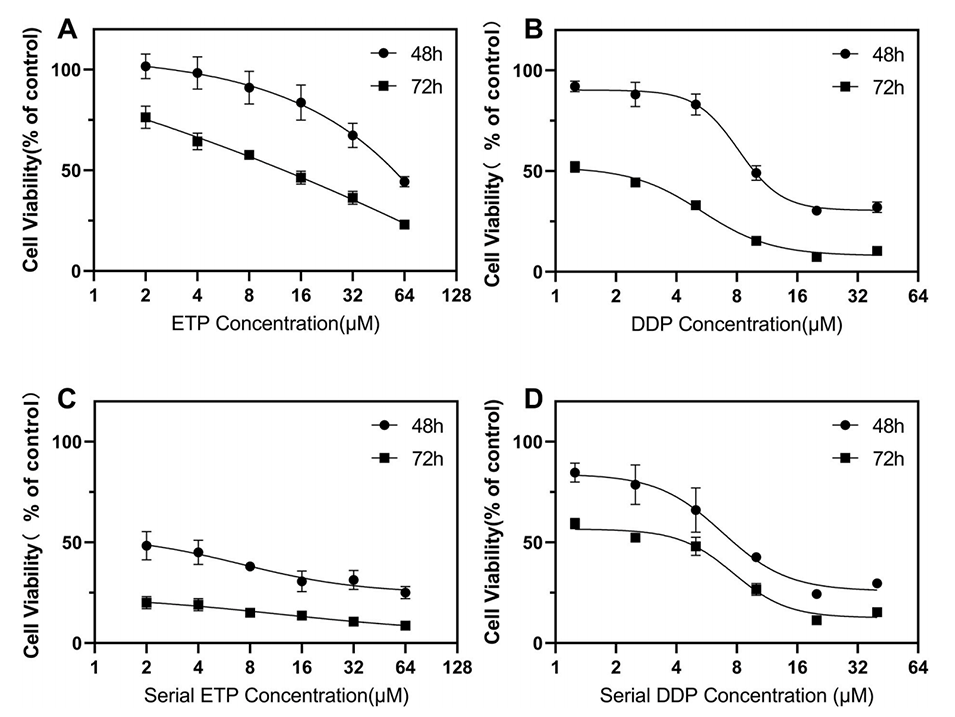
图5.在微流控芯片上通过alamarBlue法测定A549细胞对顺铂和依托泊苷的药物敏感性。
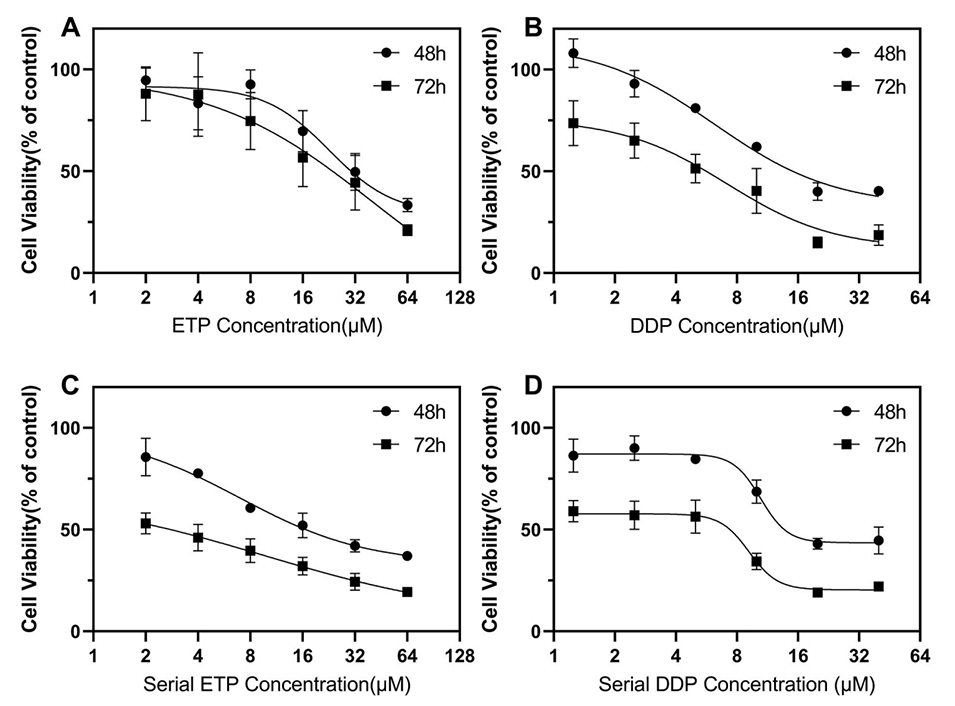
图6.在384孔微孔板上通过alamarBlue法测定A549细胞对顺铂和依托泊苷的药物敏感性。
原文链接:https://doi.org/10.1016/j.talanta.2024.126298














