作为等离子体纳米材料的一个重要分支,纳米粒子-镜面腔体具有很高的灵敏度,但复杂的制备和读出过程限制了其在生物传感中的广泛应用。另外,结合流动性和优异等离子体特性的液态金属(LM)已成为构建等离子体纳米结构的潜在候选材料。

近期,吉林大学化学学院张俊虎教授团队开发了一种基于液态金属的微流控纳米等离子体传感器平台,实现了对SARS-CoV-2抗体的高灵敏度、宽动态范围的裸眼检测,且具有快速、便携和适用于即时检测的优势。相关研究以“Liquid-metal-based microfluidic nanoplasmonic platform for point-of-care naked-eye antibody detection”为题目,发表在期刊《Biosensors and Bioelectronics》上。
本文要点:
1、本研究提出了一种基于液态金属的微流控纳米等离子体平台,用于临床生物标志物的裸眼检测。
2、通过将液态金属引入蛋白包覆的金纳米粒子单层上,形成“镜面-纳米颗粒”结构,简化了传统纳米粒子-镜面腔体的制备过程。
3、该装置对生物分子层的厚度和折射率变化做出响应,能够输出高灵敏度(检测限约604fM)和宽动态范围(6个数量级)的肉眼可读信号。
4、新的检测方法可在30分钟内生成定量结果,支持高通量、基于智能手机的SARS-CoV-2抗体检测,适用于多种变异株的临床血清或血液样本。
5、这些结果为使用液态金属材料的即时检测开辟了先进途径,并展示了其在促进各种传染病的诊断、监测和流行病学研究方面的潜力。
全文总结/概括:
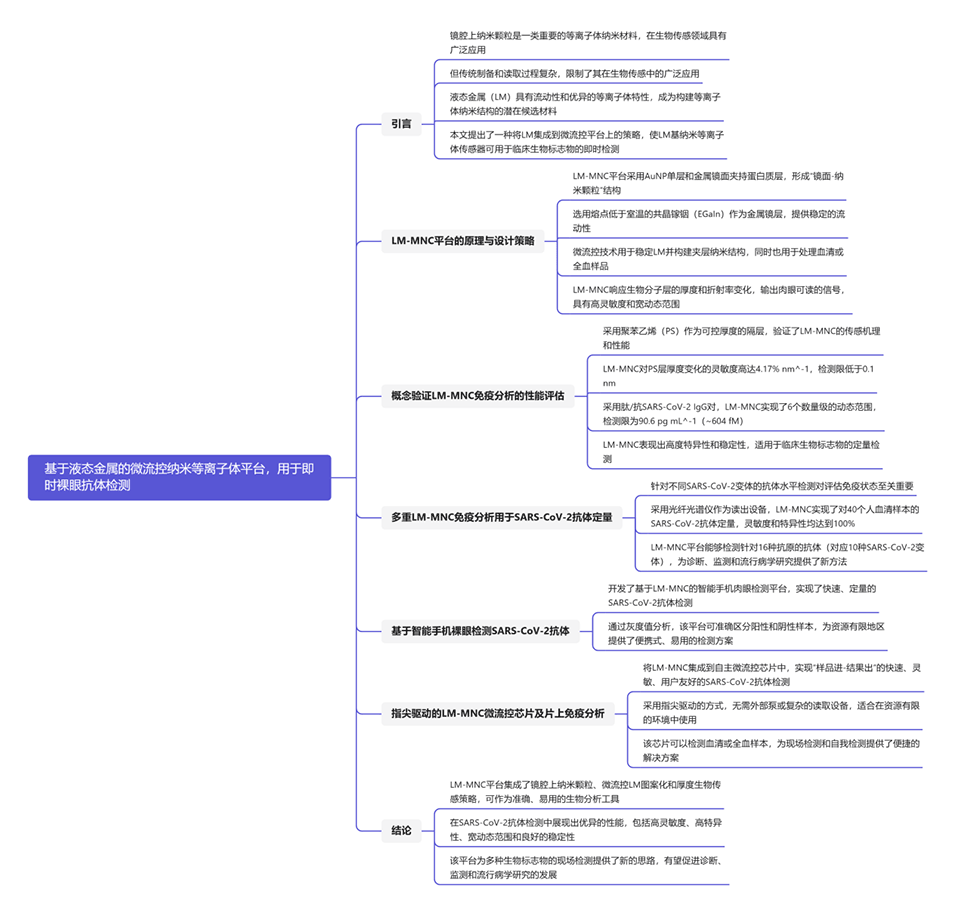
微流控集成策略通过以下方式简化了纳米等离子体传感器的制造过程:
1、稳定液态金属:
微流控通道的设计有助于在构建夹层纳米结构时稳定液态金属(如共晶镓铟),确保了材料的均匀分布和结构的一致性。
2、构建夹层纳米结构:
通过微流控技术,液态金属被精确地涂覆在蛋白质包覆的金纳米粒子(AuNP)单层上,形成了创新的“镜面-纳米粒子”结构,这一过程较传统固体贵金属膜的制备更为简便快捷。
3、实现微型化和功能化:
微流控集成技术有助于实现传感器设备的微型化,同时减少样本和试剂的消耗。
这一特性为即时检测(POC)应用提供了高度集成和功能化的纳米等离子体传感器,解决了传统制造方法难以实现的挑战。
LM-MNC在临床诊断方面的潜在应用主要包括:
1、现场快速检测:LM-MNC平台能够实现对临床样本的快速检测,适合在资源受限的环境中进行即时诊断。
2、高灵敏度和宽动态范围:该技术具有高灵敏度,能够检测到低浓度的生物标志物,同时拥有宽动态范围,适用于不同浓度水平的检测。
3、多路复用检测:LM-MNC支持对多种生物标志物的同时检测,有助于对多种疾病标志物进行综合分析,提高诊断的准确性。
4、低成本和易于操作:由于检测过程简单且无需昂贵设备,LM-MNC有助于降低临床检测成本,使得检测更加普及。
5、智能手机辅助检测:结合智能手机的检测方式,使得LM-MNC平台更加便捷和易于使用,便于在家庭或社区环境中进行检测。
6、疾病流行病学研究:通过高通量的检测能力,LM-MNC有助于进行大规模的疾病流行病学研究,为疾病预防和控制提供数据支持。
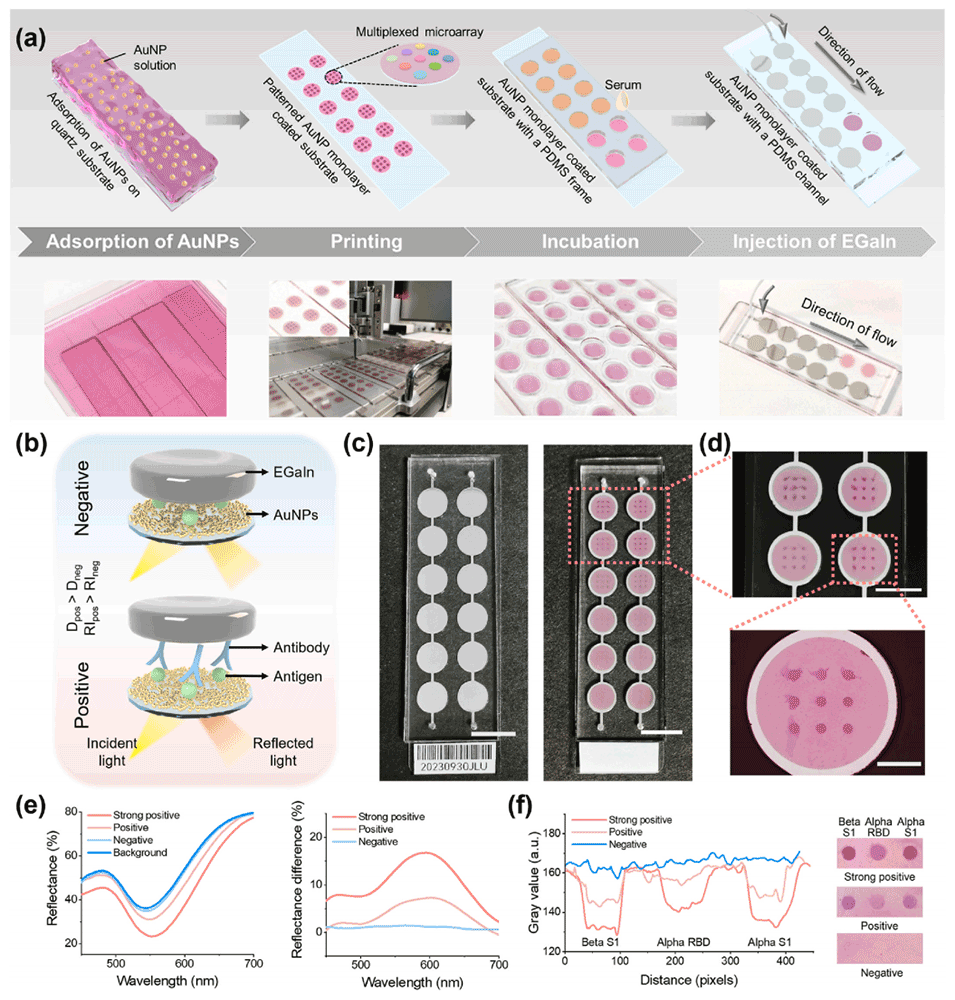
图1.使用LM-MNC平台进行的严重急性呼吸系统综合征冠状病毒2型抗体测定的原理和读出途径。
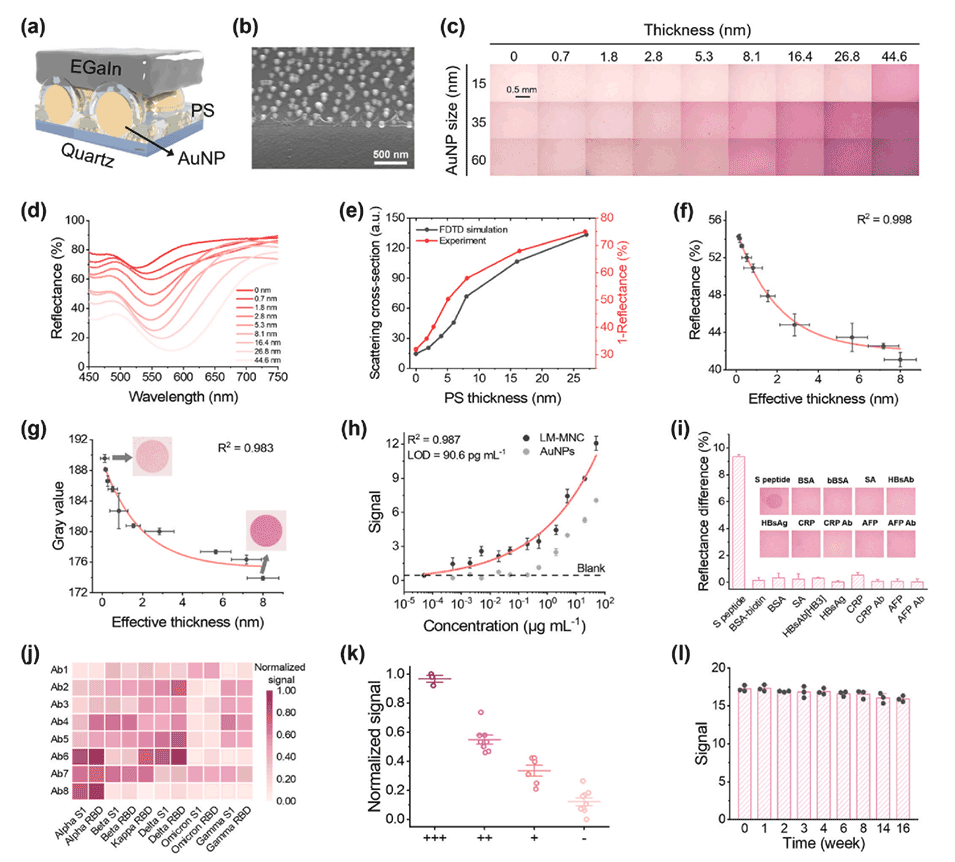
图2.概念验证LM-MNC免疫测定的性能评估。
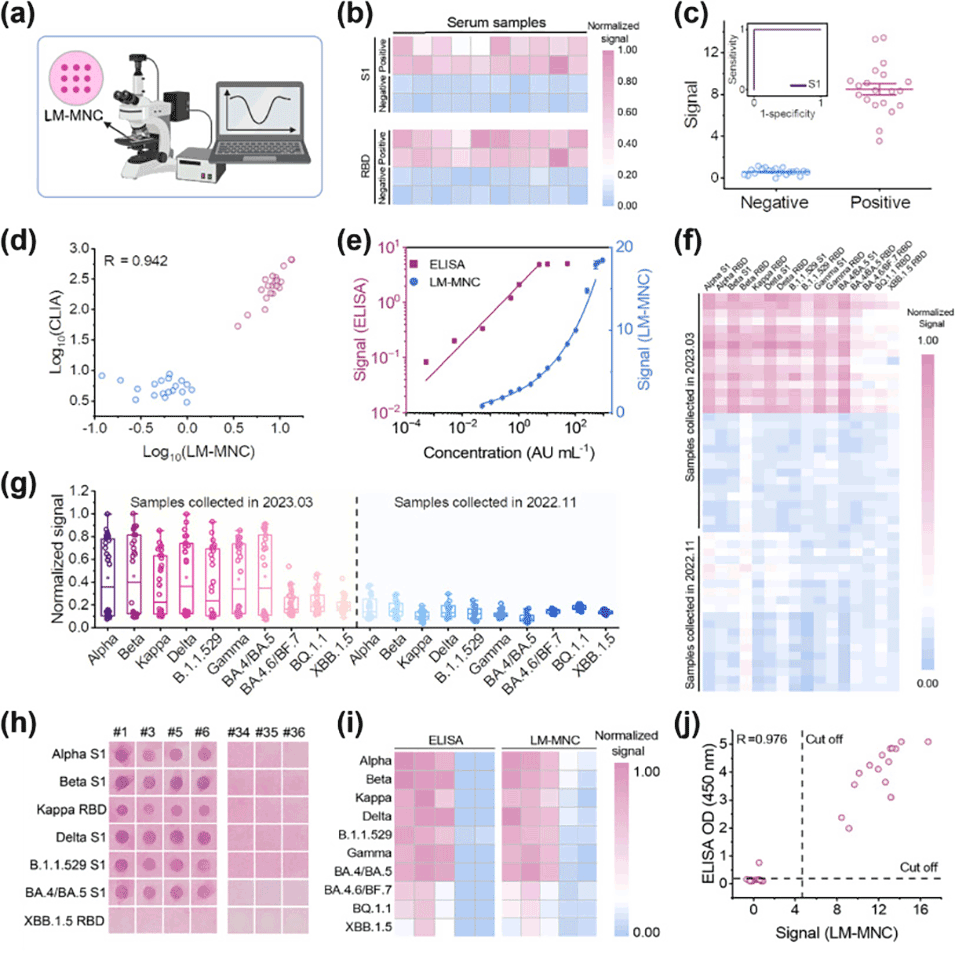
图3.LM-MNC多重免疫测定法用于使用配备光纤光谱仪的显微镜对人类血清样品中的严重急性呼吸系统综合征冠状病毒2型抗体进行定量。
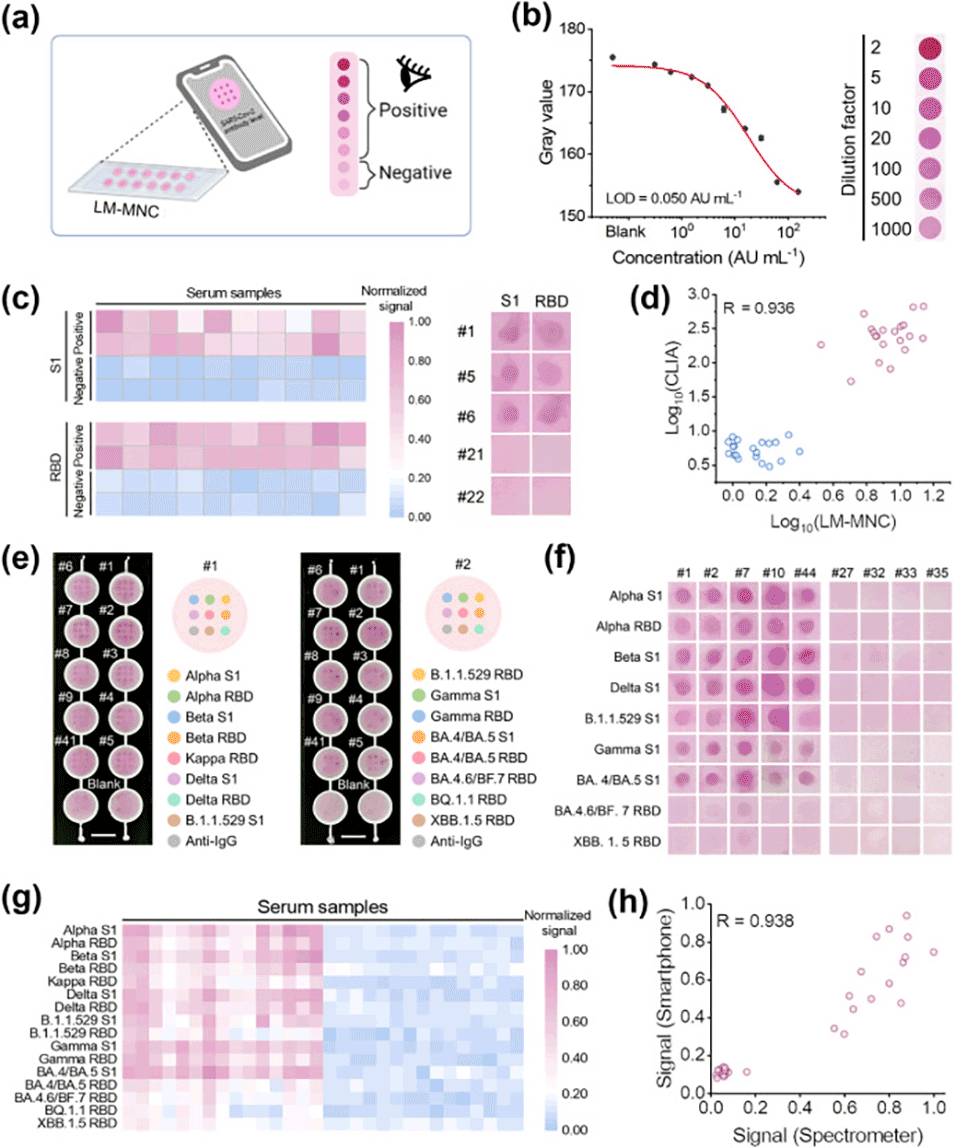
图4.使用智能手机作为读出设备进行多重严重急性呼吸系统综合征冠状病毒2型抗体定量的裸眼检测和灰度值分析。
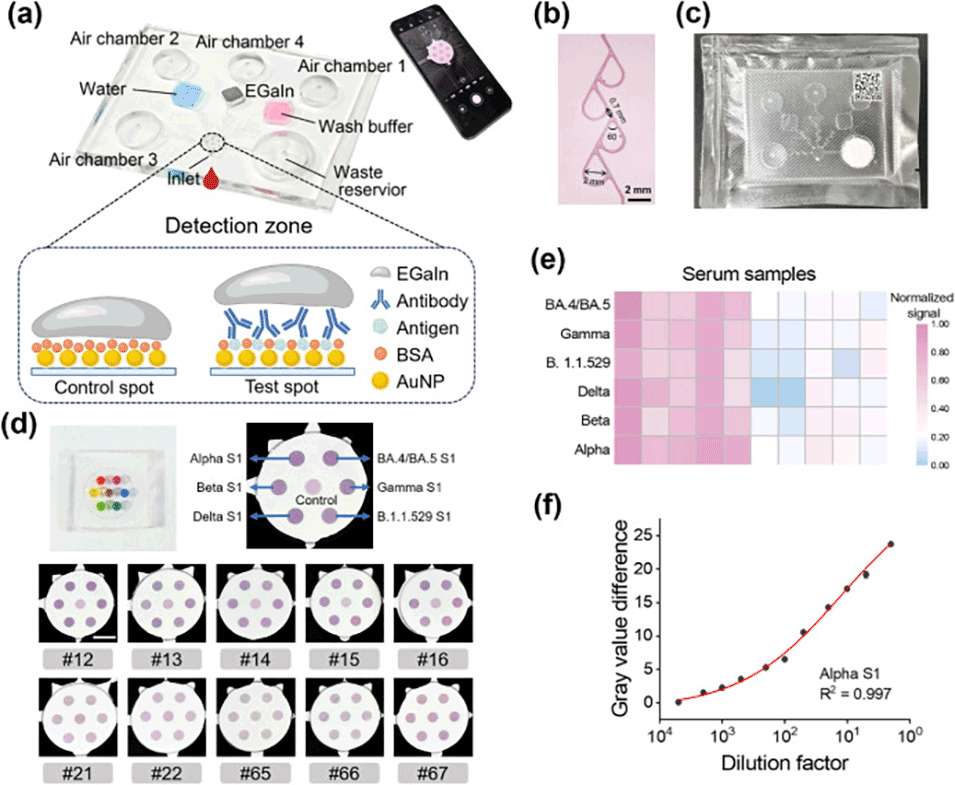
图5.手指驱动的微流控装置和芯片LM-MNC免疫测定。
原文链接:https://doi.org/10.1016/j.bios.2024.116469














