
导读:
基于体外培养原代肿瘤细胞进行的药物筛选在个性化癌症诊断领域展现出巨大潜力。尽管如此,肿瘤细胞的稀缺性,特别是在早期癌症患者中,这限制了该技术的广泛应用。近期,澳门大学贾艳伟团队联合北京科技大学姚海龙团队开发了一种利用原代肿瘤细胞进行药物筛选的数字微流控系统,该系统可针对个体癌症患者进行药物筛选并给出治疗方案,从而确保最佳治疗效果。相关研究以“Drug screening on digital microfluidics for cancer precision medicine”为题目发表于期刊《Nature Communications》。
本文要点:
1、本研究开发了一种使用原代肿瘤细胞进行药物筛选的数字微流控系统,并建立了精准医疗的工作方案。
2、开发了智能控制逻辑,以提高系统的通量并减少其占地面积,从而在一个4×4cm2的芯片上并行筛选三种药物,设备尺寸为23×16×3.5cm3。
3、在MDA-MB-231乳腺癌异种移植小鼠模型和患者肝癌标本中验证了这种方法,结果表明,用筛选出对单个原发性肿瘤细胞有效的药物对小鼠/患者进行治疗可以有效抑制肿瘤。
4、用芯片上筛选为无效的药物治疗的小鼠表现出与对照组相似的结果。
5、通过芯片筛选确定的有效药物与通过单个肿瘤的外显子组测序确定的相关基因不存在突变的一致性,进一步验证了该方案。
6、因此,该技术有望推动精准医疗在癌症治疗乃至其他疾病治疗中的应用。
全文总结/概括:
数字微流控系统在癌症精准医疗中相比传统方法的优势包括:
1、样本需求量少:DMF技术可以使用非常少量的样本进行药物筛选,这对于获取困难或数量有限的原代肿瘤细胞尤其重要。
2、高通量筛选:数字微流控平台能够同时进行多个药物或多个样本的筛选,提高了实验的效率和通量。
3、精准控制:DMF系统提供精准的液滴操控能力,可以精确控制药物浓度和反应条件,从而获得更可靠的实验结果。
4、减少操作复杂性:相比传统细胞培养和药物筛选方法,DMF系统的操作更为简便,减少了人为操作的复杂性和出错率。
5、成本效益:由于样本和药物用量少,DMF技术在成本上可能更具优势,尤其是在进行大规模筛选时。
6、减少患者风险:在药物筛选阶段使用更少的生物样本意味着对患者的侵入性更小。
7、快速反馈:DMF系统能够快速进行药物筛选并提供结果,有助于加速精准医疗方案的制定。
数字微流控技术在癌症精准医疗中的实际应用面临哪些挑战?
1、技术标准化:缺乏统一的操作和数据解读标准,可能导致不同实验室间结果的不一致性。
2、临床转化:将实验室技术转化为临床应用需要通过严格的监管审查和临床试验验证。
3、成本效益平衡:尽管数字微流控技术可能降低长期的药物筛选成本,但初期的设备投资和维护费用相对较高,这可能阻碍其在资源有限的医疗机构中的应用。
4、样本处理:原代肿瘤细胞可能比较脆弱,如何有效分离并将这些细胞加载到微流控芯片上,同时保持它们的活性和稳定性,是一个技术挑战。
5、数据解读:需要专业的生物信息学工具和知识来分析大量实验数据,这对非专业用户来说可能是个难题。
6、患者接受度:新技术的推广需要克服患者对安全性和有效性的疑虑。
7、多因素交互作用:肿瘤微环境的复杂性要求在微流控系统中精确模拟多种生物学因素的交互作用。
8、长期监测和评估:需要长期监测患者对药物的反应,以评估筛选药物的长期效果和安全性。
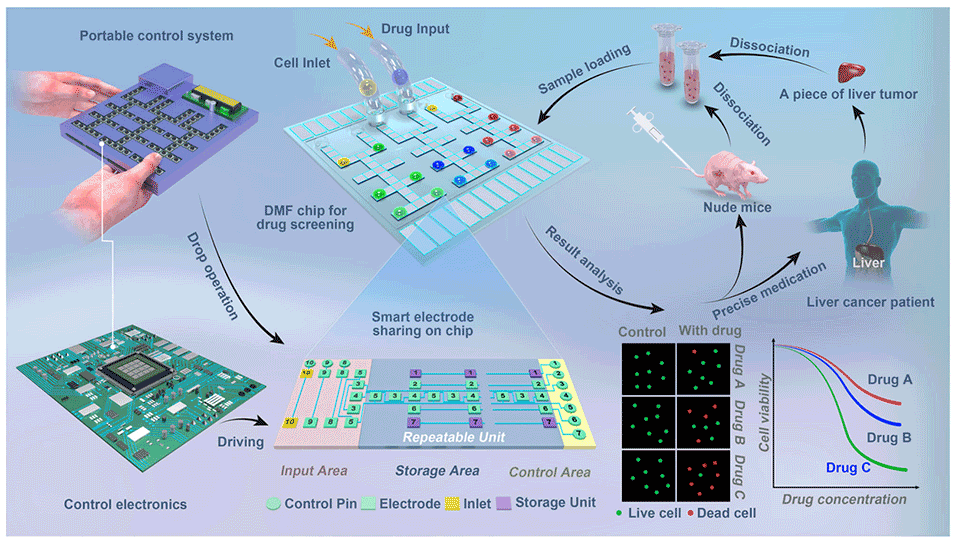
图1.用于癌症精准医疗的数字微流控药物筛选示意图。
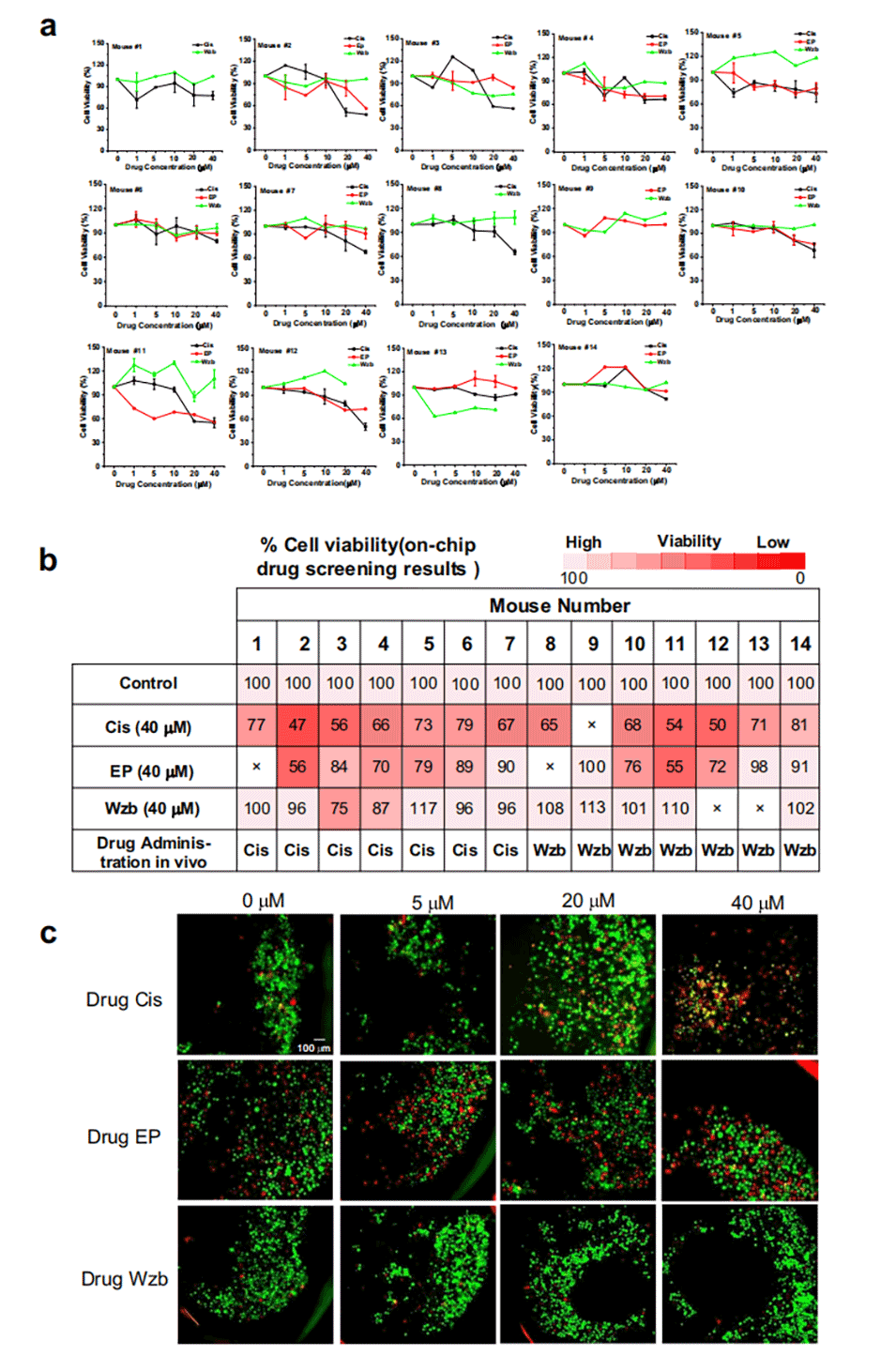
图2.芯片上的单药筛选。
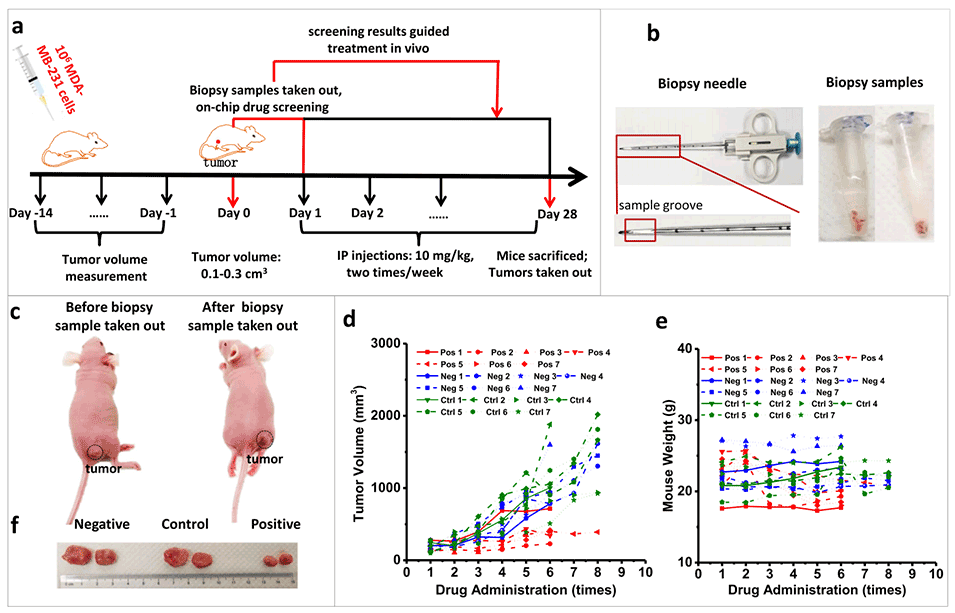
图3.单药体内治疗过程与结果。
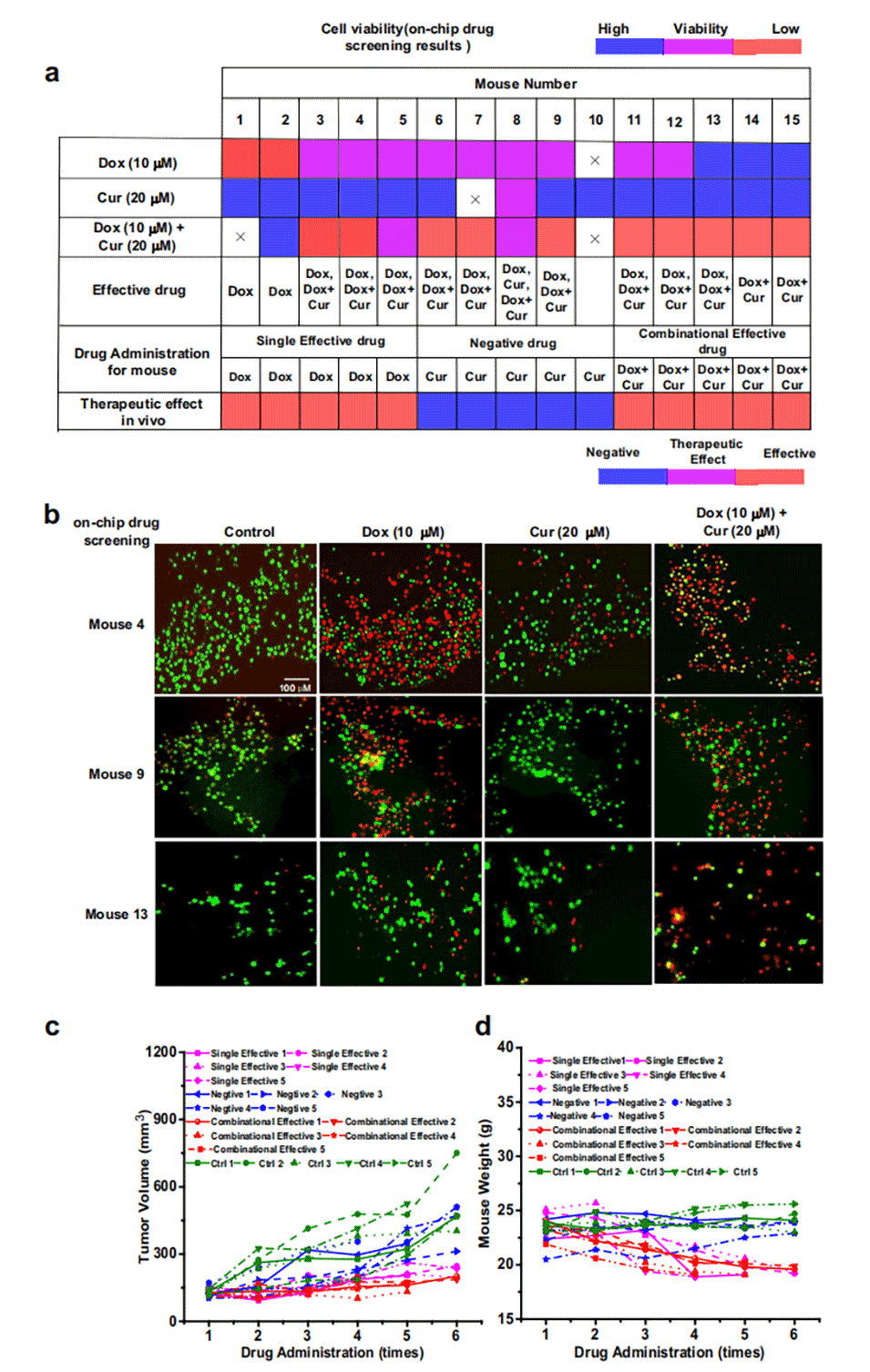
图4.芯片上的组合药物筛选和体内治疗。
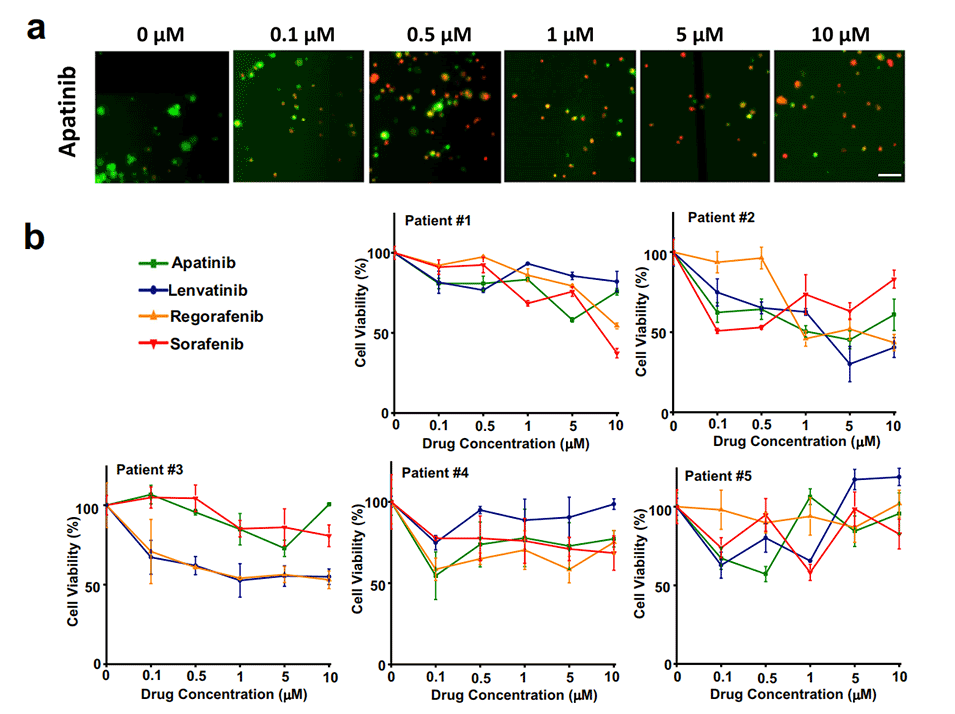
图5.利用便携式数字微流控(DMF)系统对五名肝癌患者进行四种临床抗癌药物的芯片药物筛选结果。
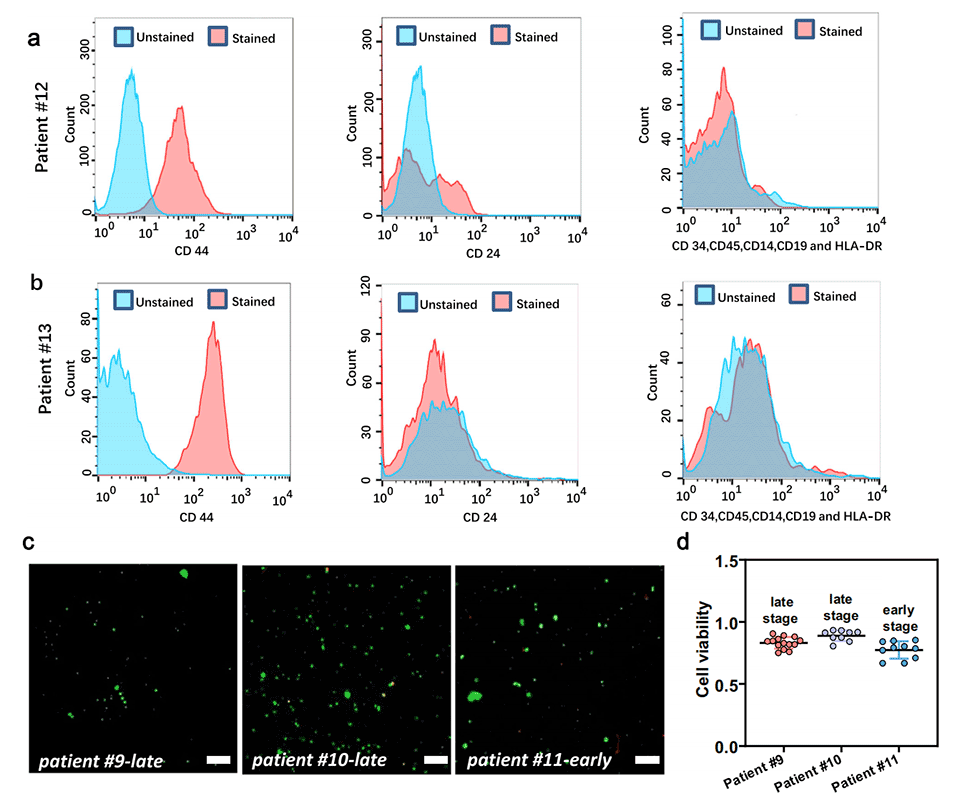
图6.人类患者活检样本的表征。
原文链接:https://doi.org/10.1038/s41467-024-48616-3














