数字PCR是一种强大的核酸绝对定量方法,广泛应用于病毒拷贝数绝对定量、肿瘤标志物检测和产前诊断等领域。然而,现有的商用ddPCR平台通常将液滴生成、PCR反应和液滴检测分别在不同的仪器中进行操作,这增加了操作的复杂性和时间的消耗。因此,将ddPCR工作流程集成到全自动化的一体化平台中,使ddPCR既易于使用又实用,是目前研究的核心理念之一。

近期,中南大学湘雅医院姜志平团队开发了一种创新型集成数字液滴PCR平台,该平台利用尖端的微流控技术,将液滴生成、PCR扩增和液滴检测操作步骤集成到单个芯片上,加样后自动分析数据,满足了“样品进,结果出”的临床要求。相关研究以“Analytical validation of the DropXpert S6 system for diagnosis of chronic myelocytic leukemia”为题目,发表在期刊《Lab on a Chip》上。
本文要点:
1、本研究开发了一种创新与集成的新型数字液滴PCR平台,即DropXpert S6系统,其通过尖端的微流控技术,将液滴生成、PCR扩增和荧光成像等功能集成于一体,实现了全自动化操作。
2、该研究首次验证了DropXpert S6系统的性能,从准确度、检测限、线性度和精密度四个方面重点评估了其在慢性髓系白血病(CML)诊断中的可靠性、重复性和一致性。
3、该系统在多次独立实验中表现出一致的结果,相同样本在不同时间点的检测结果高度一致,与传统ddPCR平台相比,DropXpert S6在CML患者的分子检测中显示出高度一致的结果,展示了其在CML分子检测、临床评估和治疗管理中的重要潜力。
4、总之,高度自动化和精确的性能使其有望成为未来临床实验室中重要的检测工具,促进更精准个体化治疗的发展,其可重复性预示着未来在临床上的广泛应用。
全文总结/概括:

DropXpert S6系统在慢性髓性白血病(CML)诊断中的具体优势包括:
1、全流程集成:DropXpert S6系统将液滴生成、PCR扩增和荧光成像集成在一个自动化平台上,实现了从样本到结果的全自动化操作。
2、高灵敏度检测:采用数字PCR技术,该系统能够对CML患者的BCR-ABL融合基因进行高灵敏度检测,这对于疾病的早期诊断和监测至关重要。
3、操作简便性:简化了传统数字PCR的操作步骤,系统配备直观的用户界面,降低了操作难度,即使是非专业人员也能快速上手。
4、高重复性和可靠性:通过减少液滴转移等步骤,降低了样本损失和交叉污染的风险,提高了实验结果的重复性和可靠性。
5、快速结果输出:整个检测过程耗时约2小时,能够快速提供检测结果,满足了临床快速诊断的需求。
6、高通量能力:单次实验能够同时处理多达16个样品(使用4个C4芯片),显著提高了检测效率和通量。
7、高精确度:系统的准确性评估显示,每个靶基因的绝对偏差范围在-0.1到0.08之间,均在±0.5个对数数量级内,确保了检测结果的高精度。
DropXpert S6系统在临床应用中可能面临哪些挑战?
1、技术集成的复杂性:将多个操作步骤集成到一个系统中,需要确保每个组件的高效协同工作,这在技术上是一个挑战。
2、成本效益考量:尽管自动化提高了效率,但系统的购置和维护成本可能较高,需要评估其在不同临床环境中的经济可行性。
3、数据管理和分析:系统产生的大量数据需要有效的管理和分析工具,以确保数据的准确性和临床应用的可靠性。
4、临床验证和法规合规性:在临床应用中,系统需要经过严格的验证和测试,以满足临床诊断的准确性和法规要求。
5、用户接受度:推广新技术需要克服用户的惯性和对新系统的适应期,可能需要额外的培训和教育。
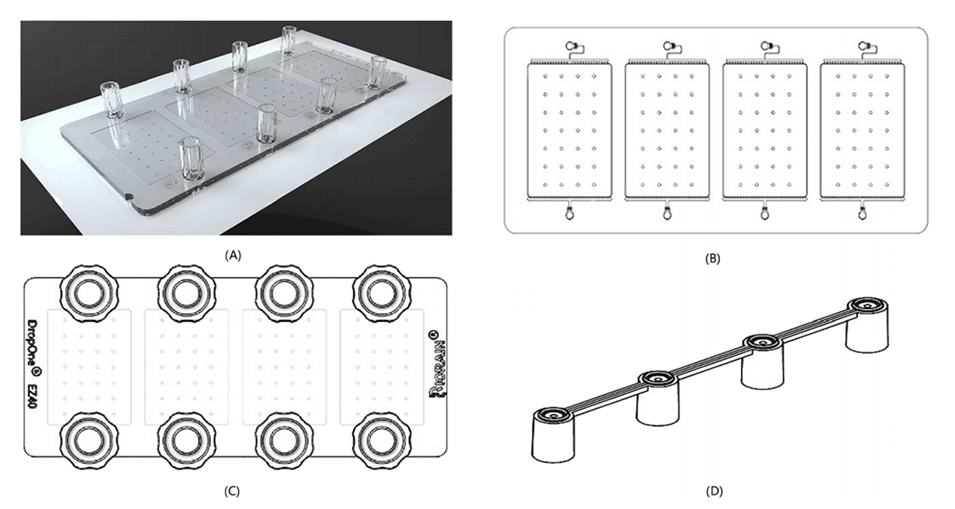
图1.微流控芯片DropOne C4的结构。

图2.DropXpert S6的外部和内部结构有三个主要功能单元。
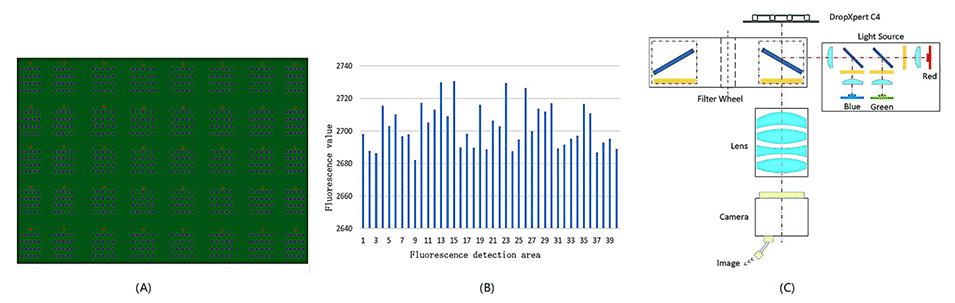
图3.宽视场荧光成像特征。
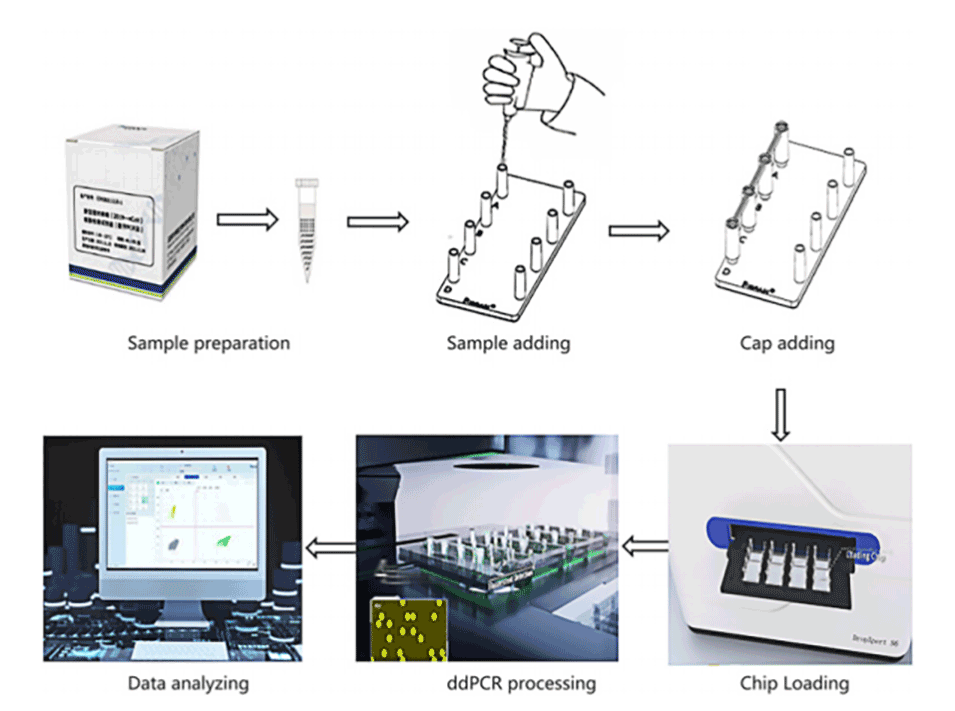
图4.DropXpert S6数字PCR工作流程:样品制备完成后,加入样品并用连接帽密封;然后将C4芯片放入DropXpert S6中,自动依次进行液滴生成、热循环、荧光成像采集和数据分析,最后使用软件进行数据分析。
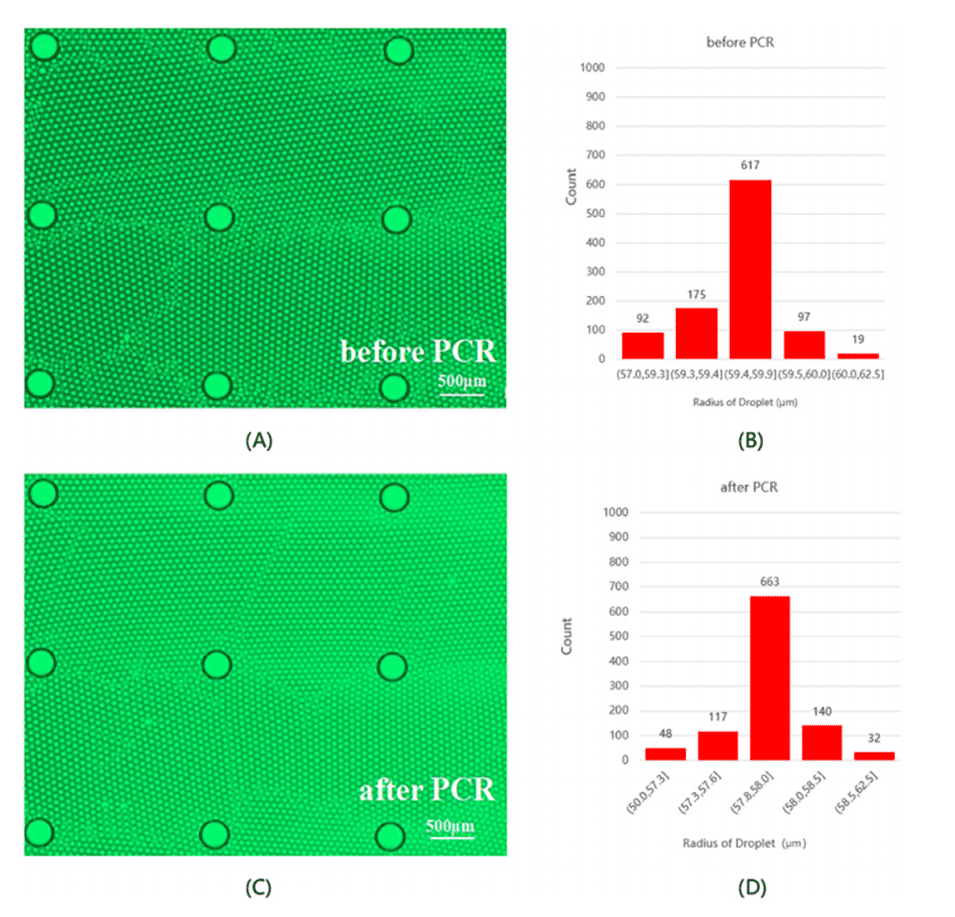
图5.扩增前后液滴状态的示意图。
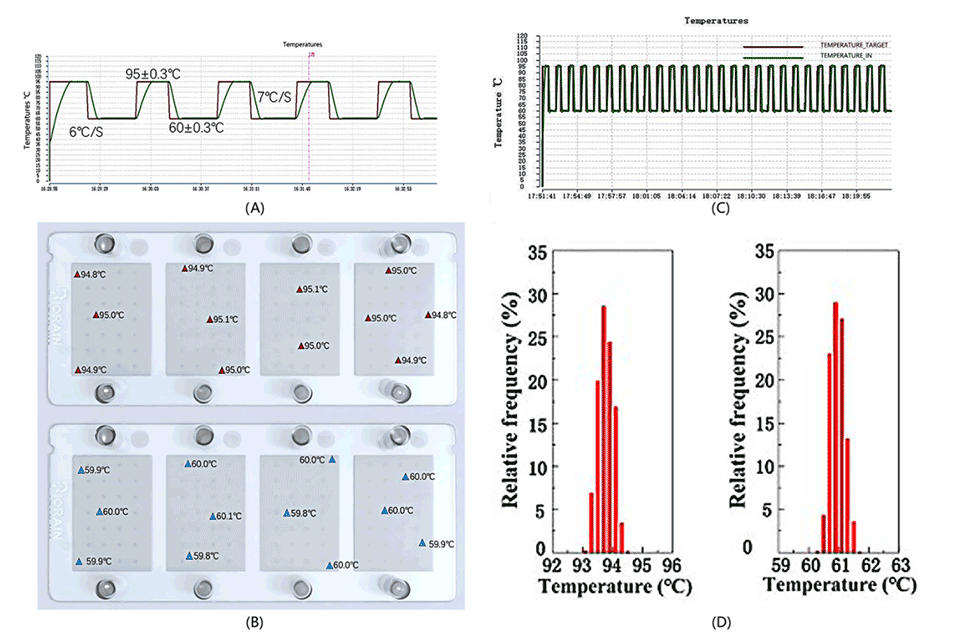
图6.dPCR扩增和温度测量过程中的温度变化。

图7.C4芯片生成液滴的可视化。使用FAM、HEX、ROX和CY5四个采集通道进行PCR后成像。右上角放大了液滴形态,左下角显示了液滴晶体的放大部分。未扩增的液滴颜色较深,观察到扩增的液滴颜色较浅。
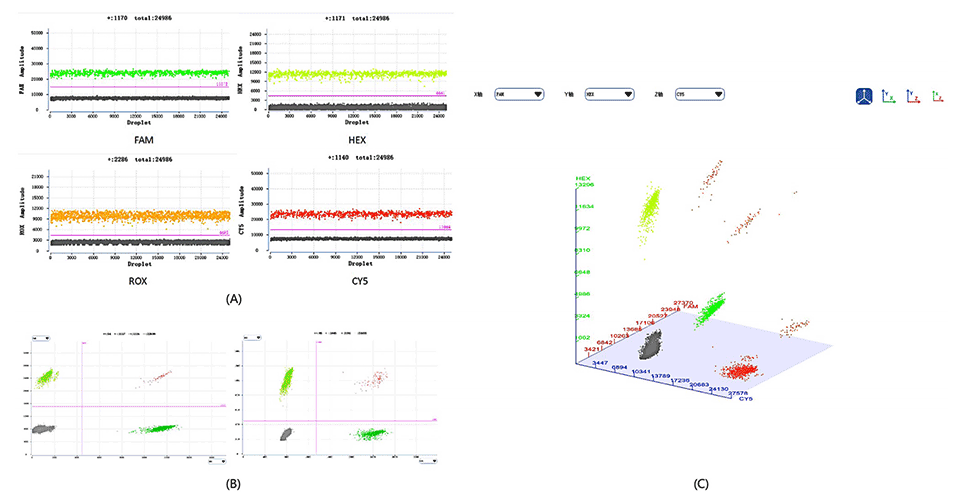
图8.S6软件可以显示1D散点图、2D图和3D图。
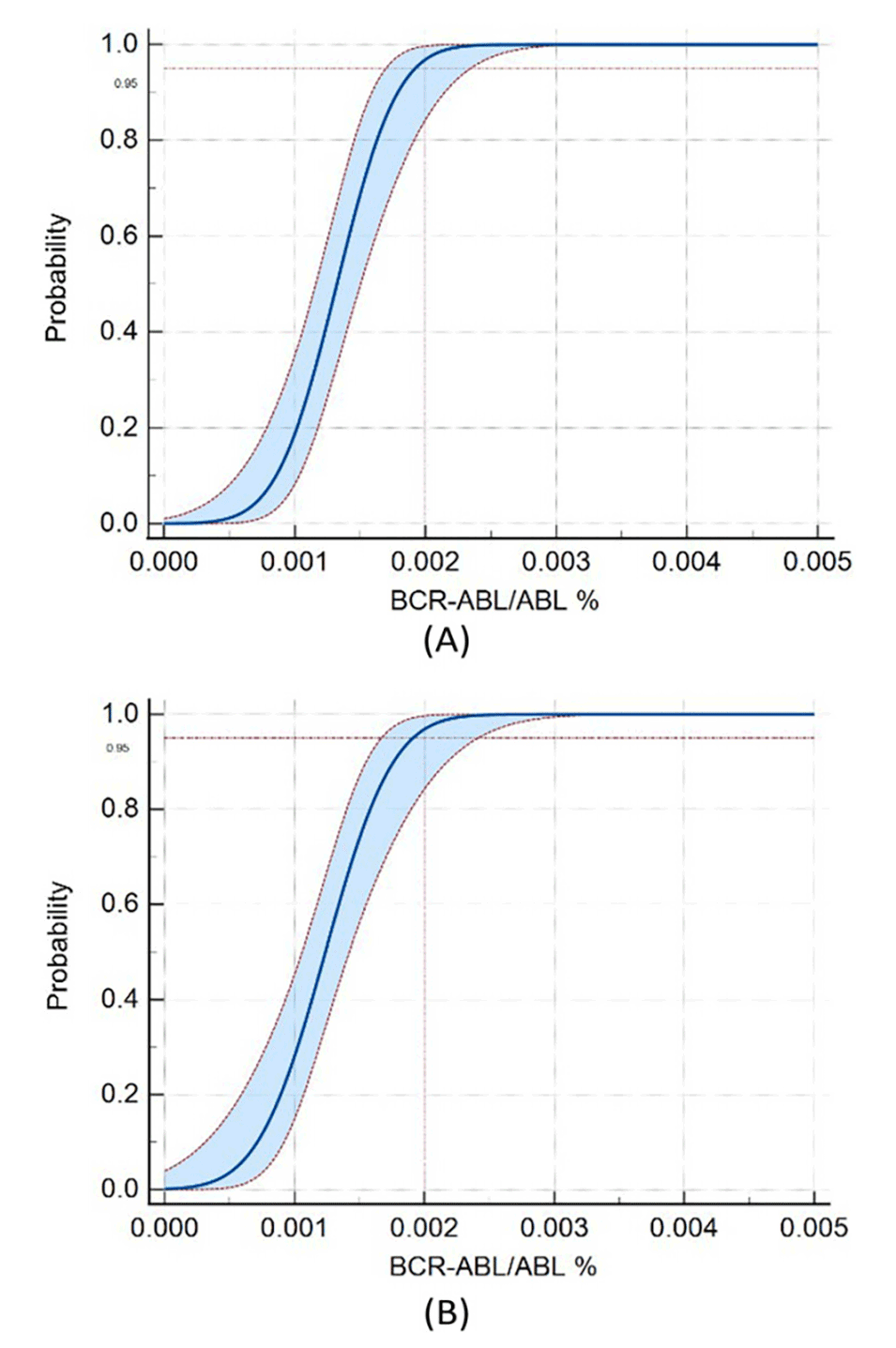
图9.(A)E14A2和ABL质粒的LoD研究。(B)E13A2和ABL质粒的LoD研究。质粒样品E14A2、E13A2和ZL-ABL的数字PCR定量在低浓度配置下进行,每种浓度有32个重复,根据质粒DNA联合研究的结果,该测定的LoD可确定为MR4.7(0.002%)。
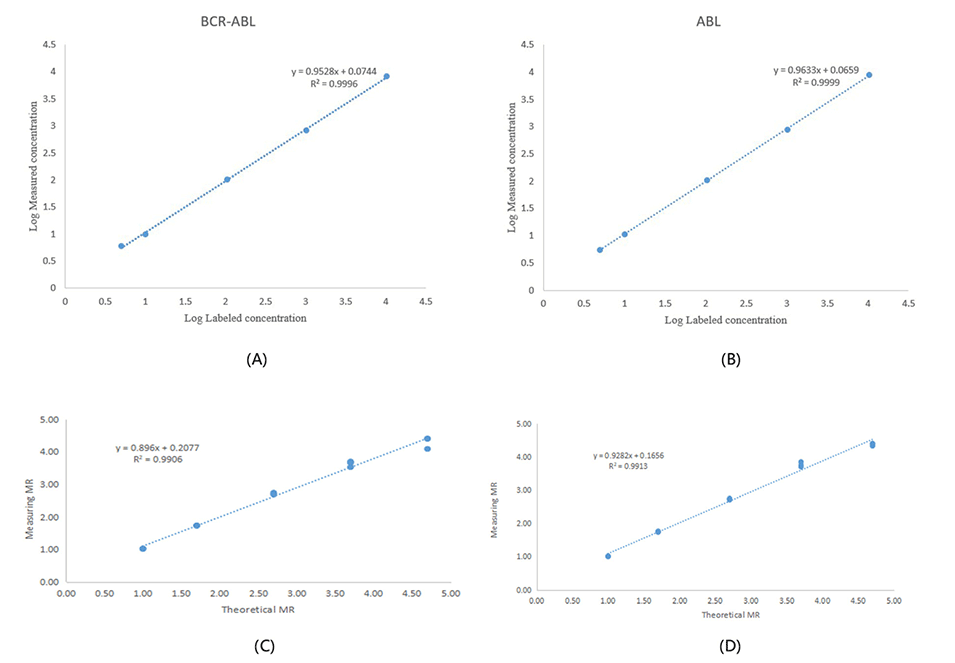
图10.标准物质以及质粒样品E14A2和E13A2的线性研究结果。
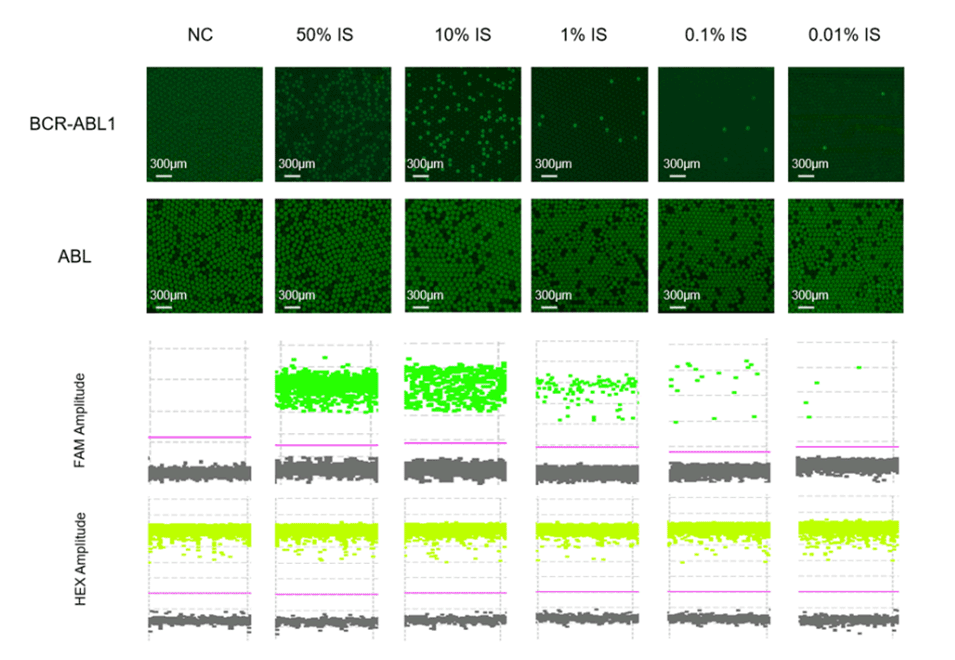
图11.原始液滴图和一维图显示了通过样品梯度稀释进行线性评估的结果。原始液滴图表示荧光通道上BCR-ABL1和ABL靶标的信号。作为内部参照的ABL基因保持稳定的拷贝数,而BCR-ABL1基因在无模板对照(NC)中没有扩增。在50%至0.01%的IS范围内,BCR-ABL1基因表现出极好的线性变异。
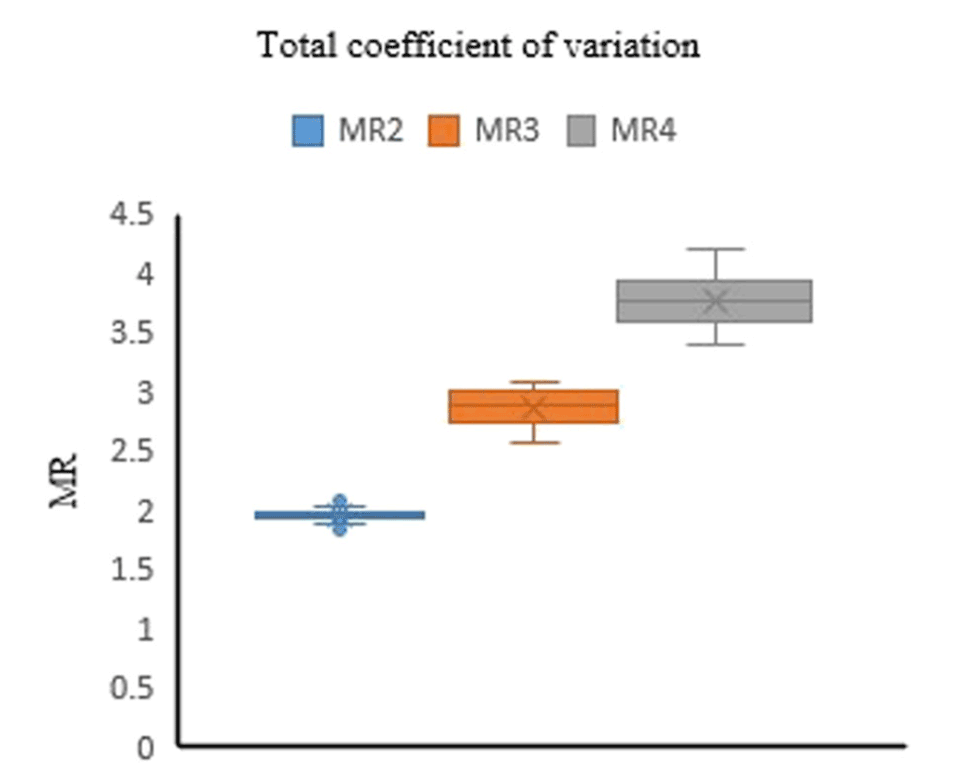
图12.样品MR2、MR3和MR4分别有46、46和47个重复。这些样本的检测平均MR值分别为1.96、2.88和3.79。三个样本的变异系数分别为0.68%、4.47%和4.11%。
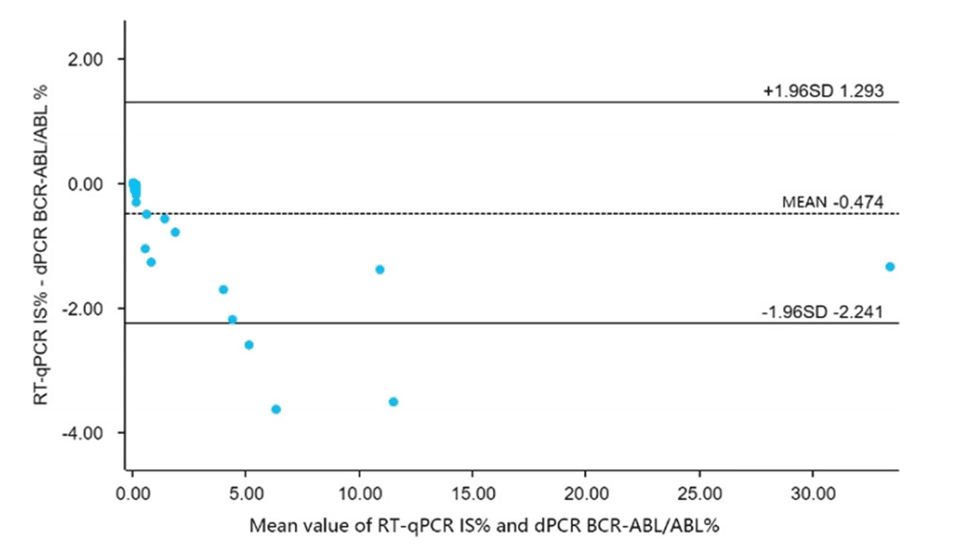
图13.使用qPCR和dPCR测量临床样本中的IS值,并使用Bland-Altman图评估两种技术的一致性。两种方法的平均偏差为-0.474,标准差为0.902,95%置信区间差为-2.241至1.293。
原文链接:https://doi.org/10.1039/D4LC00175C














