慢性疾病和创伤的增加导致对伤口护理的需求不断增长,给全球医疗卫生服务体系带来了巨大压力。人造皮肤为伤口提供机械和微环境支持,这对于伤口愈合和组织再生至关重要。然而,由于现有技术尚未能实现所需性能的有效协同,人造皮肤的临床应用仍然存在挑战。

近期,南京工业大学陈苏教授团队采用微流控同轴静电纺丝技术构建了核壳凝胶纳米纤维人造皮肤材料,由于微流控技术的精确可控及高效传质特性,该方法实现了对核壳凝胶纳米纤维微观结构的精确调控。所制备的核壳凝胶纳米纤维人造皮肤为伤口愈合提供了理想的微环境,大大加快了创面愈合和组织再生。相关研究以“Core‐Shell Gel Nanofiber Scaffolds Constructed by Microfluidic Spinning toward Wound Repair and Tissue Regeneration”为题目,发表在期刊《Advanced Science》上。
本文要点:
1、本研究采用微流控同轴静电纺丝技术,成功构筑了核-壳型羧甲基纤维素钠-铁离子络合物/聚乙烯醇@PCL-姜黄素(CMC-Fe/PVA@PCL-Cur)凝胶-纳米纤维。
2、由于微流控技术的精确可控及高效传质特性,该方法实现了对核壳凝胶纳米纤维微观结构的精确调控。
3、该核壳凝胶纳米纤维人造皮肤材料兼具凝胶和纳米纤维的优势,显示出优异的透气性、高孔隙率、大比表面积以及湿润微环境,同时具有生物相容性、可生物降解性、药物释放能力和抗菌性能。
4、此外,基于羧甲基纤维素钠(CMC-Na)和Fe3+的快速螯合作用,该人造皮肤还表现出优异的力学性能和应变响应性。
5、值得注意的是,这种人造皮肤能够以受控和持续的方式输送药物,从而加速伤口愈合过程。
6、结果表明,本研究不仅展示了一种灵活的方法来制造核壳凝胶纳米纤维支架,还为设计新一代人造皮肤提供了新的思路。
全文总结/概括:
采用微流控纺丝技术(MST)构建人造皮肤的优势如下:
1、微观结构精确控制:MST能够精确控制纤维的直径、孔隙率和表面特性,这对于模拟自然皮肤的微观结构至关重要。
2、多功能集成:通过MST,可以在人造皮肤中集成多种功能,如药物释放、抗菌性能和应变敏感性,从而增强其临床应用的多功能性。
3、生物相容性和生物降解性:MST制造的纳米纤维支架展现出优异的生物相容性,支持细胞的附着和生长。此外,这些支架的设计使其能够根据需要自然降解,为新组织的形成提供空间,从而避免长期异物反应。
4、机械性能优化:MST能够通过调整纤维的组成和结构来优化人造皮肤的机械强度和柔韧性,使其更接近自然皮肤的特性。这对于人造皮肤在动态环境下的适应性和耐用性至关重要。
5、促进细胞交互和组织再生:MST制造的纤维支架提供了类似于细胞外基质的环境,有助于细胞的迁移、增殖和分化,从而促进伤口愈合和组织再生。
凝胶纳米纤维支架(NFSs)在伤口愈合和组织再生中的作用包括:
1、提供湿润微环境:凝胶NFSs的亲水性和透气性为伤口提供了一个湿润的微环境,有助于维持适宜的水分平衡,为细胞的生长和迁移创造有利条件。
2、促进胶原蛋白生成:通过Masson染色评估,凝胶NFSs能够促进胶原蛋白纤维的生成和有序排列,这对于新组织的形成和伤口愈合至关重要。
3、增强新血管形成:凝胶NFSs通过提高CD31的表达,促进新血管的形成,从而为伤口愈合提供所需的氧气和营养物质。
4、抗菌性能和药物释放能力:凝胶NFSs不仅展示出优异的抗菌特性,有助于减少伤口感染,还具备以受控和持续的方式释放药物(如姜黄素)的能力。这种双重功能有助于减轻炎症反应,促进伤口愈合,同时减少感染风险。
5、生物相容性和生物降解性:凝胶NFSs展现出良好的生物相容性,支持细胞的附着和生长。同时,其生物降解性确保了随着时间的推移,支架能够自然降解,为新组织的形成提供空间,减少对愈合过程的干扰。
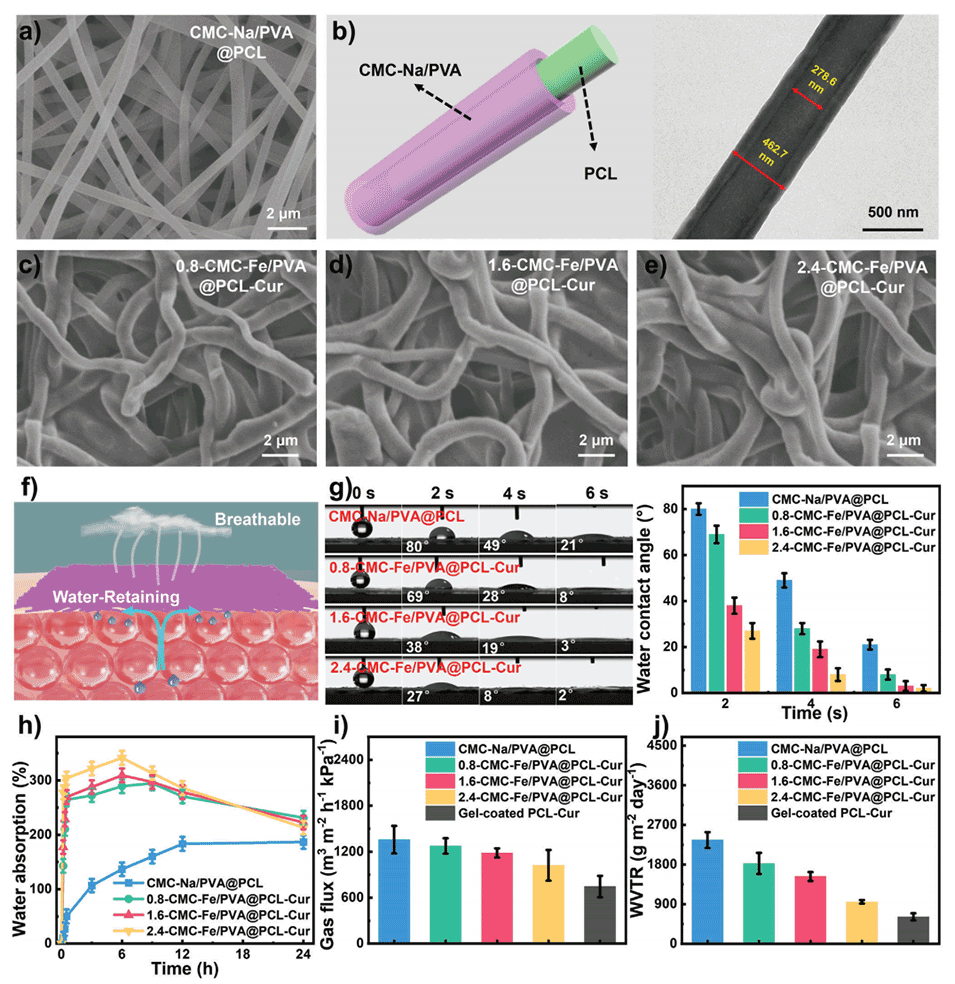
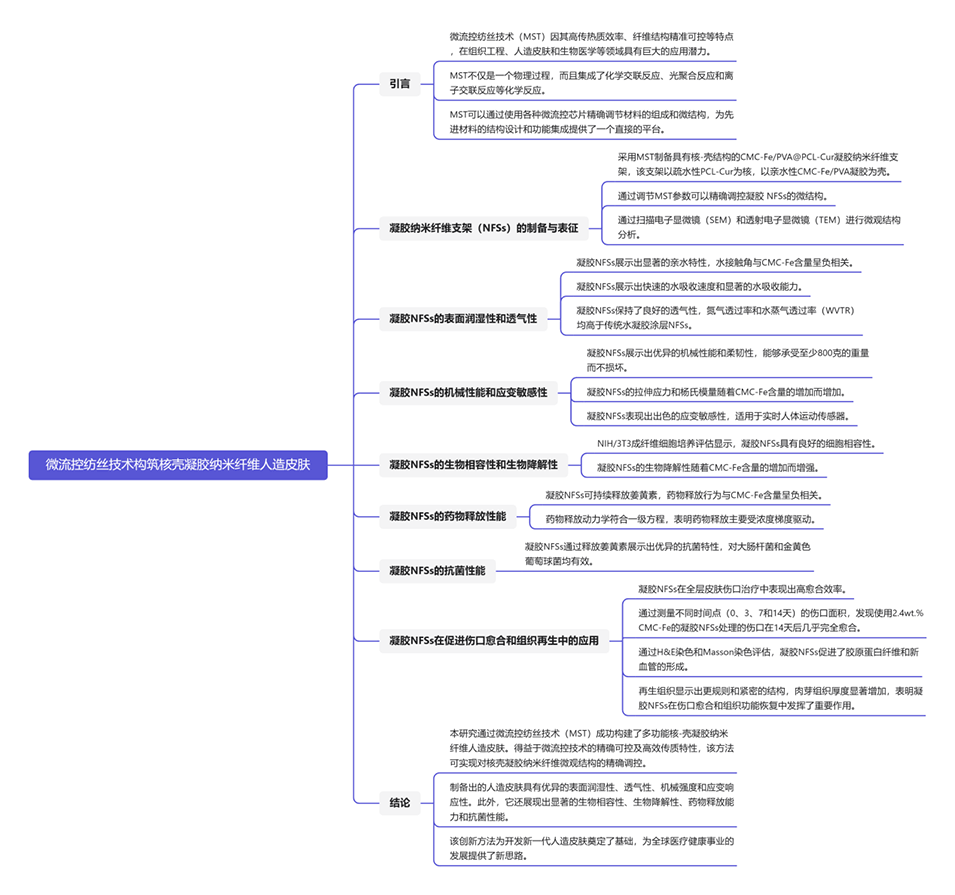
图1.a)CMC-Na/PVA@PCL纳米纤维的SEM图像。b)核壳CMC-Na/PVA@PCL纳米纤维的示意图和TEM图像。c–e)凝胶NFSs的SEM图像。f)凝胶NFSs表面润湿性和透气性的示意图。g)CMC-Na/PVA@PCL纳米纤维和凝胶NFSs的水接触角和h)吸水率随时间的变化。i)CMC-Na/PVA@PCL纳米纤维、凝胶NFSs和凝胶涂覆PCL-Cur纳米纤维的氮气渗透性和j)WVTR。
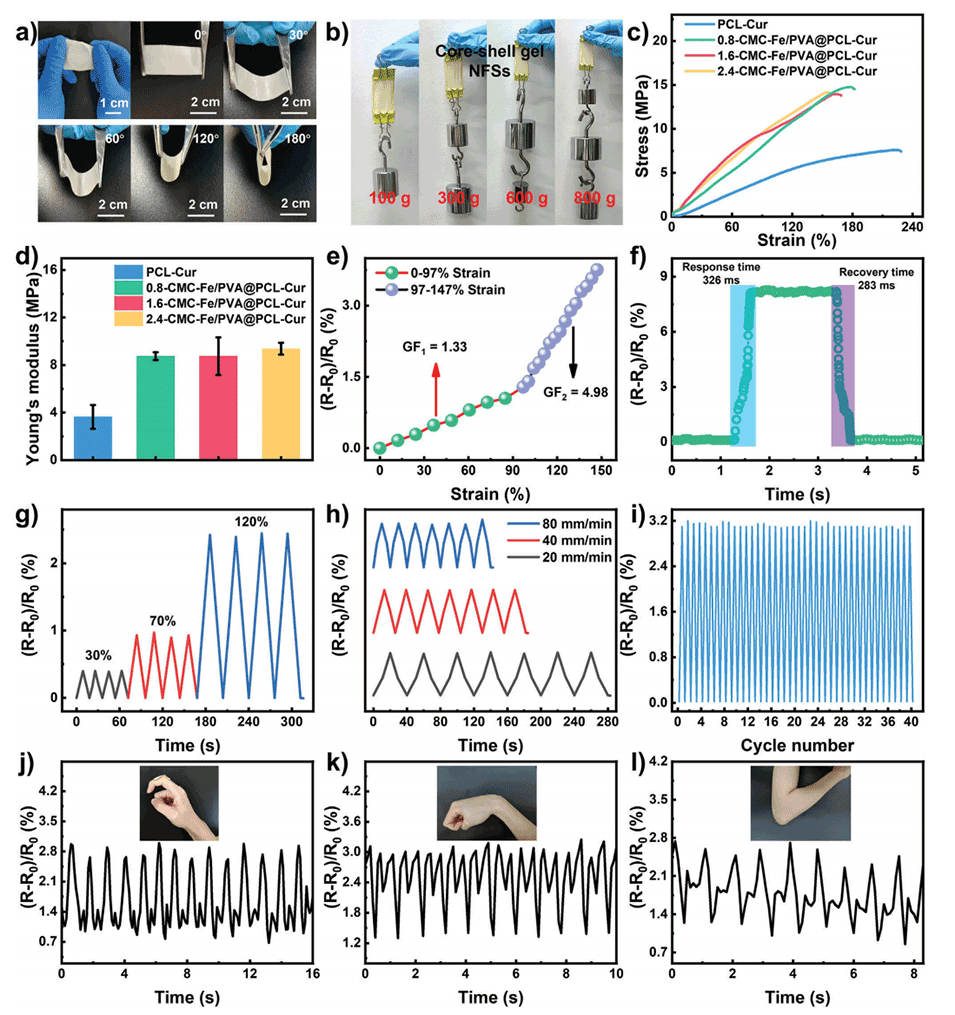
图2.a)凝胶NFSs在不同角度弯曲的光学图像。b)凝胶NFSs承受高达800克重量而不断裂的光学图像。纯PCL-Cur纳米纤维和凝胶NFSs的c)应力-应变曲线和d)杨氏模量。e)凝胶NFSs传感器的相对电阻随外加应变的变化。f)凝胶NFSs传感器的响应时间和恢复时间。不同g)应变和h)拉伸速度下凝胶NFSs传感器的相对电阻变化。i)凝胶NFSs传感器在40次循环弯曲过程中的相对电阻变化。凝胶NFSs传感器在j)手指弯曲、k)手腕弯曲、l)手臂弯曲时的相对电阻变化。
图3.a)培养24小时和48小时后,在CMC-Na/PVA@PCL纳米纤维和凝胶NFSs中增殖的NIH/3T3细胞的荧光显微照片。b)24和48小时后不同样品的细胞活力分布。c)药物释放过程的机制说明。d)CMC-Na/PVA@PCL纳米纤维和凝胶NFSs对大肠杆菌和金黄色葡萄球菌的抑制作用。与不同样品一起孵育后e)大肠杆菌和f)金黄色葡萄球菌菌落的数量。与不同样品一起孵育的g)大肠杆菌和h)金黄色葡萄球菌悬浮液的OD600值随时间的变化。数据显示为平均值±标准差。柱状图表示标准误差,n=3。*p<0.05,**p<0.01,***p<0.001。
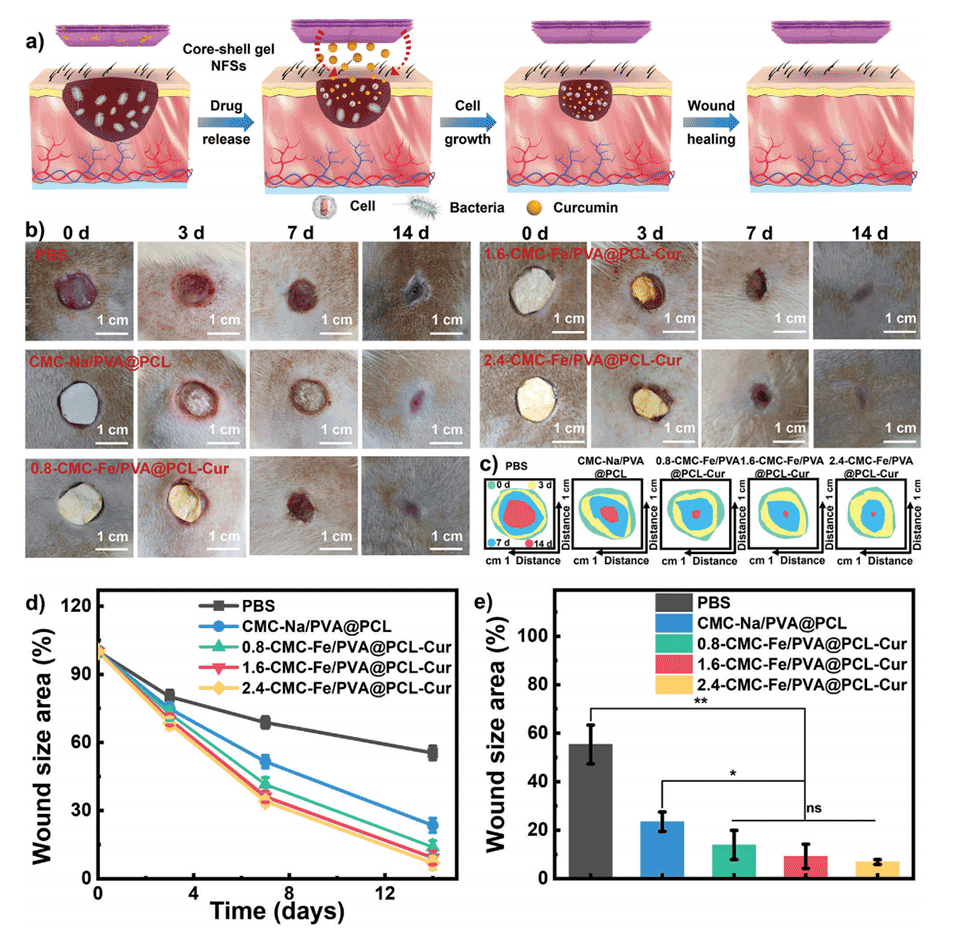
图4.a)伤口愈合过程机理图。b)PBS、CMC-Na/PVA@PCL纳米纤维和凝胶NFSs处理伤口的光学照片。c)0、3、7、14天模拟伤口的收缩情况。d)不同样品处理后伤口面积随时间的变化。e)不同样品处理14天后的伤口愈合面积。数据显示为平均值±标准差。柱状图表示标准误差,n=3。*p<0.05,**p<0.01。
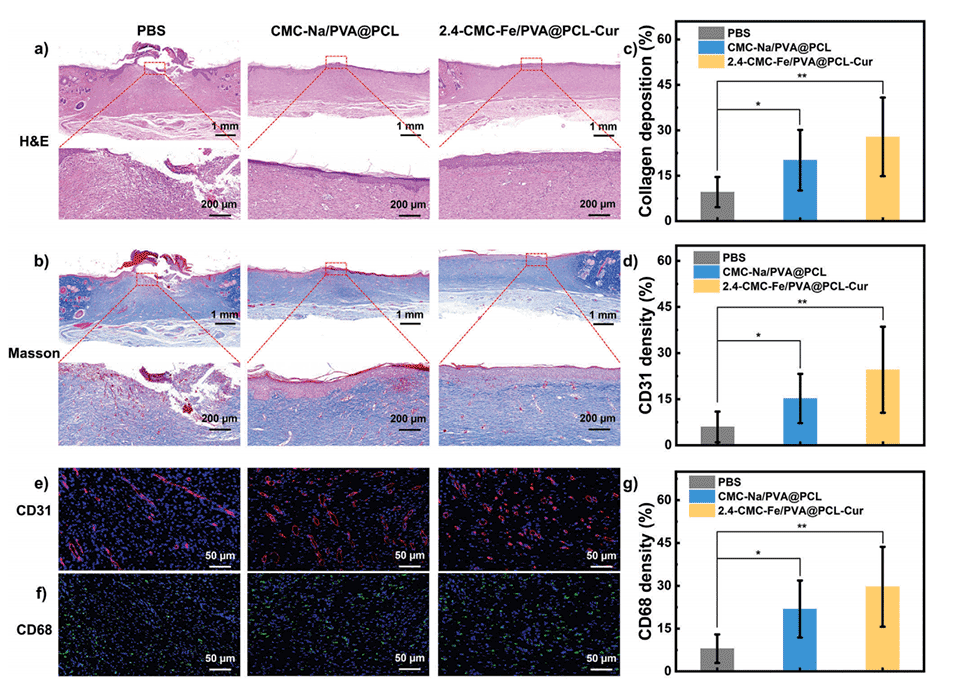
图5.a)用PBS、CMC-Na/PVA@PCL纳米纤维和凝胶NFSs处理后再生组织的H&E染色和b)Masson染色图像。c)胶原蛋白沉积的定量统计。d)CD31密度的定量统计。e)用PBS、CMC-Na/PVA@PCL纳米纤维和凝胶NFSs处理后再生组织的CD31染色和f)CD68染色图像。g)CD31密度的定量统计。数据显示为平均值±标准差。柱状图表示标准误差,n=3*。p<0.05,**p<0.01。
原文链接:https://doi.org/10.1002/advs.202404433














