在药物筛选领域,表型药物发现(PDD)是一种重要的药物开发策略,它侧重于直接利用生物系统的表型变化来识别潜在的药物分子。然而,PDD的过程复杂且耗时,需要对大量化合物进行筛选和分析。近年来,人工智能(AI)技术的快速发展为这一领域带来了新的机遇。AI的预测能力、数据分析和高效处理数据的优势,为提高PDD的效率和准确性提供了可能。

近期,中国医学科学院北京协和医院潘慧教授团队在国际知名期刊《ACS Applied Materials & Interfaces》上发表综述文章“AI-Powered Microfluidics: Shaping the Future of Phenotypic Drug Discovery”,深入探讨了AI与微流控技术结合在PDD中的应用进展和所面临的挑战。文章指出,通过将先进的微流控平台与AI算法相结合,研究人员能够快速筛选大型化合物库,识别新的候选药物,并以前所未有的速度和效率阐明复杂的生物途径。
本综述还讨论了微流控系统和不同用途的人工智能驱动分析的协同组合,并展望了AI驱动微流控技术在未来药物发现中的潜力。潘慧教授的这项研究不仅为PDD领域提供了新的视角,也为AI技术在生物医学研究中的应用开辟了新的道路。
本文要点:
1、本文概述了基于AI的微流控技术及其在药物发现中应用的最新进展与挑战。
2、讨论了用于高通量筛选的微流控系统和用于表型表征、药物-靶标相互作用和预测建模的人工智能驱动分析的协同组合。
3、强调了人工智能驱动的微流控技术在实现自动化药物筛选系统方面的潜力。
4、AI驱动的微流控技术为未来PDD提供了一种有前景的方法,能够快速、经济、准确地识别具有治疗相关性的化合物。
一张图读懂全文:
在表型药物发现(PDD)中使用微流控技术的优势包括:
1、精确的微环境控制:微流控技术能够精细调控细胞生长的微环境,实现更精准的体内条件模拟。
2、高通量筛选能力:该技术平台能够快速筛选大型化合物库,促进有效药物候选物的鉴定。
3、实时细胞反应监测:微流控平台支持对细胞反应的即时分析,便于迅速评估药物的效果。
4、药物浓度梯度的生成:能够在实验中创建药物浓度梯度,增强对细胞在不同剂量下变化的评估精度。
5、多药物组合的同时测试:能够在单一实验中测试多种药物组合,便于研究药物的协同效应。
6、减少样本需求量:微流控设备所需的样本量较小,适合于珍贵或有限的生物样本研究。
7、多分析集成:能在一个平台上集成多种分析方法,提供更全面的数据支持,改善药物发现流程。
8、探究细胞间复杂相互作用:微流控技术支持不同细胞类型的共培养,为深入研究药物反应相关的细胞间复杂相互作用提供了实验条件。
在药物发现中,AI与微流控技术的集成面临以下挑战:
1、数据标注与训练:大多数AI算法依赖于监督学习,这需要大量人工进行数据标注。这个过程耗时且劳动密集,尤其是在高通量微流控平台生成大量数据的情况下。
2、AI模型的可解释性:AI算法常被视为“黑箱”系统,难以理解其决策过程。缺乏可解释性可能会影响人们对AI驱动微流控系统的信任,特别是在医疗应用中,质量保证至关重要。
3、适当数据类型的选择:确定哪些数据类型最适合用于训练AI模型极为重要。并非所有影响药物筛选的因素都具有相同的重要性,因此需要根据因果影响优先考虑某些因素,以提高准确性。
4、过拟合风险:在数据不足的情况下,AI模型可能会出现过拟合,即在训练数据上表现良好,但在未见数据上表现不佳。需要定制算法和预训练策略来减轻这一风险。
5、标准化问题:微流控平台上传感器、成像设备和执行器之间缺乏标准化的数据格式和通信协议,可能导致数据解释延迟,并妨碍药物评估过程中的实时调整。
6、监管与伦理考虑:AI在药物发现中的集成引发了监管和伦理问题,特别是关于数据隐私、知情同意以及AI驱动决策在临床环境中的影响。
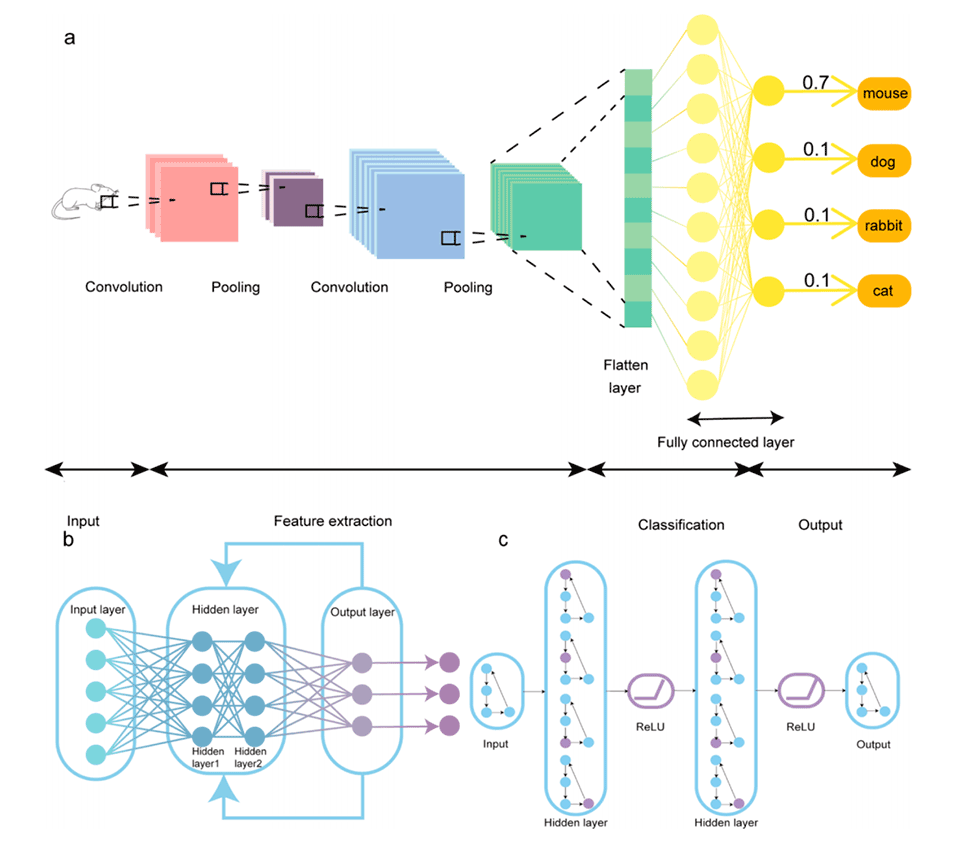
图1.微流控平台在表型药物筛选中的应用。

图2.一些典型的机器学习模型。(a)卷积神经网络(CNN)结构。(b)递归神经网络(RNN)结构。(c)图神经网络(GNN)结构。
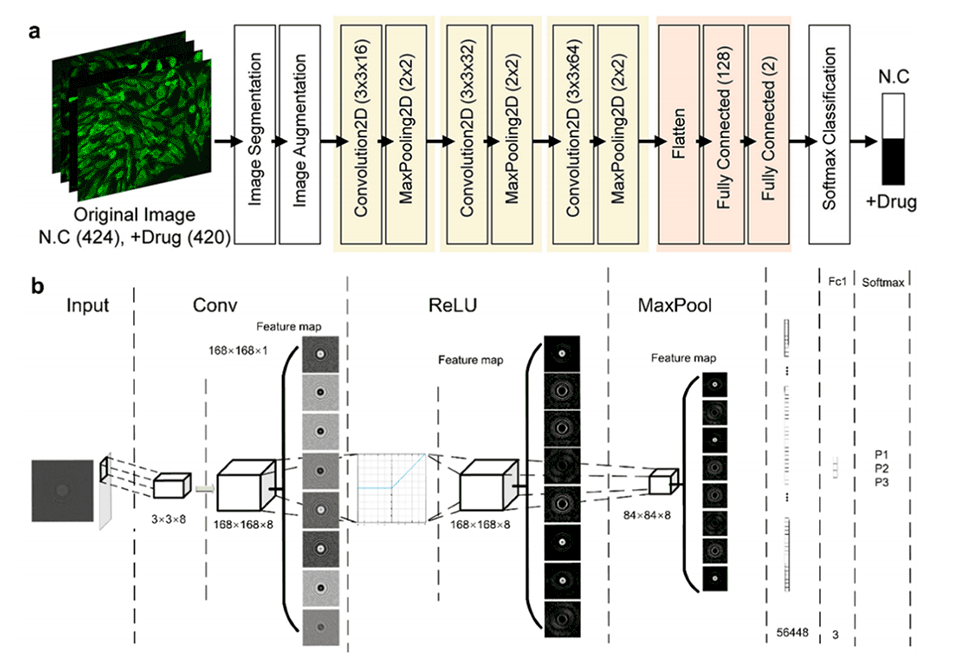
图3.人工智能驱动的图像分析与处理(1)。
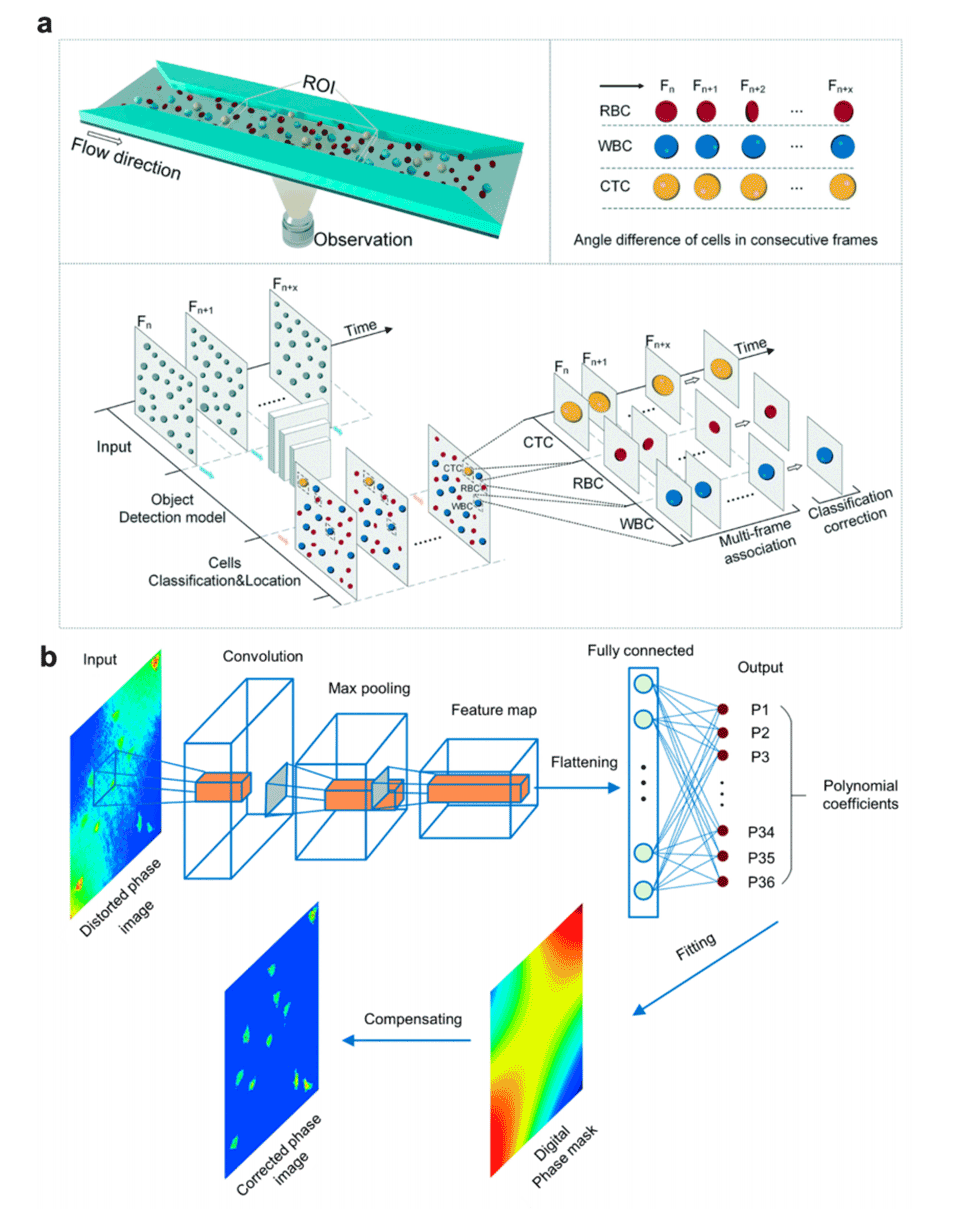
图4.人工智能驱动的图像分析与处理(2)。
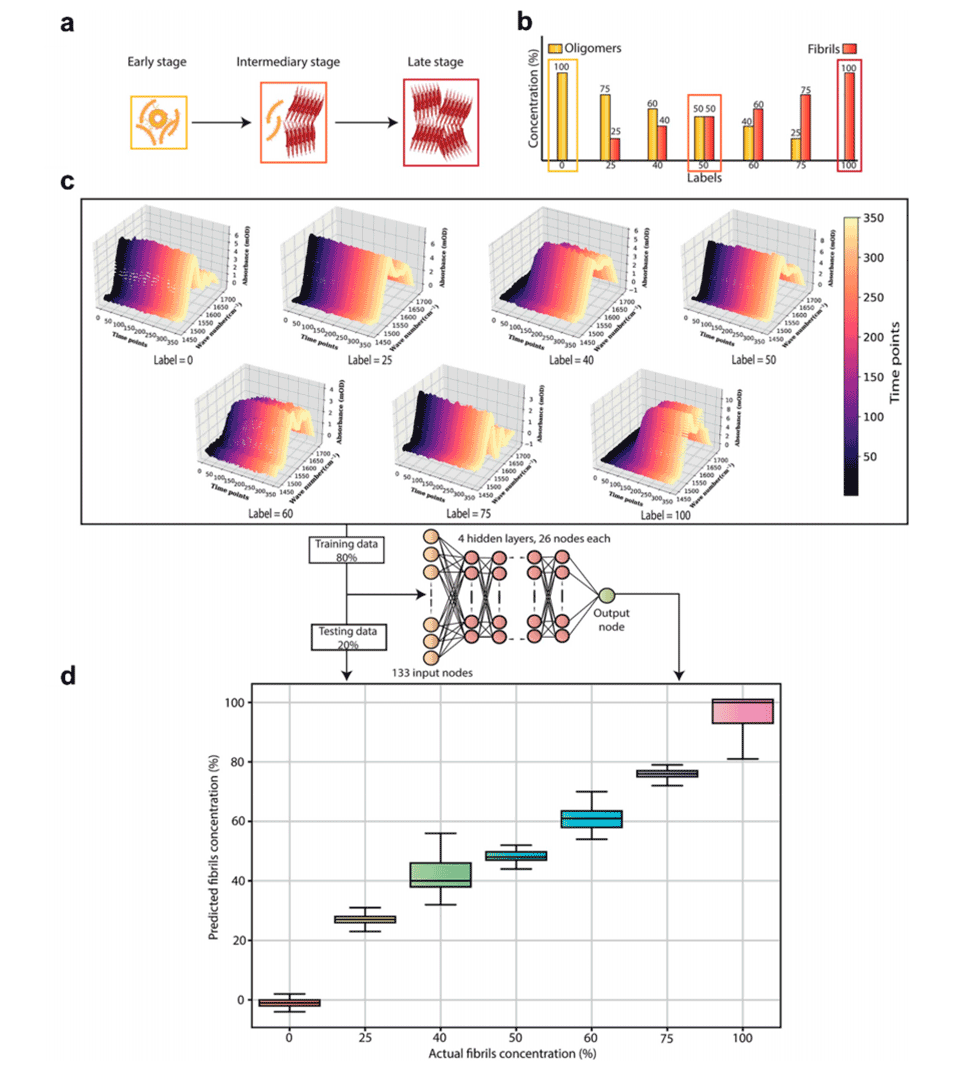
图5.人工智能增强的表型药物筛选和预测建模(1)。
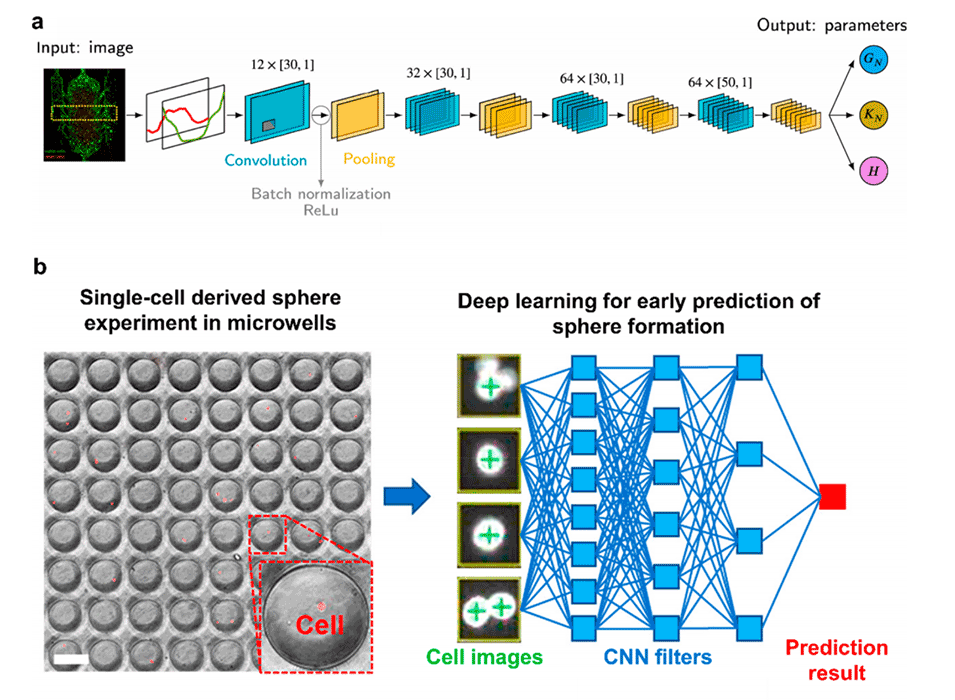
图6.人工智能增强的表型药物筛选和预测建模(2)。
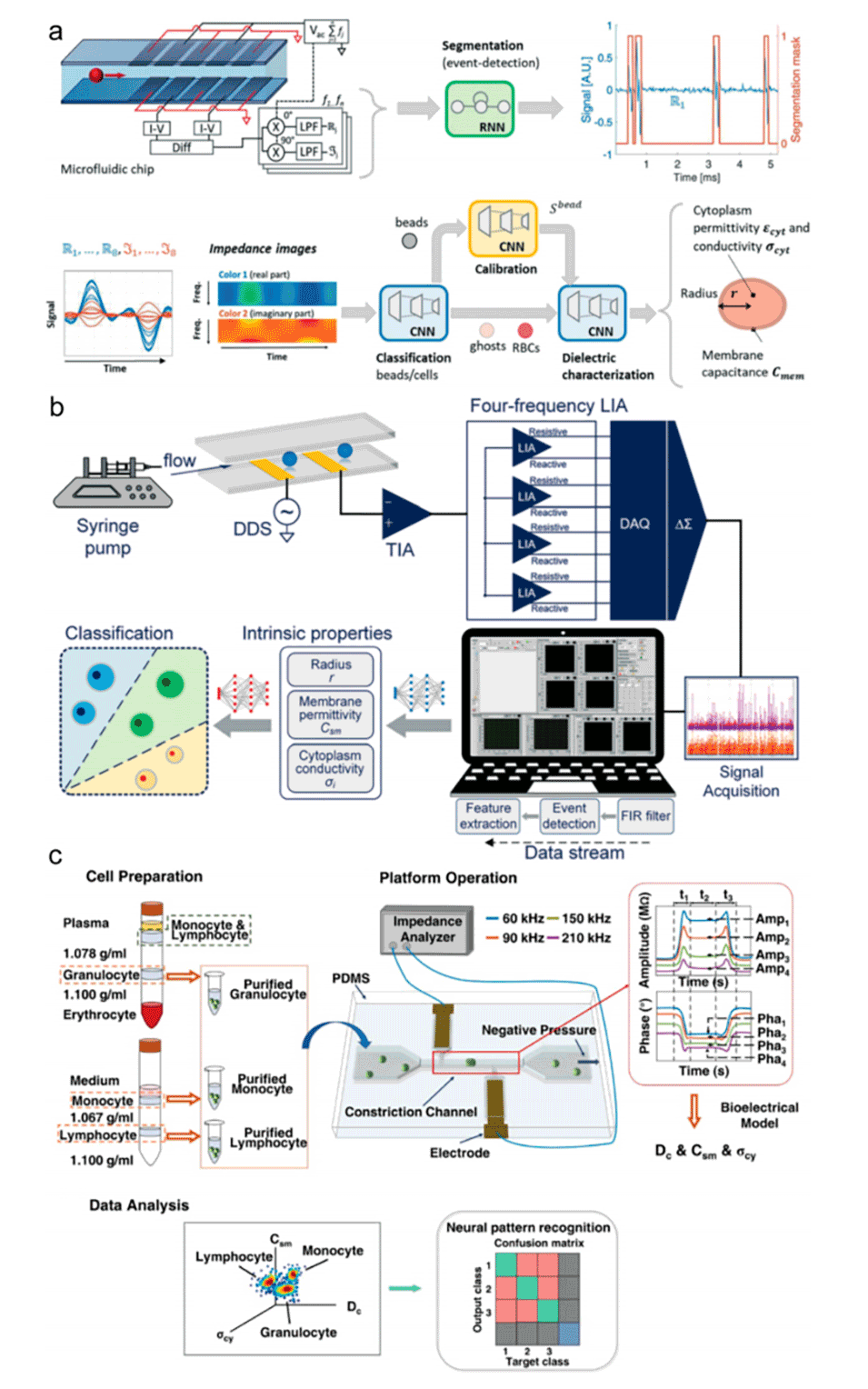
图7.人工智能在微流控阻抗细胞仪中的应用。
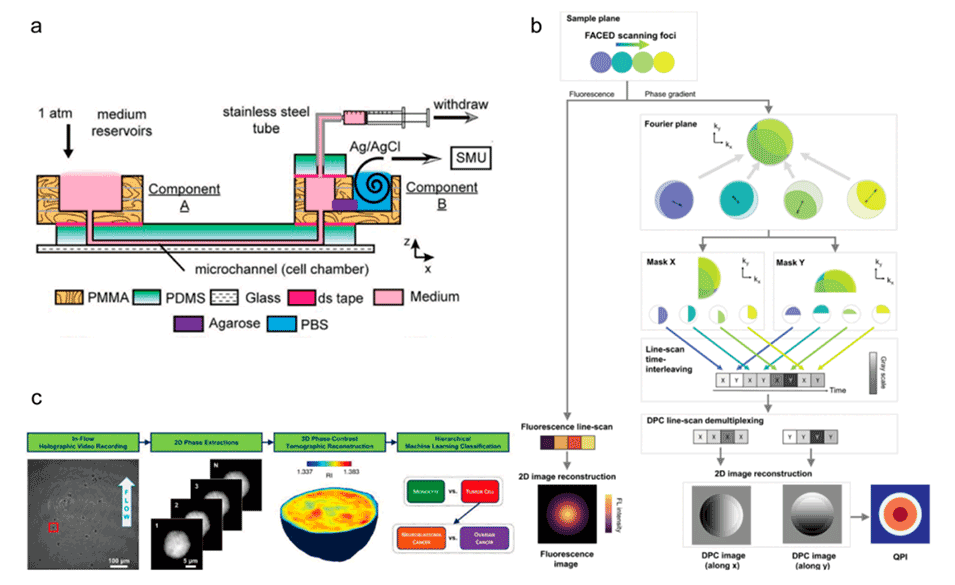
图8.单细胞水平的细胞行为和形态分析。
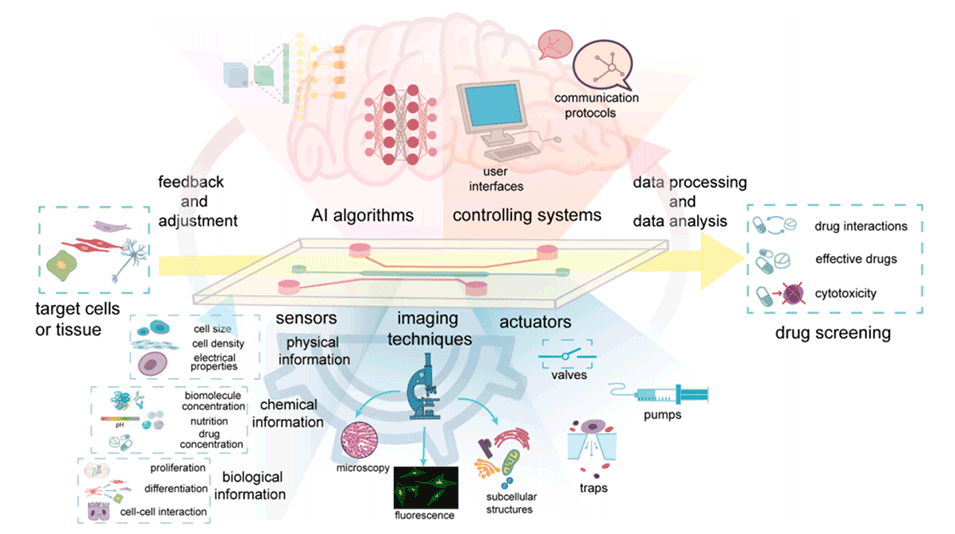
图9.将人工智能与微流控技术相结合用于表型药物筛选的图示。
原文链接:https://doi.org/10.1021/acsami.4c07665














