肿瘤类器官是由特定器官干细胞衍生的三维细胞培养模型,能够准确反映患者个体差异。尽管已有研究展示了肿瘤类器官技术在揭示肿瘤异质性方面的潜力,但现有技术在分析通量和分辨率上仍存在局限。因此,亟需开发高通量的单细胞培养工具,以便全面展示肿瘤内部的异质性。微流控技术为单细胞培养提供了有效的解决方案,能够精确控制细胞环境并实现大规模的单细胞衍生肿瘤类器官(STO)检测,从而推动个性化治疗和药物筛选的研究。

近期,广州市第一人民医院刘大渔研究员团队与暨南大学王丽辉教授团队合作,开发了一种新型微流控芯片,该芯片包含30,000个微孔,能够高通量地培养单细胞衍生的结肠癌类器官(STO)。这一技术的应用有效促进了肿瘤异质性的分析,并为个性化治疗和药物筛选提供了新的途径。研究成果以“Forming Single-Cell-Derived Colon Cancer Organoid Arrays on a Microfluidic Chip for High Throughput Tumor Heterogeneity Analysis”为题,发表在国际知名期刊《ACS Biomaterials Science & Engineering》上。
本文要点:
1、本研究开发了一种基于微流控芯片的单细胞培养方法,用于构建大规模的单细胞衍生肿瘤类器官(STO)阵列。
2、通过在微孔表面修饰疏水性聚合物,并在培养基中添加PEG,建立了一个有利于肿瘤干细胞选择性扩增的非粘附培养环境。
3、该方法可获得约20%的STO形成率,并产生超过800个STOs,为高通量肿瘤异质性分析提供了有效平台。
4、对STOs进行综合分析发现,其具有显著的个体间异质性,较小的STOs表现出更强的侵袭性和耐药性,这可能与它们具有更高的干细胞特性有关。
5、总体而言,所开发的微流控方法有效促进了STO的形成,并为研究肿瘤异质性以及进行以个性化治疗为重点的药物筛选提供了广阔的前景。
在癌症研究中使用单细胞衍生的肿瘤类器官(STOs)的优势包括:
1、遗传背景的一致性:STOs来源于单个肿瘤干细胞,保证了遗传背景的一致性,有助于更准确地研究肿瘤细胞的遗传和表型特征。
2、肿瘤异质性的体现:STOs能够展示肿瘤内部的异质性,因为它们能够反映出单个肿瘤干细胞的多样性,包括不同的基因表达和药物反应。
3、高通量筛选能力:利用微流控芯片技术,可以同时培养和分析大量STOs,提高了研究的效率和通量。
4、个性化医疗的潜在应用:STOs可以用于评估个体对不同治疗方案的反应,有助于开发个性化的癌症治疗策略。
5、伦理争议的避免:与使用动物或人类样本相比,STOs的使用避免了伦理问题。
6、模拟肿瘤微环境:STOs能够在体外模拟肿瘤的三维结构和微环境,为研究肿瘤生长和转移提供了更真实的模型。
7、药物反应评估:STOs可用于评估不同药物对肿瘤细胞的影响,包括药物敏感性和耐药性的研究。
8、肿瘤干细胞特性的研究:STOs的形成和扩增有助于深入理解肿瘤干细胞的特性,包括自我更新和多向分化能力。
在微流控芯片上培养的单细胞衍生肿瘤类器官(STOs)虽然为模拟肿瘤微环境提供了一个强大的体外模型,但仍存在一些局限性:
1、缺乏完整的肿瘤微环境:STOs可能无法完全复制肿瘤内部的细胞外基质、免疫细胞、成纤维细胞和其他细胞类型,这些都是影响肿瘤行为的关键因素。
2、血管系统的缺失:微流控芯片上的STOs不包含血管系统,而血管在肿瘤生长、转移和对治疗的响应中起着至关重要的作用。
3、动态变化的缺失:肿瘤在体内是动态发展的,包括肿瘤细胞的增殖、迁移和分化。STOs可能无法完全模拟这种动态过程。
4、空间异质性的局限:STOs可能无法完全再现肿瘤内部的空间异质性,包括不同区域的氧气浓度、pH值和代谢物分布等。
5、长期培养的挑战:在微流控芯片上长期培养STOs可能会遇到技术挑战,如维持细胞活性和功能状态的稳定性。
6、药物筛选的局限性:虽然STOs可用于药物筛选,但它们可能无法完全预测药物在体内的真实效果,特别是在复杂的生理条件下。
7、个体差异的模拟:尽管STOs来源于患者特定的肿瘤细胞,但它们可能无法涵盖所有患者的肿瘤异质性,限制了模型的普适性。
为了克服这些局限性,研究人员需要进一步改进微流控芯片的设计,整合更多的生物学因素,以及开发新的技术来更全面地模拟肿瘤微环境。
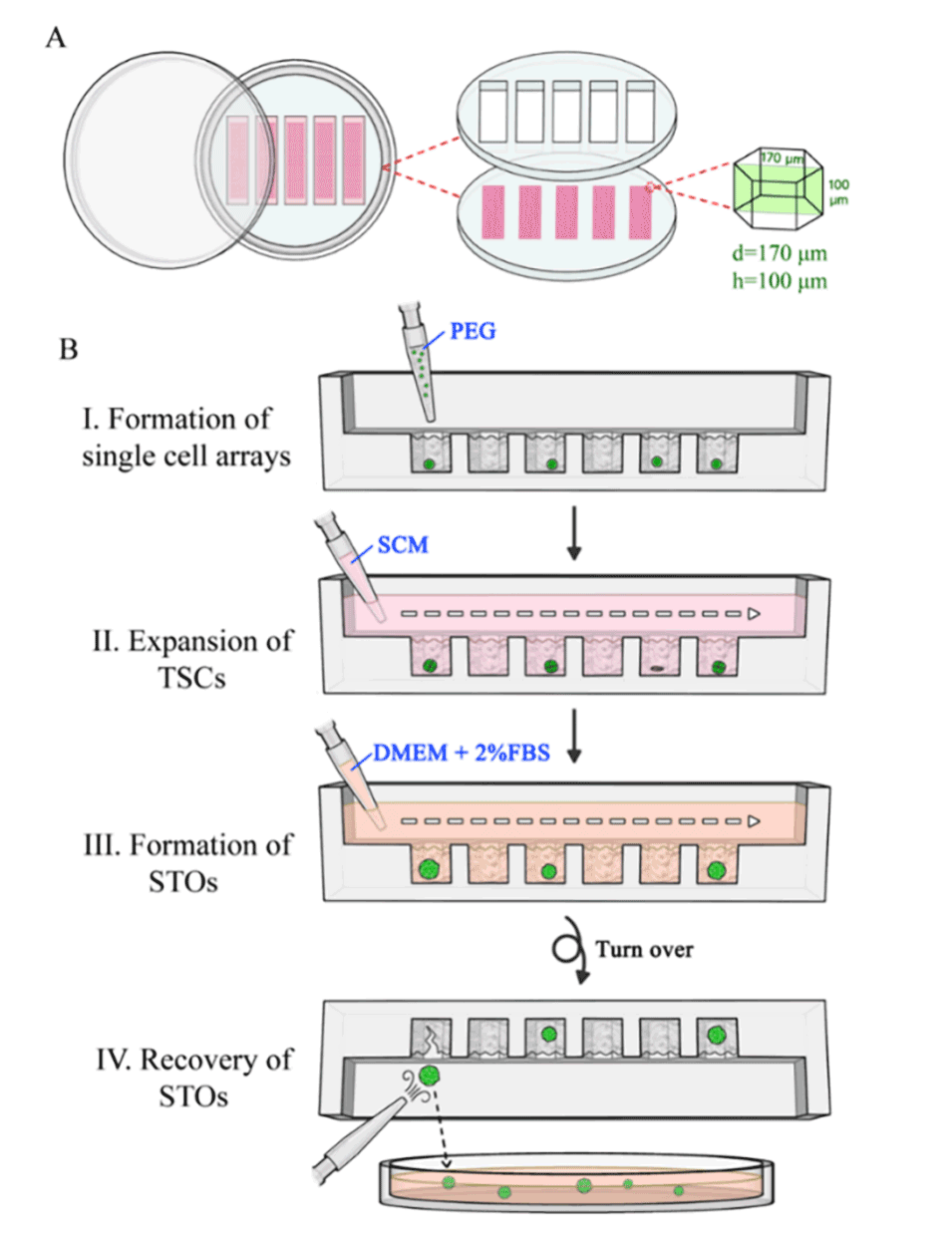
图1.(A)微流控芯片结构示意图。(B)微流控芯片操作程序。
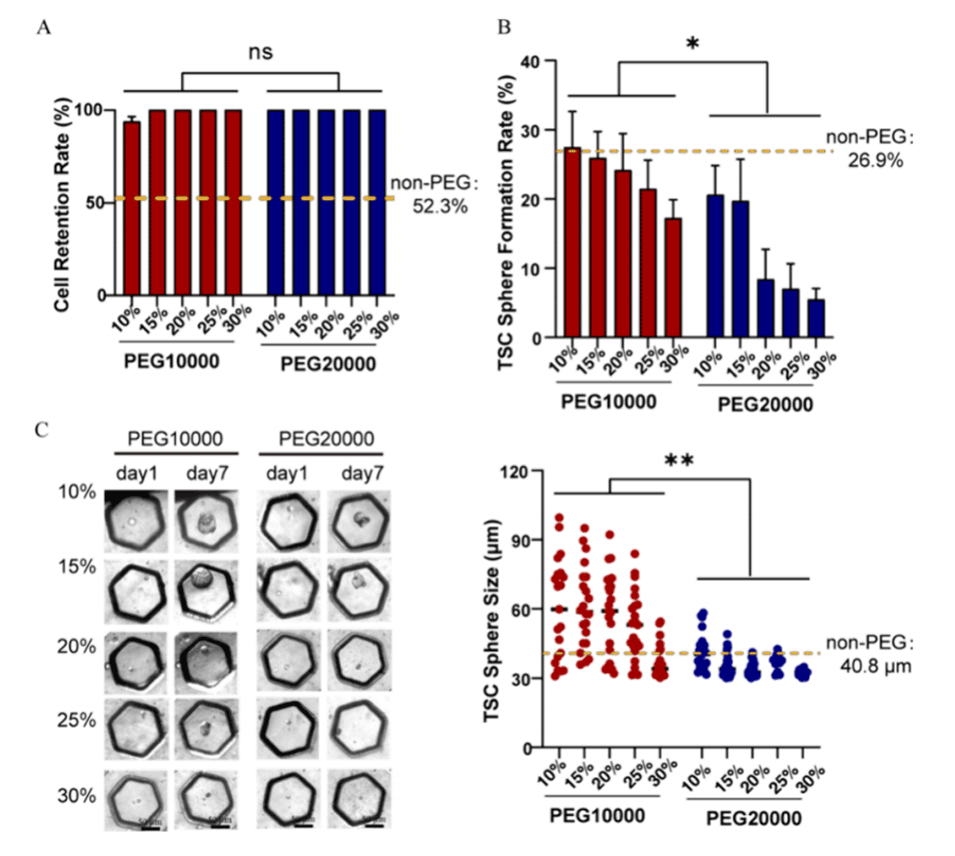
图2.在不同浓度的PEG存在下,连续单细胞培养中的细胞保留和TSC球体形成。
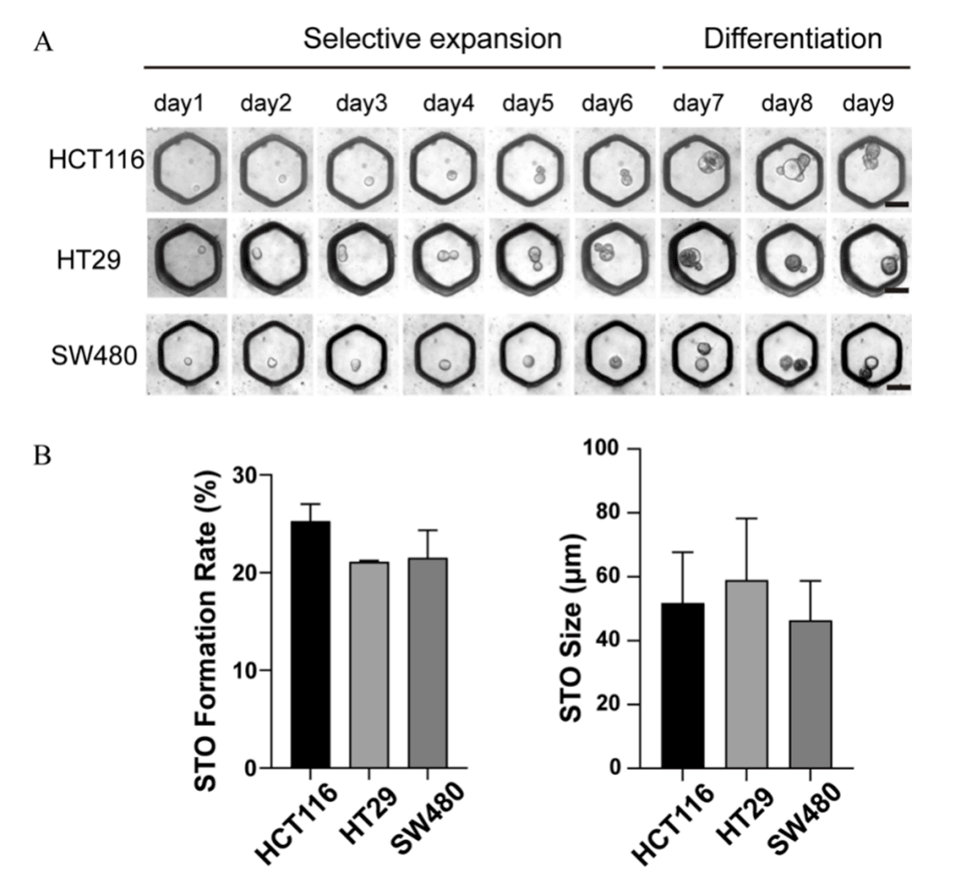
图3.(A)经过6天的单细胞培养后,TSC球体形成,随后经过3天的差异诱导,发育成STO。比例尺:50μm。(B)来源于各种类型的结肠癌癌细胞的STO的形成速率和大小。
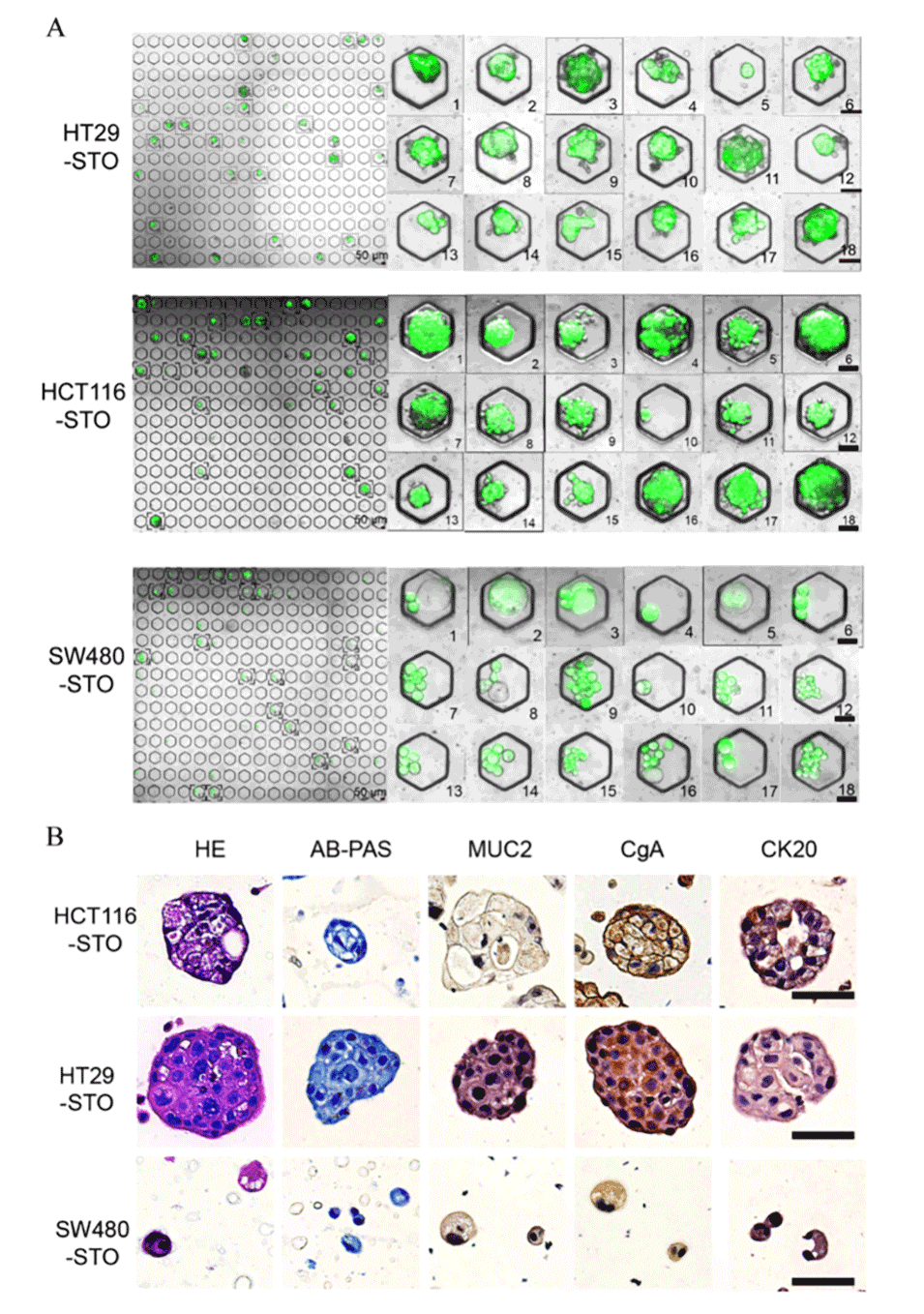
图4.(A)钙黄绿素AM/PI染色显示所得STO的活力。比例尺:50μm。(B)HE染色显示各种STO内的腺体结构。AB-PAS染色显示STO内的中性粘蛋白(红色/紫色)和酸性粘蛋白(蓝色)。免疫组织化学染色显示STO内细胞中MUC2、CgA和CK20的表达。比例尺:50μm。
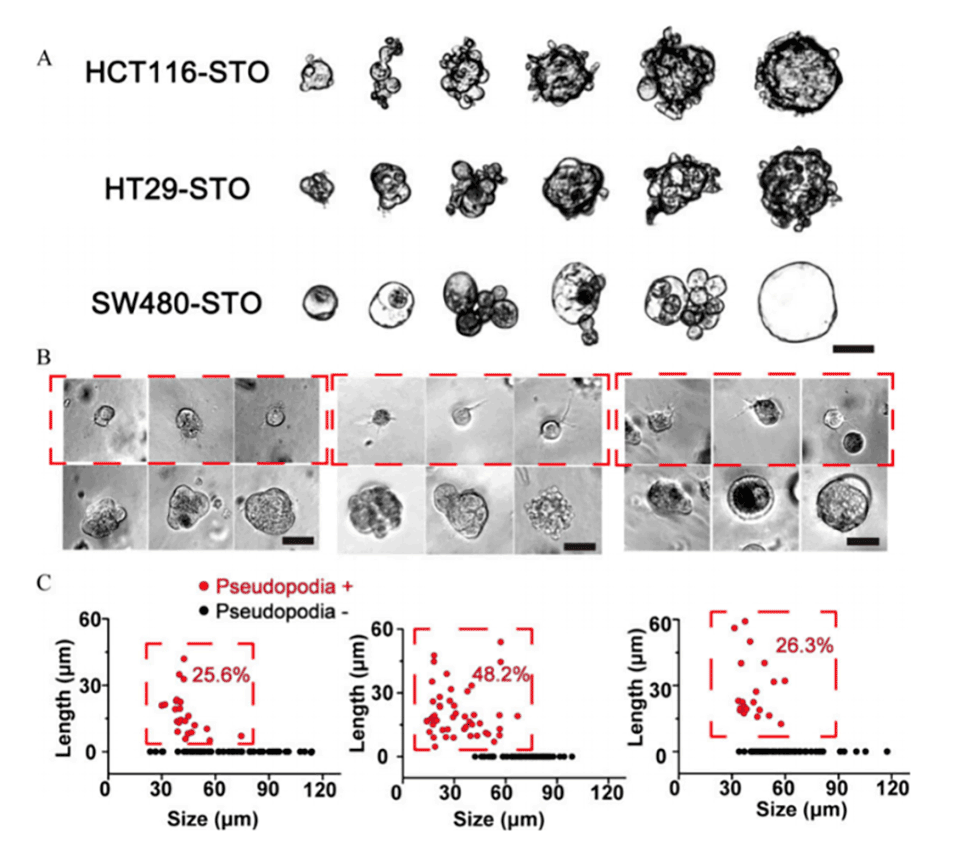
图5.(A)单个STO之间的形态差异。比例尺:50μm。(B)在Matrigel中培养2天后,STO中侵袭性伪足的发育情况。比例尺:50μm。(C)不同大小的STO中侵袭性伪足的发育情况。
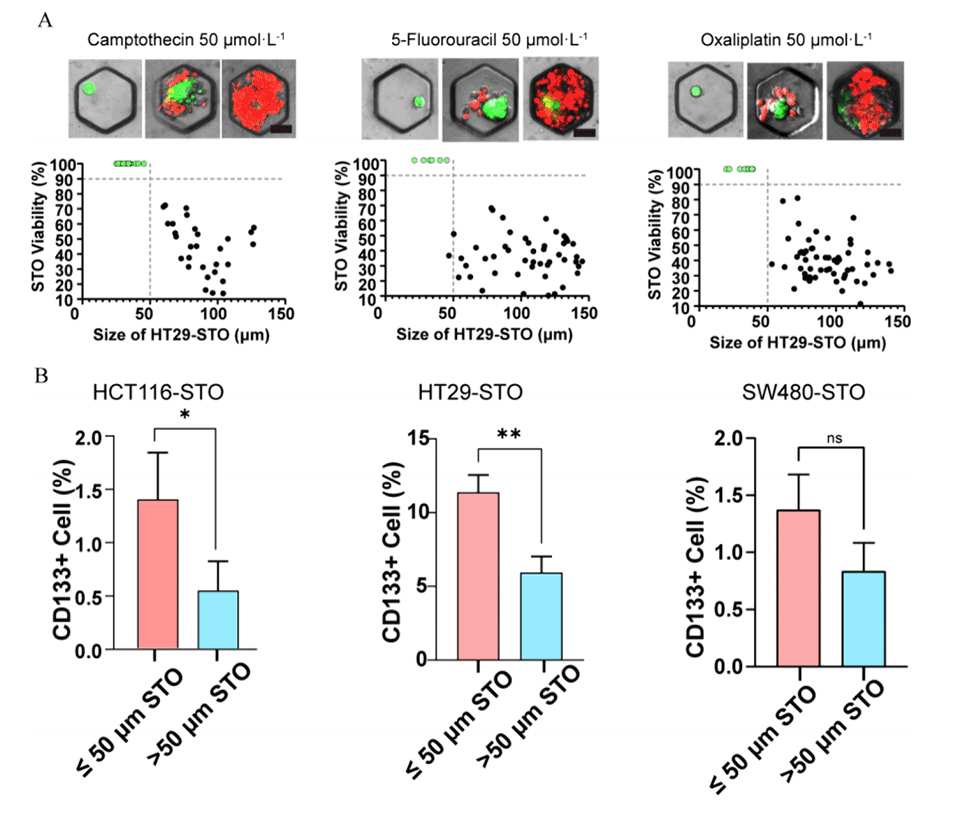
图6.(A)用药物组合(CPT 50μmol/L、5-Fu 50μmol/L和OX 50μmol/L)处理HT29-STO 48小时后,使用钙黄绿素AM/PI染色测定单个STO内细胞的存活率(上图)。比例尺:50μm。散点图(绿色部分表示高度存活的STO)显示了存活率与STO大小的相关性(下图)。(B)流式细胞术结果显示,CD133在小尺寸和大尺寸STO的细胞中的表达(n=3)。
原文链接:
https://doi.org/10.1021/acsbiomaterials.4c00727














