间充质干细胞(MSCs)因其体外增殖能力和分化为中胚层谱系(特别是成骨细胞)的潜力,已成为干细胞研究和临床前研究不可或缺的来源。这种能力推动了它们在骨再生和骨软骨修复领域的应用。评估MSC分化状态的传统方法需要侵入性操作,例如细胞裂解或固定。

近期,北京科技大学张美芹教授团队提出了一种结合柔性探针扫描电化学显微镜(SECM)和微流控装置的无标记、非侵入性技术,用于实时监测和评估间充质干细胞球状体在不同诱导条件下的成骨分化过程。相关研究以“Label-Free Imaging of Mesenchymal Stem Cell Spheroid Differentiation with Flexible-Probe SECM and a Microfluidic Device”为题目,发表在期刊《Analytical Chemistry》上。
本文要点:
1、本研究提出了一种结合柔性探针扫描电化学显微镜(SECM)和微流控芯片的无标记方法,用于实时评估人源性间充质干细胞(hMSC)球形体的成骨分化状态。
2、设计了一种具有可拆卸顶部的微流控芯片,该芯片能够同时培养并比较4组不同浓度成骨诱导培养基对hMSC球形体的影响。
3、通过追踪对氨基酚(PAP)的生成速率,并利用[Ru(NH3)6]Cl3(Ruhex)评估细胞形态变化,可以辨别指示成骨分化的碱性磷酸酶(ALP)活性的变化。
4、将SECM分析与免疫荧光染色和定量PCR相结合,验证了SECM结果的可靠性,并进一步分析了与成骨分化相关的基因表达。
5、该方法为无创性监测干细胞分化过程提供了新的技术手段,有助于深入理解干细胞分化的分子机制,并应用于再生医学和组织工程领域。
这种无标记、非侵入性技术相比传统方法的优势包括:
1、非侵入性:不需要对细胞进行裂解或固定,能够保持细胞的自然状态和功能,对细胞微环境无干扰。
2、实时监测:能够连续跟踪细胞分化过程中的生化变化,提供动态监测。
3、高分辨率:柔性探针SECM提供了更高的空间分辨率,能够精确地分析细胞聚集体的微小变化。
4、无需标记:避免了使用荧光标记或放射性同位素等可能影响细胞生理状态的标记物。
5、兼容性:与后续的分子生物学检测如基因表达分析和免疫荧光染色兼容,便于验证SECM的观察结果。
6、多功能性:可以同时评估细胞形态和功能,如通过检测ALP活性来评估细胞的成骨分化情况。
局限性可能包括:
1、技术复杂性:SECM是一种相对复杂的技术,需要专业的操作培训和仪器维护。
2、设备成本:SECM设备及其配件可能成本较高,限制了其在一些实验室的普及。
3、样品制备:可能需要特定的样品制备技术,以确保细胞在微流控装置中的适当培养和分化。
4、数据分析:电化学信号的解析可能需要专业知识,以区分和解释与细胞分化相关的信号。
5、适用范围:虽然该技术适用于MSCs的成骨分化,但对其他类型细胞或不同分化路径的适用性可能需要进一步验证。
6、规模化挑战:对于大规模的细胞培养和分析,可能需要额外的系统优化和自动化技术。
这项技术通过提供一种新的监测手段,有助于推动干细胞研究和组织工程领域的发展,但其应用可能需要克服一些技术和成本上的挑战。
如何确保无标记、非侵入性SECM技术在监测干细胞分化过程中的准确性和可重复性?
1、优化探针设计:使用柔性微电极作为SECM探针,可以实现与细胞表面更接近的接触,从而提高空间分辨率和信号质量。
2、精确控制工作距离:通过调整探针与细胞培养基质之间的距离,可以优化信号获取,减少由于距离变化引起的误差。
3、双介质成像策略:利用[Ru(NH3)6]Cl3作为负反馈模式下的介质,可以独立于细胞表面形态记录细胞的电化学活性,从而准确反映细胞分化状态。
4、实时监测与数据分析:通过实时监测细胞分化过程中的电化学信号,并结合专业的数据分析方法,可以提高结果的准确性和可重复性。
5、微流控装置的标准化:使用标准化的微流控装置进行细胞培养和分化,可以确保实验条件的一致性,增强实验结果的可比性。
6、后续生物学验证:通过免疫荧光染色和qPCR等分子生物学方法对SECM的结果进行验证,可以确保监测结果的生物学意义和可靠性。
7、实验操作的规范化:制定严格的实验操作流程和质量控制标准,减少操作误差,提高实验的可重复性。
通过上述措施,可以在不使用标记物的情况下,准确、可重复地监测干细胞的分化过程,为干细胞研究提供了一种新的分析工具。
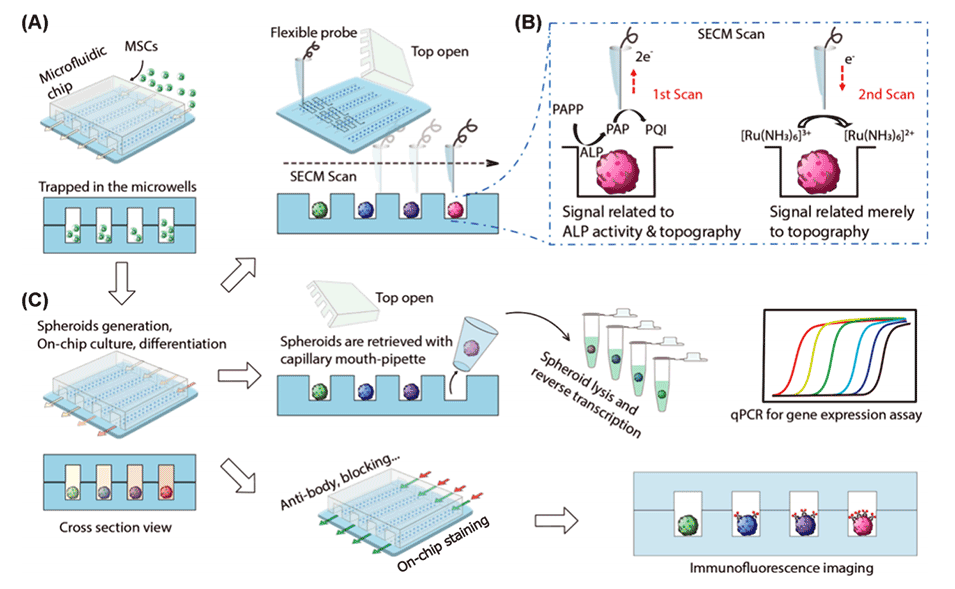
图1.使用带有微流体阵列的柔性探针SECM进行MSC球体成骨分化分析的示意图。
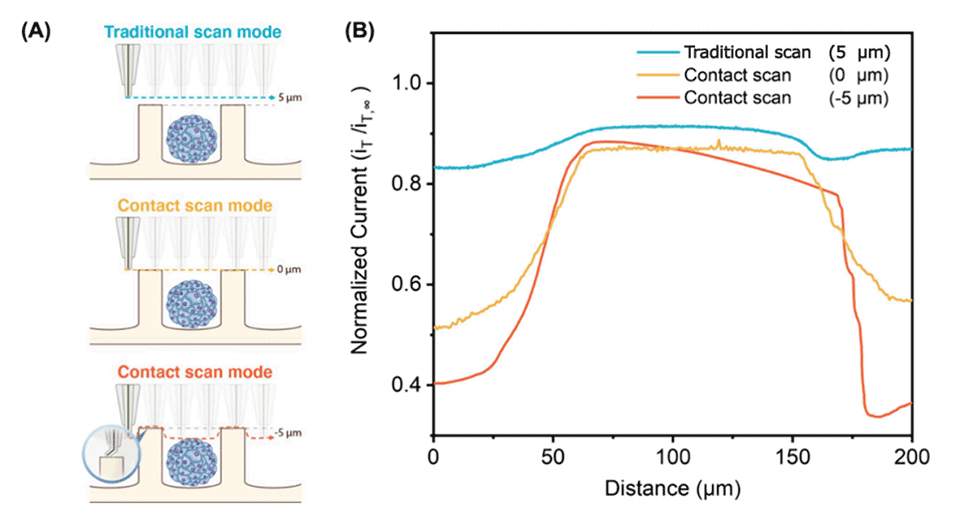
图2.SECM工作电极和PDMS基底之间的最佳扫描距离研究。
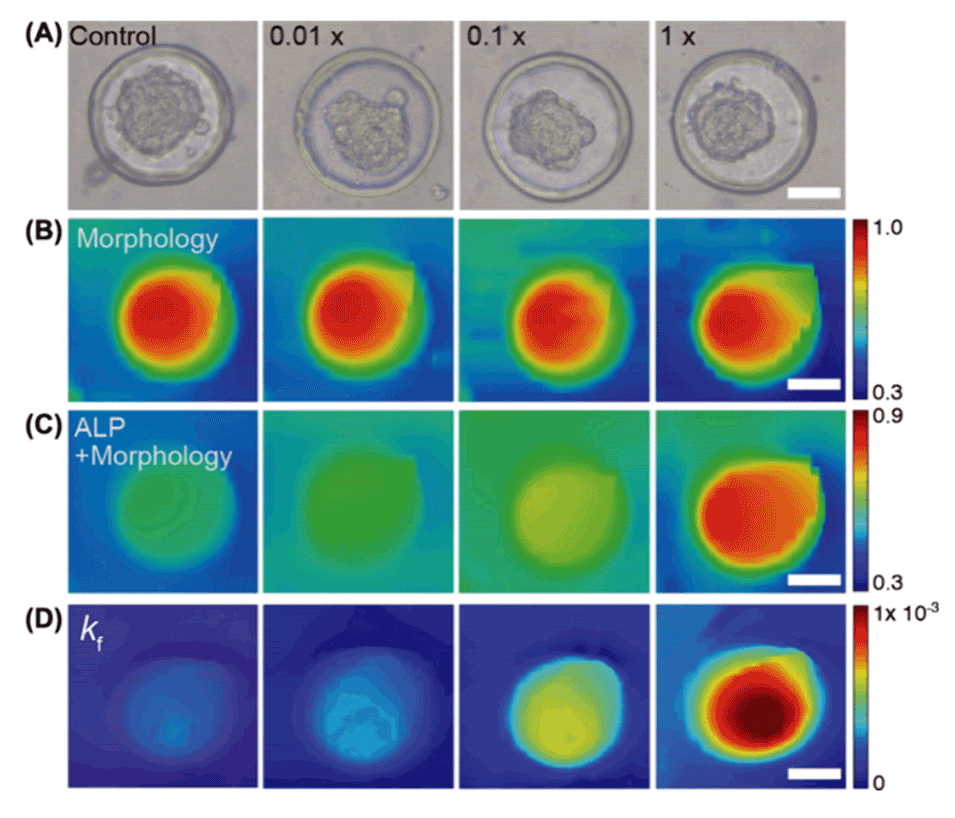
图3.四种分化条件(不同OM浓度)下微孔结构中球体的SECM扫描成像。

图4.通过免疫荧光染色和基因表达分析来确定,在微流控装置中培养的hMSC球状体在不同浓度成骨诱导培养基(OM)下的成骨分化状态。
原文链接:https://doi.org/10.1021/acs.analchem.4c01637














