
导读:
实验进化是仔细检查和剖析抗菌素耐药性发展的有力方法。然而,它通常需要较长的时间来检测进化变化。近期,宝洁新加坡创新中心刘吉泉团队与中国科学院青岛生物能源与过程研究所孙鲁阳、徐健、马波等人合作,提出了一种基于微流体的实验进化系统,该系统能够快速建立高密度细胞群并加速抗菌素耐药性的进化过程。相关研究以“Ultrafast Evolution of Bacterial Antimicrobial Resistance by Picoliter-Scale Centrifugal Microfluidics”为题目,发表在期刊《Analytical Chemistry》上。
本文要点:
1、本研究设计了一种离心微流控系统,以加速细菌耐药性的实验进化过程。
2、通过芯片上的简单离心步骤,实现了约1012个细胞/mL的高密度细菌基质,使细菌能在比最低抑菌浓度(MIC)高数倍的抗菌浓度下生存并快速产生耐药性。
3、在芯片上进化48小时后,大肠杆菌对消毒剂(三氯生)和抗生素(环丙沙星和阿米卡星)的敏感性降低了64至128倍,速度远快于传统的连续接种实验进化。
4、该微流控系统的快速性和简便性表明其在揭示抗药性机制以及识别杀菌剂和抗生素靶标方面具有广泛的应用前景。
微流控系统与传统培养方法相比,在抗生素筛选和耐药性研究中有哪些优势?
1、加速抗药性进化:微流控系统能够在短时间内(如10小时内)促进细菌的抗药性进化,而传统的连续培养方法通常需要几周到几个月的时间。这种加速的进化过程使得研究人员能够更快地观察到细菌对抗生素的适应和耐药性的进展。
2、高密度培养:微流控芯片能够在微通道中实现高达约1012个细胞/mL的细菌浓度,这种高密度的环境促进了细菌之间的竞争和群体感应,从而加速了耐药性的发展。
3、空间分隔和浓度梯度:微流控系统能够创建数百万个微小的培养环境,允许细菌在不同的抗生素浓度下生长。这种空间分隔有助于细菌在不同的压力条件下进行选择和适应,而传统方法则难以实现这种精细的控制。
4、减少试剂使用:微流控技术需要的试剂量远低于传统培养方法,这不仅降低了成本,也减少了实验的环境影响。
5、实时监测和分析:微流控系统可以结合实时监测技术(如拉曼光谱),直接在芯片上评估细菌的代谢活性和抗药性。这种实时分析能力使得研究人员能够更好地理解细菌在抗生素压力下的反应。
6、易于操作和高通量:微流控系统的操作相对简单,且能够实现高通量筛选,适合大规模的抗生素筛选和耐药性研究。
综上所述,微流控系统在抗生素筛选和耐药性研究中提供了更快、更高效和更灵活的实验平台,能够更好地应对当前抗生素耐药性日益严重的公共卫生挑战。
在微流控实验中,细菌对抗生素的耐药性是如何迅速产生的?
1、高密度细菌聚集:该系统利用离心技术在微通道末端形成高达1012个细胞/mL的细菌聚集。这种高密度环境促进了细菌之间的竞争和合作,增强了细菌适应环境的能力。
2、快速选择压力:在微流控芯片中,细菌能够在抗菌剂浓度高于最小抑菌浓度(MIC)10-20倍的条件下生长。这种极端的选择压力加速了抗药性突变的发生,使细菌能够迅速适应并存活于高浓度的抗生素环境中。
3、触发群体感应:高密度细菌聚集使得细菌能够产生和检测信号分子,启动群体感应机制。这一机制使细菌能够协调其行为,激活与抗药性相关的基因,例如外排泵和抗菌降解酶的产生,从而增强其对抗生素的抵抗力。
4、生物膜的形成:在高密度环境中,细菌更容易形成生物膜,这为其提供了额外的保护屏障,增强了对抗生素的抵抗能力。生物膜中的细菌能够更好地抵御外部压力,进一步促进耐药性的积累。
5、抗生素靶点的改变:细菌通过突变或基因重组改变抗生素的靶点,从而降低抗生素的结合能力和有效性。这种机制使得细菌能够逃避抗生素的抑制作用,进一步增强耐药性。
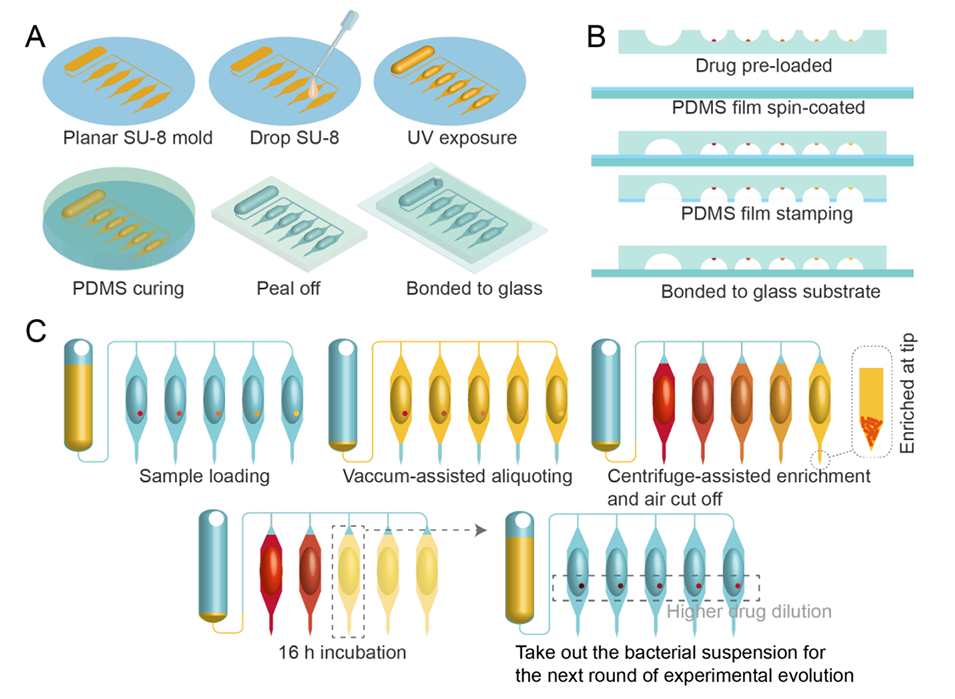
图1.所提出的芯片上实验进化方案。
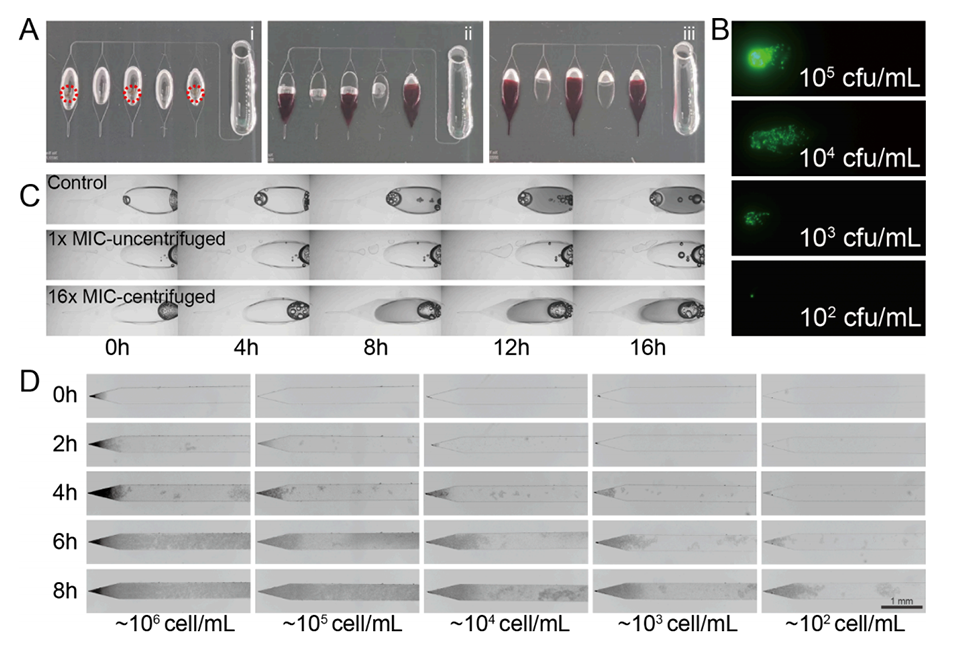
图2.微流控装置中细菌细胞的上样和片上富集。
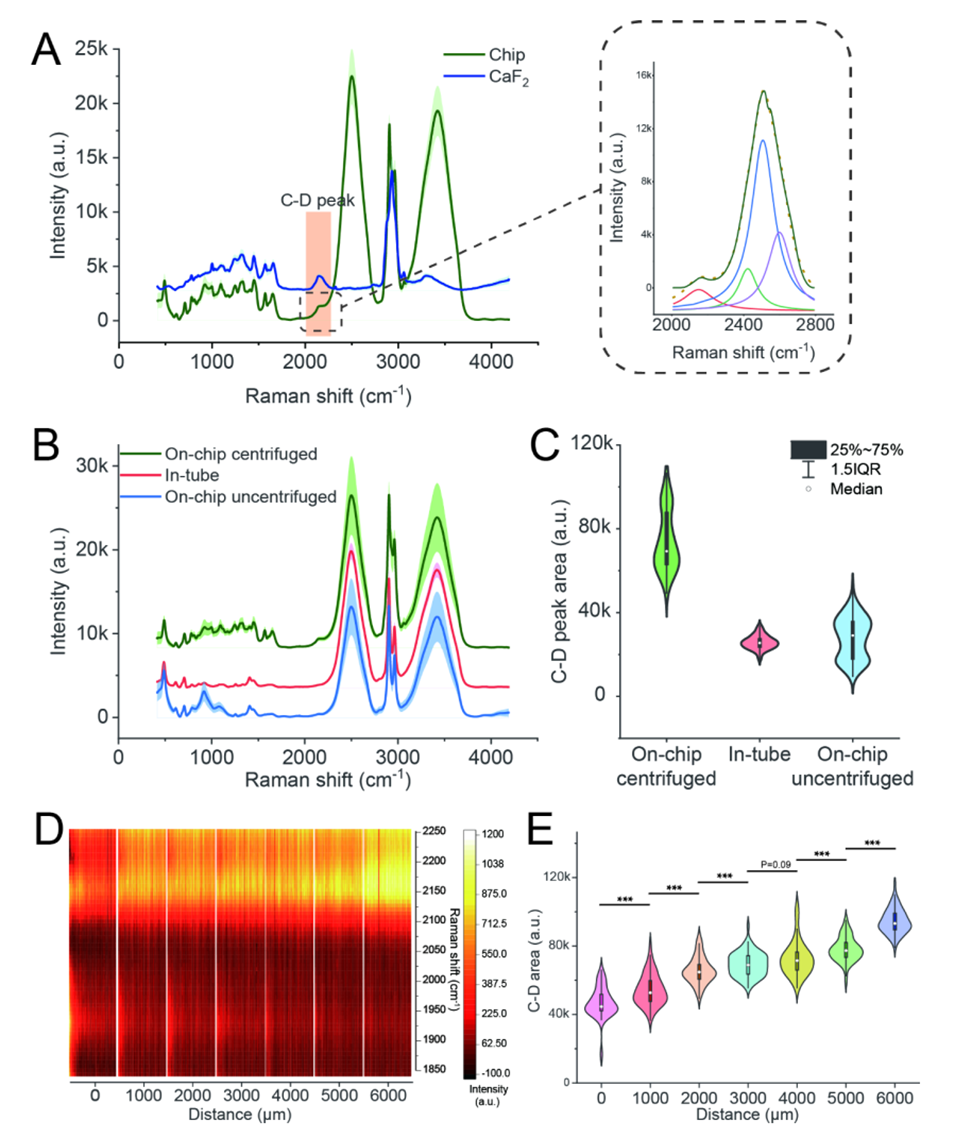
图3.在由于三氯生暴露而施加进化压力的情况下,微流控芯片中细菌代谢活力的分析。
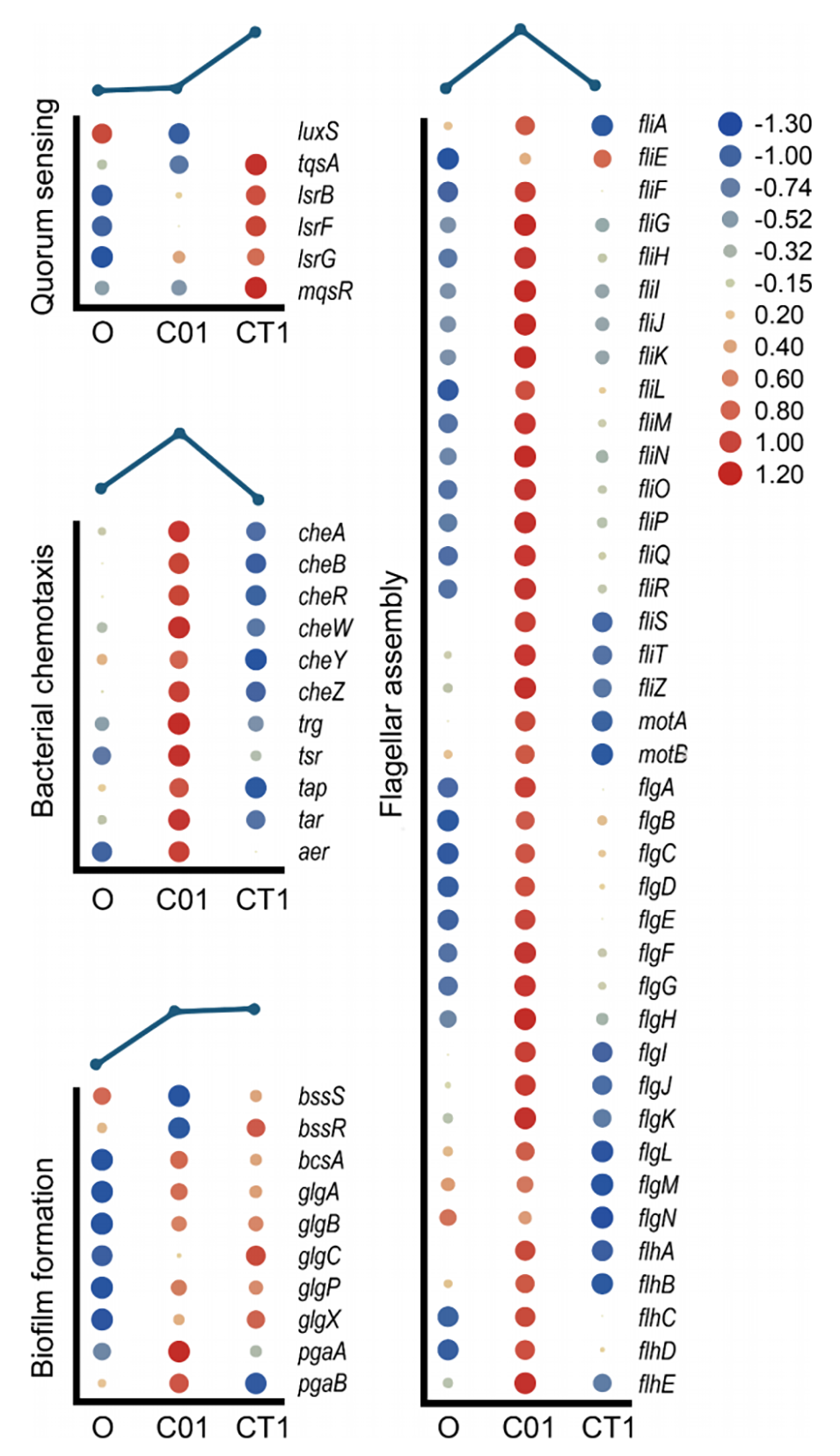
图4.芯片上进化后菌株的RNA-seq。
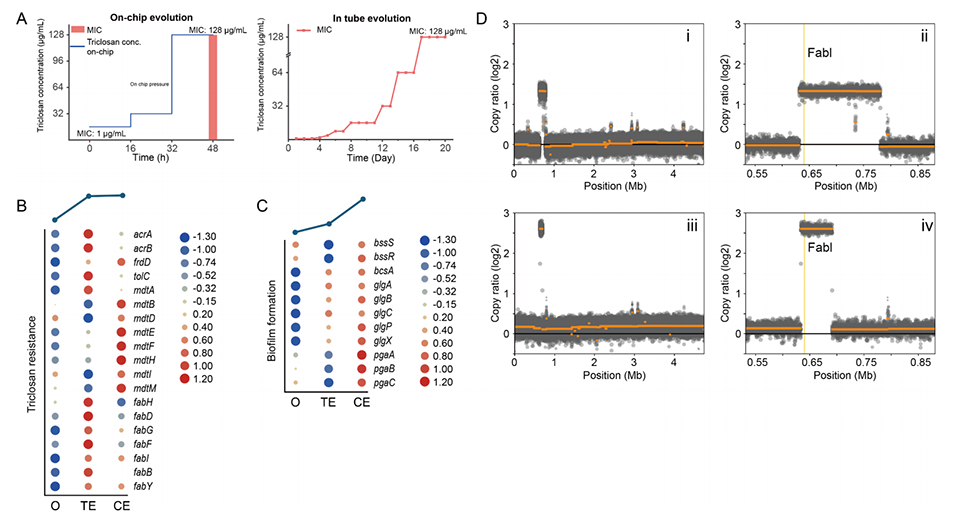
图5.大肠杆菌(ATCC8739)芯片上和管内实验进化的比较。
论文链接:https://doi.org/10.1021/acs.analchem.4c04482














