循环肿瘤细胞(CTCs)是肿瘤发生、进展和预后监测的关键指标,但高灵敏度和高纯度捕获CTCs仍然是一大挑战。此外,原位捕获和同步清除有望成为阻止肿瘤转移的方法,但还需要进一步探索。

近期,吉林大学董彪教授团队联合吉林大学第一医院刘海鹏副教授团队,提出了一种结合磁性纳米粒子和倒置微流控芯片的技术,有效提高了CTCs捕获效率和纯度,并能对其进行原位灭活,为预防肿瘤转移提供了新策略。相关研究以“Combining hybrid cell membrane modified magnetic nanoparticles and inverted microfluidic chip for in situ CTCs capture and inactivation”为题目,发表在期刊《Biosensors and Bioelectronics》上。
本文要点:
1、本研究设计了一种生物模拟细胞膜包覆的磁性纳米颗粒(NPs),以解决血液循环中免疫系统对捕获探针的非特异性吸附问题。
2、通过提取人乳腺癌细胞膜(TM)和白细胞膜(WM),形成混合膜(HM),并将其修饰在载有吲哚菁绿(ICG,光敏剂)的多孔磁性NPs表面。
3、掺入TM增强了材料的靶向特异性,提高了捕获效率,而WM涂层减少了同源白细胞(WBC)的干扰,进一步提高了捕获纯度。
4、结合新型倒置微流控芯片,首次使用聚合物光子晶体作为CTCs捕获界面。除了为CTC附着提供有利的表面结构外,808nm光子带隙还可有效放大捕获表面位置处的808nm激发光。
5、在捕获CTCs后,探针中的ICG分子促进增强的光热(PTT)和光动力(PDT)协同效应,直接灭活捕获的CTCs。
6、这种方法实现了超过95%的捕获效率和纯度,并可原位灭活CTCs,为抑制肿瘤转移提供了新思路。
循环肿瘤细胞(Circulating Tumor Cells, CTCs)是从实体肿瘤中脱落并进入外周血液循环的肿瘤细胞。它们在肿瘤转移过程中起关键作用,是肿瘤从原发部位扩散到其他器官的重要环节。CTCs的研究在癌症领域具有重要意义,主要体现在以下几个方面:
1、肿瘤监测和诊断:CTCs的存在和数量可以作为肿瘤发生、进展和复发的生物标志物,为癌症的早期诊断和预后评估提供重要信息。
2、转移机制研究:CTCs是肿瘤转移的关键环节,通过研究其特性和行为,可以深入了解癌症转移的分子机制,从而为抑制转移提供新策略。
3、个性化治疗:通过分离和分析CTCs,可以获得患者肿瘤的分子信息,帮助制定个性化治疗方案,提高治疗效果。
4、实时监测治疗效果:CTCs数量的动态变化可以实时反映治疗的效果,为治疗方案的调整提供依据。
总之,CTCs在癌症的发生、进展和治疗中扮演着重要角色,是癌症研究和临床应用中的关键生物标志物。
倒置微流控芯片在CTCs捕获和灭活中的作用机制如下:
倒置设计与磁场协同:芯片采用倒置设计,经磁性纳米颗粒标记的CTCs在外部向上磁场的作用下上升并被捕获在芯片表面,而白细胞等其他细胞则因重力和流体剪切力作用而下沉,最终从芯片中排出。
磁性纳米颗粒与混合膜技术:磁性纳米颗粒由肿瘤细胞膜(TM)和白细胞膜(WM)融合形成的混合膜(HM)包覆,增强了对CTCs的靶向性,同时减少了白细胞等背景细胞的非特异性吸附,从而提高了捕获效率和纯度(均超过95%)。
光子晶体结构的应用:芯片表面引入了具有808 nm带隙的聚合物光子晶体(OPC)层。该光子晶体结构不仅提供了有利的表面结构以增强CTCs的附着,还通过光子带隙效应放大了808 nm激发光信号,并延长其在捕获表面的作用时间,从而显著增强了光热(PTT)和光动力(PDT)的协同效应。

图1.CTC捕获平台示意图。制备Fe3O4-ICG@HM纳米平台用于高效分离和检测稀有CTCs。WM和TM融合为HM,然后涂覆在Fe3O4-ICG上。在用纳米复合材料标记后,将CTC注入具有倒置捕获表面和外部磁体的微流控芯片中。使用共聚焦激光扫描显微镜(CLSM)进行实时捕获和原位PDT/PTT。

图2.A)磁性纳米颗粒的合成工艺;B)Fe3O4和Fe3O4-ICG@HM的TEM图像;C)Fe3O4的XRD分析;D)Fe3O4-ICG、ICG和Fe3O4的FTIR光谱;E)WM、TM、WM和TM的混合物以及融合的HM的CLSM图像。比例尺=50μm;F)SDS-PAGE用于蛋白质分析,1)WM,2)TM,3)HM,4)Fe3O4-ICG@HM;G)Fe、S元素的相应能量色散X射线(EDX)图和Fe、S、O、Na、N元素的混合图像;H)与MCF-7细胞孵育3小时的融合HMs的CLSM图像。细胞核、TM和WM分别用Hoechst(蓝色)、DiO(绿色)和DiI(红色)标记。比例尺=100μm。

图3.A-B)近红外辐照(808nm,1.0W/cm2,10min)下水、Fe3O4、ICG、Fe3O4-ICG和Fe3O4-ICG@HM的温度升高;C)近红外辐照(808nm,1.0W/cm2,10min)下,不同浓度Fe3O4(ICG浓度固定为10μg/mL)的温度升高;D)近红外辐照(808nm,1.0W/cm2,10min)下,不同浓度ICG(Fe3O4浓度固定为100μg/mL)的温度升高;E)随着近红外辐照率的变化,ICG浓度为10μg/mL和Fe3O4浓度为100μg/mL时的温度升高;F)Fe3O4和Fe3O4-ICG在重复激光照射和冷却试验中的温度变化曲线;G)Fe3O4、ICG、Fe3O4-ICG和Fe3O4-ICG@HM产生的ROS的CLSM图像。比例尺=100μm;H)ROS指示剂DPBF与不同浓度ICG混合在10min近红外辐照(808nm,1.0W/cm2)下的紫外-可见吸收变化;I)在不同时长的近红外辐照(808nm,1.0W/cm2)下,ROS指示剂DPBF与Fe3O4、ICG和Fe3O4-ICG混合的紫外-可见吸收变化。

图4.A)与DiI标记的Fe3O4-ICG@HM(Fe3O4-ICG@HM浓度为100μg/mL)孵育2小时后,MCF-7、RAW264.7、B16和L929细胞的CLSM图像。比例尺=150μm;B)与Fe3O4-ICG、Fe3O4-ICG@WM、Fe3O4-ICG@TM和Fe3O4-ICG@HM孵育的MCF-7、RAW264.7、L929细胞的明场图像。比例尺=100μm;C)与Fe3O4-ICG@WM、Fe3O4-ICG@TM和Fe3O4-ICG@HM孵育的MCF-7细胞的流式细胞术分析。设置空白组作为对照;D)与Fe3O4-ICG@WM、Fe3O4-ICG@TM和Fe3O4-ICG@HM孵育的RAW264.7细胞的流式细胞术分析。设置一个空白组作为对照。
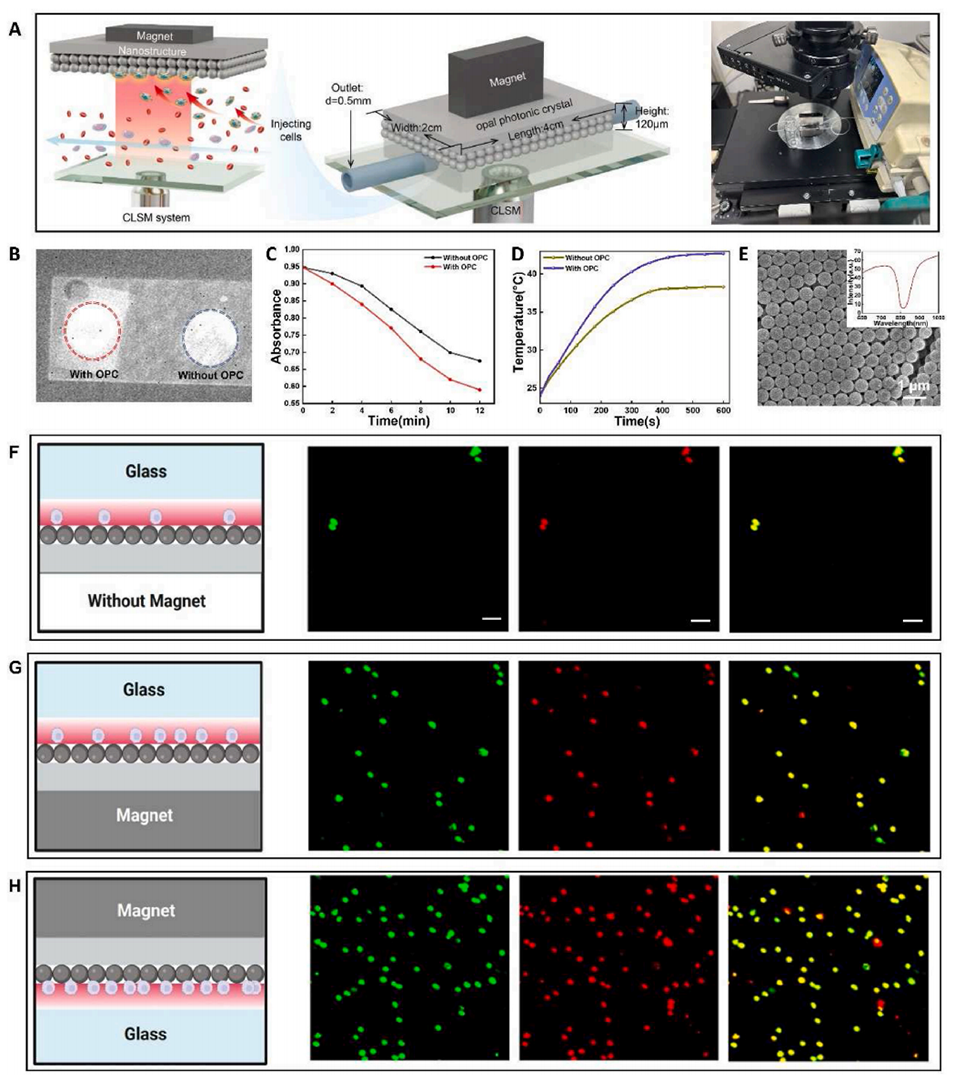
图5.A)倒置微流控芯片捕获CTCs的示意图。以及CTCs隔离的工作站设置。使用注射泵将样品连续泵入芯片;B)将OPC放置在玻璃上,然后将ICG滴在其上,建立空白对照组(不含OPC的玻璃),并通过光场NIR成像系统成像;C)在近红外辐照(808nm,1.0W/cm2,10分钟)下,有OPC和没有OPC的吸光度随时间变化;D)在近红外辐照(808nm,1.0W/cm2,10分钟)下,有OPC和无OPC的温度升高;E)微流控芯片上OPC结构的SEM图像。以及OPC的透射率。808nm附近的最低透射率表明808nm的光在OPC的表面上被多次反射;F)OPC捕获表面在底部,没有磁铁;G)OPC捕获表面设置在底部,下方有磁铁;H)OPC捕获表面朝上,上方有磁铁。捕获细胞以及通道中混合物的CLSM图像。比例尺=100μm。

图6.A)用不同浓度的Fe3O4-ICG@HM孵育的MCF-7细胞的CLSM图像。比例尺=150μm;B)MCF-7细胞和RAW264.7细胞通过芯片前的流式细胞术分析;C)RAW264.7细胞通过芯片后的流式细胞术分析;D)芯片上捕获的MCF-7细胞的流式细胞术分析;E)OPC捕获表面上捕获的细胞的SEM图像;F)捕获表面上灭活的捕获CTCs的示意图;G)不同浓度Fe3O4-ICG@HM处理MCF-7细胞的捕获效率;H)与Fe3O4-ICG@HM孵育不同时间的MCF-7细胞的捕获效率;I)在微流体芯片内与CLSM一起进行的原位PDT/PTT。比例尺=50μm。用808nm激光照射捕获的细胞10min。
论文链接:https://doi.org/10.1016/j.bios.2024.116575














