血栓闭塞性脉管炎(TAO)是一种以血栓形成和炎症加剧为特征的慢性周围血管疾病,现有疗法效果有限。作为一种有前景的TAO治疗手段,间充质干细胞(MSCs)移植有望替代传统的药物治疗和手术干预。然而,由于移植细胞的存活率低、滞留时间短以及植入效果不佳,MSCs治疗的临床应用受到限制。

近期,中国科学院上海硅酸盐研究所陈航榕研究员和马明研究员通过微流控技术开发了负载间充质干细胞(MSCs)与氧化铈纳米酶(CeNPs)的GelMA水凝胶微球(CeGel)。该体系通过清除活性氧(ROS)保护干细胞存活,协同抑制巨噬细胞炎症因子释放,并显著促进缺血肢体内皮修复与血管再生。相关研究以“Cerium Nanozyme-Powered Hydrogel Microspheres Alleviate Thromboangiitis Obliterans via Enhanced Stem Cell Therapy”为题目,发表在期刊《Small》上。
本文要点:
1、本研究开发了一种基于微流控技术的可注射甲基丙烯酰化明胶(GelMA)水凝胶微球(CeGel),负载间充质干细胞(MSCs)和氧化铈纳米颗粒(CeNPs),用于增强TAO治疗。
2、CeNPs通过清除活性氧(ROS)保护MSCs免受氧化应激损伤,同时抑制巨噬细胞释放促炎因子,打破“ROS-炎症”恶性循环。
3、体外实验表明,CeGel显著提升MSCs存活率(H2O2处理后存活率从28%增至84%),并促进内皮细胞迁移与血管生成。
4、体内实验中,TAO模型大鼠经MSCs@CeGel治疗后,缺血肢体血流恢复加速,血栓减少,炎症因子(IL-6、TNF-α等)水平显著下降。
4、此外,水凝胶微球提供机械支撑,延长MSCs体内滞留时间,协同增强疗效。
5、研究证实,MSCs与CeNPs的联合应用通过调节微环境氧化应激和炎症反应,为TAO治疗提供了高效协同策略,具有临床转化潜力。
GelMA水凝胶微球的制备过程包括以下几个步骤:
1、材料配置
水相:将甲基丙烯酰化明胶(GelMA)与光引发剂(苯基(2,4,6-三甲基苯甲酰基)磷酸锂盐)溶解于磷酸盐缓冲液(PBS)中,并加入氧化铈纳米颗粒(CeNPs,500 μg/mL)和间充质干细胞(MSCs,5×105cells/mL)。
油相:将表面活性剂Span 80溶于轻质矿物油中,形成乳化相。
2、微流控液滴生成
采用3D打印的微流控芯片,芯片设计含针状分散相通道以增强剪切力。通过调节水相与油相的流速(通常水相流速较低,油相较高),在芯片内形成均匀液滴(直径约380 μm)。
此过程通过视频监控确保液滴稳定性和尺寸一致性。
3、光交联固化
液滴流出芯片后,通过紫外光(395 nm,10 W)照射触发GelMA的光聚合反应,形成固态微球。光交联过程固定CeNPs和MSCs的空间分布,同时保持微球的多孔结构(SEM显示孔径均一)。
4、后处理与验证
离心纯化:收集微球并用PBS洗涤,去除残留油相。
结构表征:通过光学显微镜观察微球形态,扫描电镜(SEM)确认多孔结构;元素映射(HAADF-STEM)验证CeNPs的均匀分散。
细胞活性检测:活/死染色显示微球内MSCs存活率高达90%以上,证明制备过程对细胞无显著损伤。
5、功能测试
降解实验:在胶原酶(2 U/mL)环境中,微球8天内几乎完全降解,同时CeNPs以纳米颗粒形式缓释。
体内滞留验证:通过荧光标记(如DiR染料)结合活体成像(IVIS),证实微球可延长MSCs在缺血肢体的滞留时间至7天以上。
氧化铈纳米颗粒在干细胞疗法中的作用:
1、清除活性氧(ROS):CeNPs凭借其超小粒径(2-5 nm)和表面氧空位特性,具有类似超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性,可高效清除TAO缺血微环境中的ROS(如·O2-、·OH和H2O2),保护移植的间充质干细胞(MSCs)免受氧化损伤,显著提高其存活率(H2O2处理后存活率从28%提升至84%)。
2、调节炎症微环境:CeNPs通过抑制巨噬细胞释放促炎因子(如TNF-α、IL-1β、IL-6),打破“ROS-炎症”恶性循环,改善局部微环境,为MSCs的功能发挥(分泌抗炎与促血管生成因子)提供支持。
3、促进血管再生:在体外实验中,CeNPs通过保护内皮细胞(HUVECs)免受氧化应激损伤,增强其迁移能力与血管生成活性,协同MSCs加速缺血组织的血管修复。
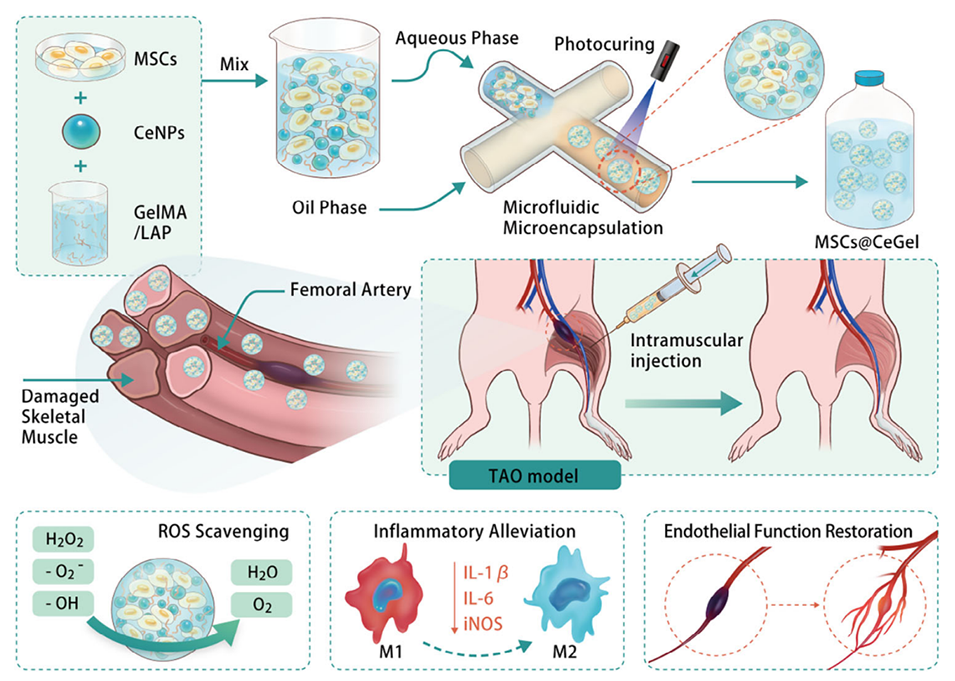
Scheme 1:MSCs@CeGel合成过程示意图及TAO的治疗机制。
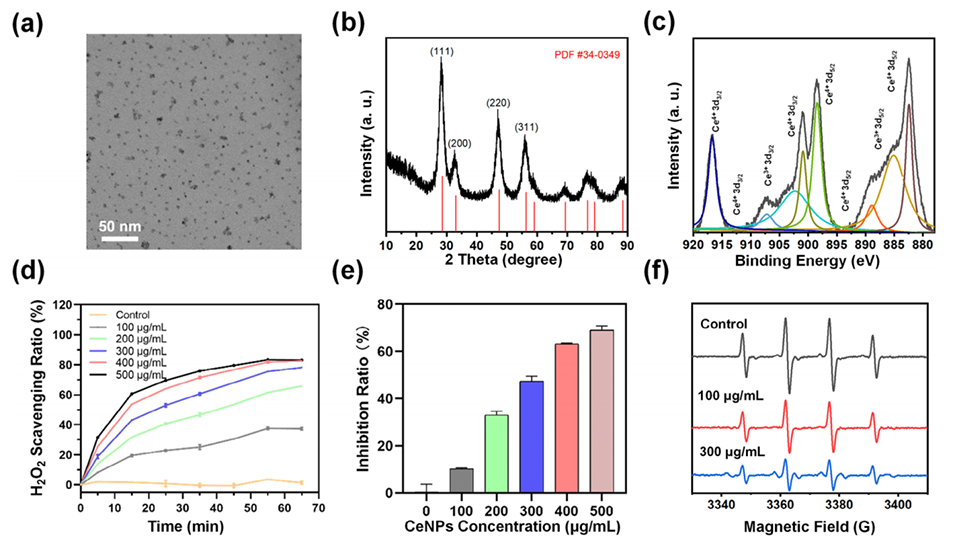
图1.CeNPs的表征和多酶活性。a)CeNPs的TEM图像。b)CeNPs的XRD图谱。c)CeNPs的XPS光谱。d)CeNPs的CAT样活性。e)CeNPs的SOD样活性。f)CeNPs的·OH清除活性。(d,e)中的数据以平均值±标准差表示(n=3)。
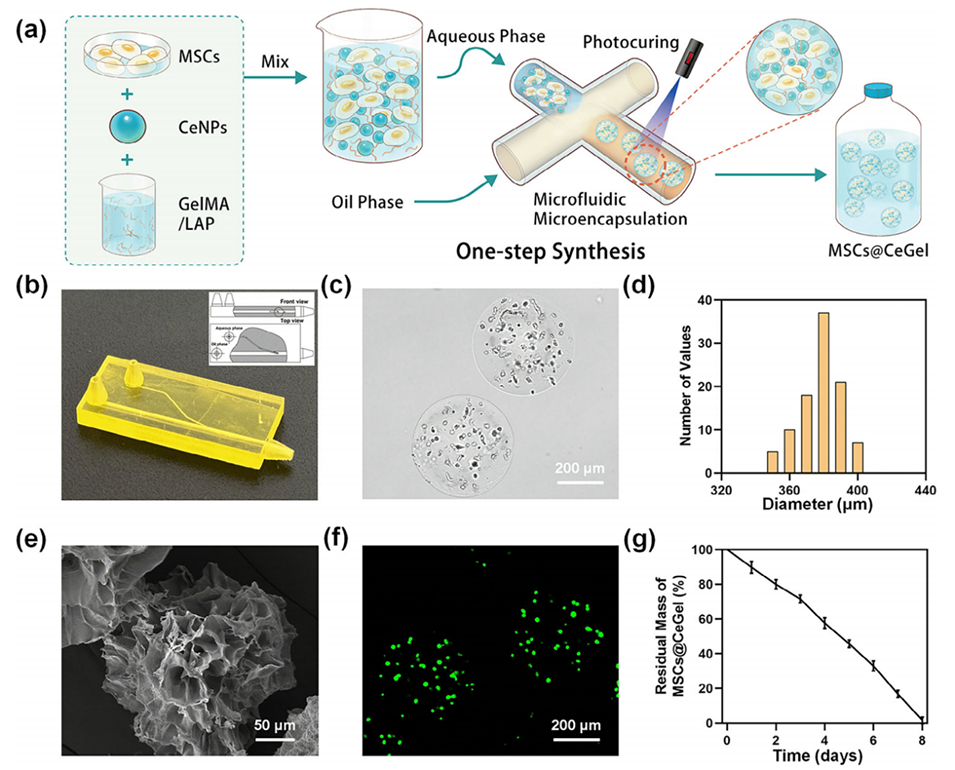
图2.MSCs@CeGel的表征。a)复合水凝胶微球合成示意图。b)3D打印微流控芯片的实物图和横截面图。c)MSCs@CeGel的光学显微图像。比例尺:200μm。d)MSCs@CeGel的粒径分布。e)MSCs@CeGel的SEM图像。比例尺:50μm。f)MSCs@CeGel的活/死测定。比例尺:200μm。g)MSCs@CeGel的降解曲线。(g)中的数据以平均值±标准差表示(n=5)。
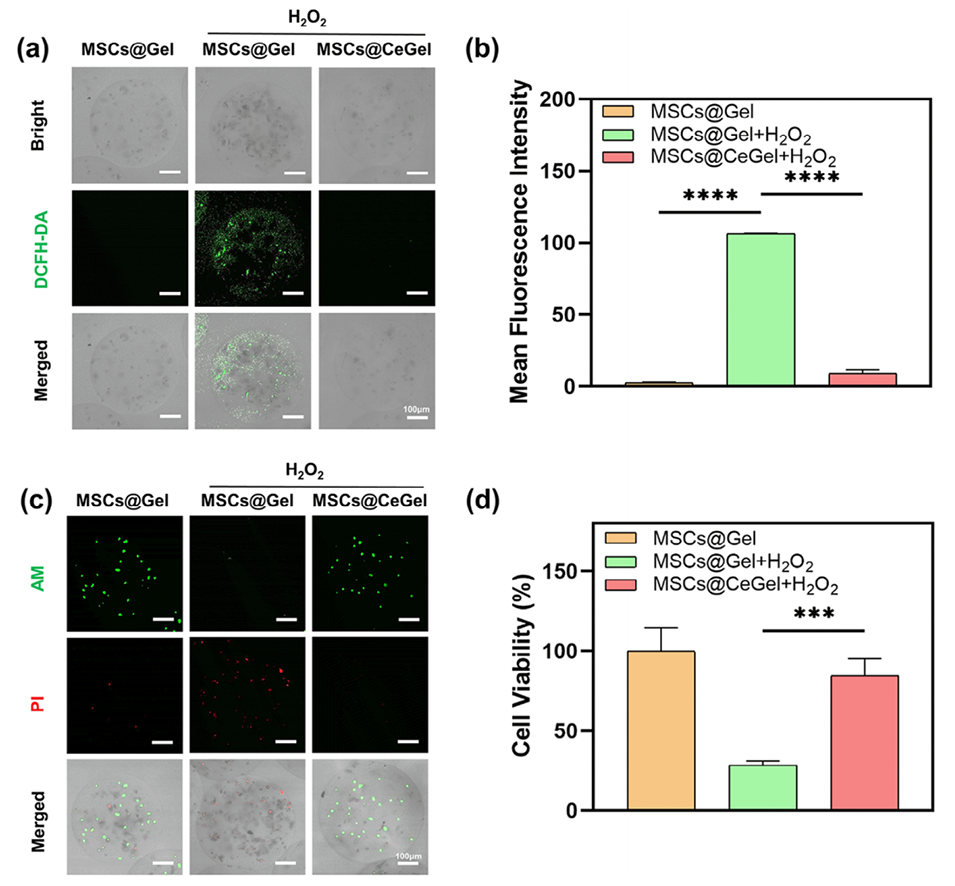
图3.CeGel水凝胶微球保护MSCs免受ROS诱导的损伤。a,b)水凝胶微球包裹的不同类型DCFH-DA染色MSCs的CLSM图像和定量分析。比例尺:100μm。c,d)包封在不同类型水凝胶微球中的MSCs的CLSM图像和定量分析。比例尺:100μm。数据以平均值±标准差表示,n=3。采用Student双侧t检验进行统计分析。*p<0.05、**p<0.01、***p<0.001和****p<0.0001表示不同的统计学显著性。ns表示无显著差异。
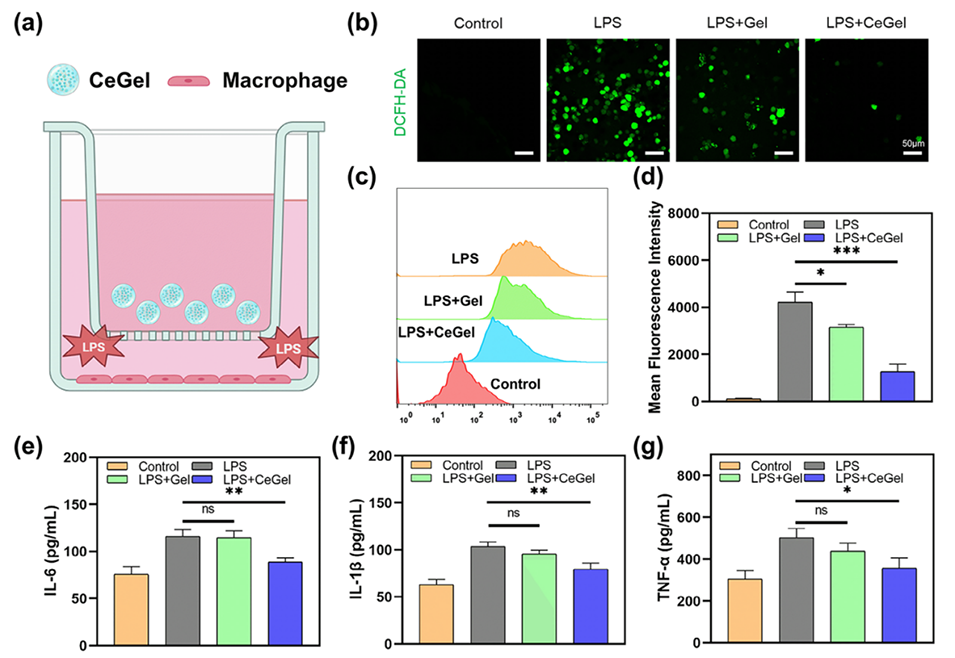
图4.CeGel的抗氧化和抗炎评价。a)利用CeGel微球减少氧化应激的实验方案。b)DCFH-DA染色RAW264.7细胞的CLSM图像分析。比例尺:50μm。c,d)使用经不同组处理的RAW264.7细胞检测ROS水平。e–g)经不同组处理的RAW264.7细胞的IL-6、IL-1和TNF-α水平。数据以平均值±标准差表示,n=3。
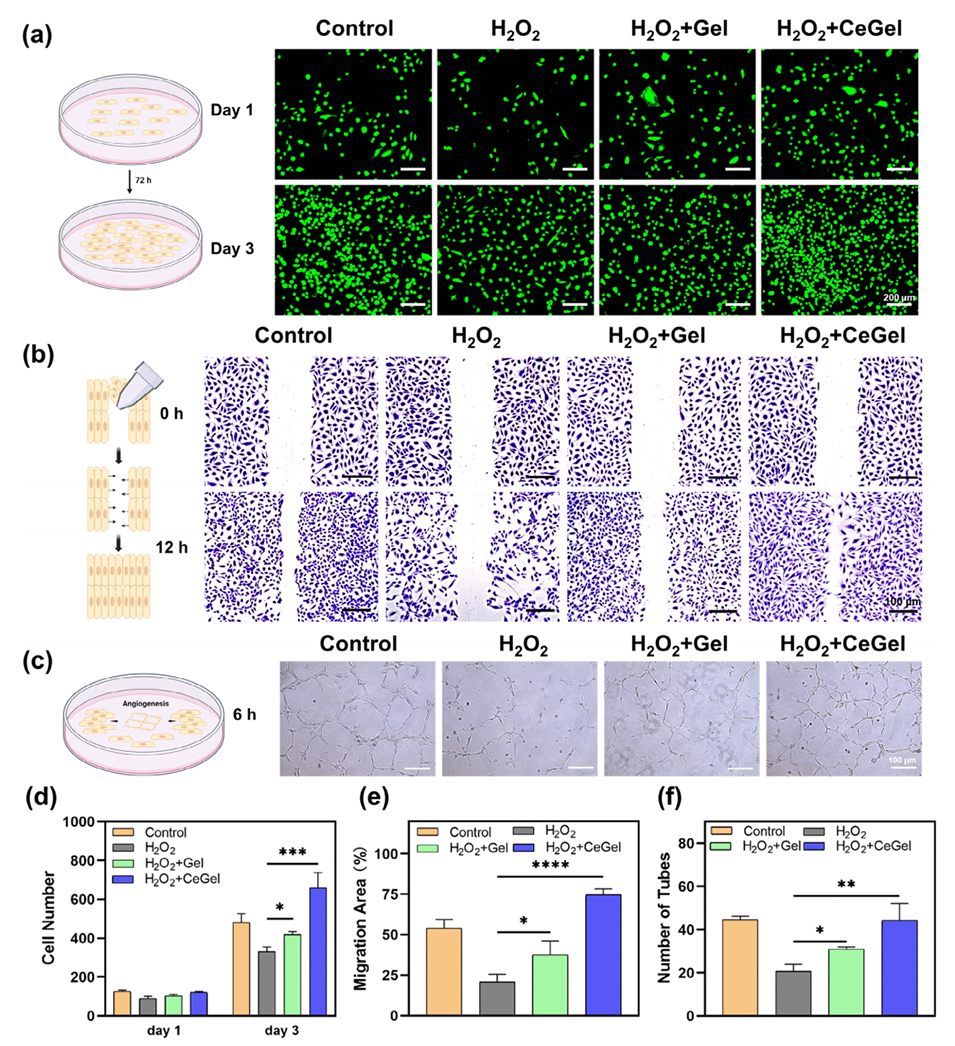
图5.细胞增殖、迁移和血管生成的体外评估。a,d)在第1天和第3天通过活/死染色观察HUVECs的增殖。比例尺:200μm。b,e)通过体外HUVECs定量评估各组的伤口愈合率。比例尺:100μm。c,f)使用HUVECs进行管形成试验。比例尺:100μm。数据以平均值±标准差表示,n=3。
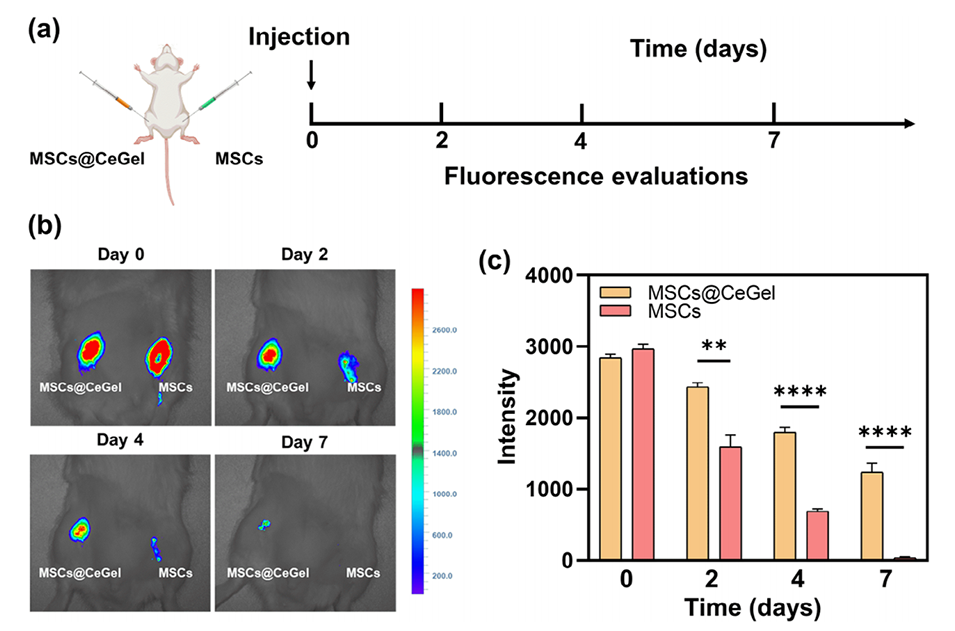
图6.CeGel在体内促进细胞滞留的能力。a)IVIS分析示意图。b)在第0、2、4和7天拍摄DIR标记的MSCs的IVIS图像,以描绘不同组中干细胞的保留情况。游离MSCs(右后肢),MSCs@CeGel(左后肢)。c)每个时间点的相对荧光强度。数据以平均值±标准差表示,n=3。
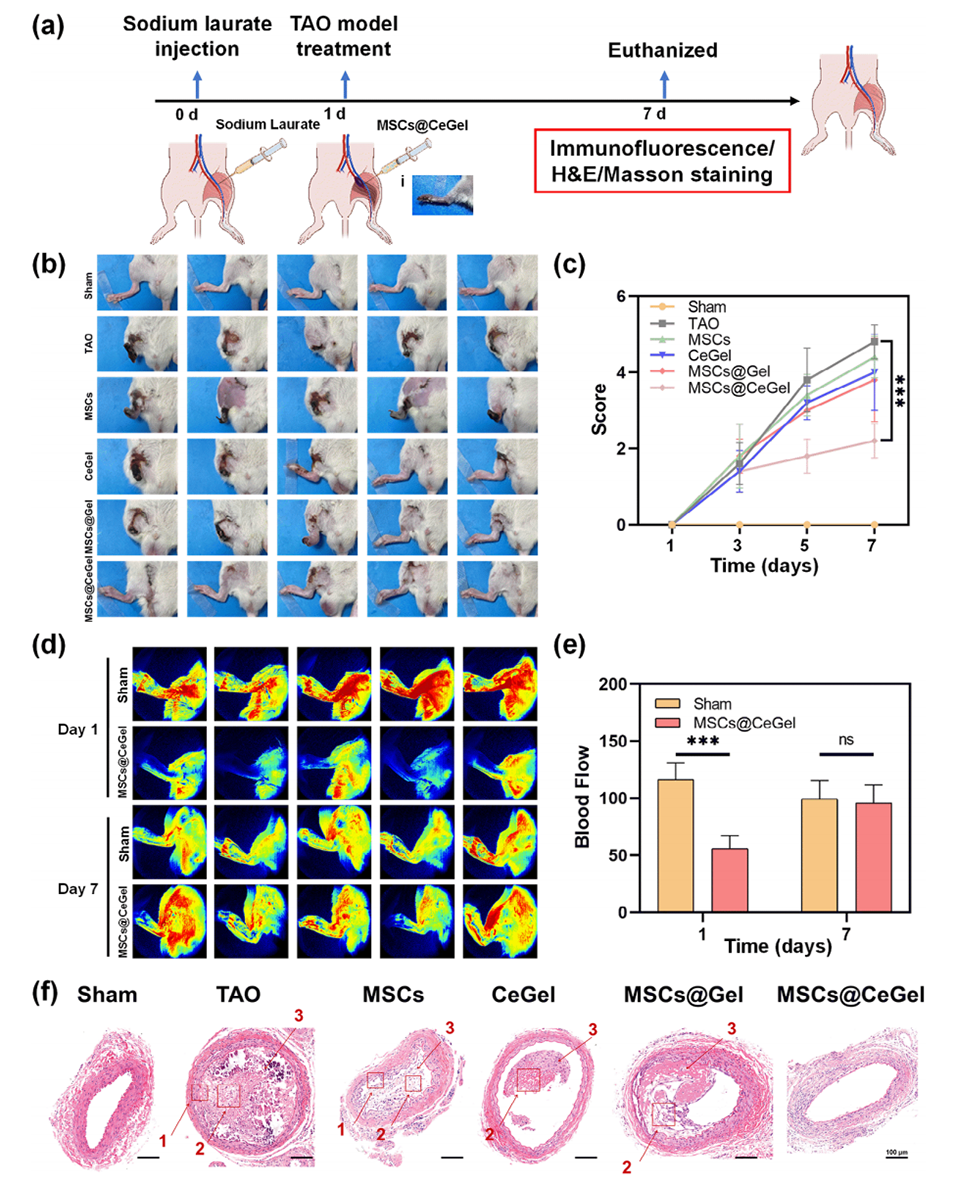
图7.MSCs@CeGel在TAO大鼠模型中的治疗效果。a)TAO大鼠模型的构建、治疗和分析的实验方案。i:该图像表明TAO大鼠模型的成功构建。b,c)不同组给药至第7天的后肢状况和评分总结。d,e)Sham和MSCs@CeGel组下肢的血流和定量分析。f)股动脉的典型H&E图像。1:内皮脱落,2:胶原纤维,3:炎性细胞。比例尺:100μm。数据以平均值±标准差表示,n=5。
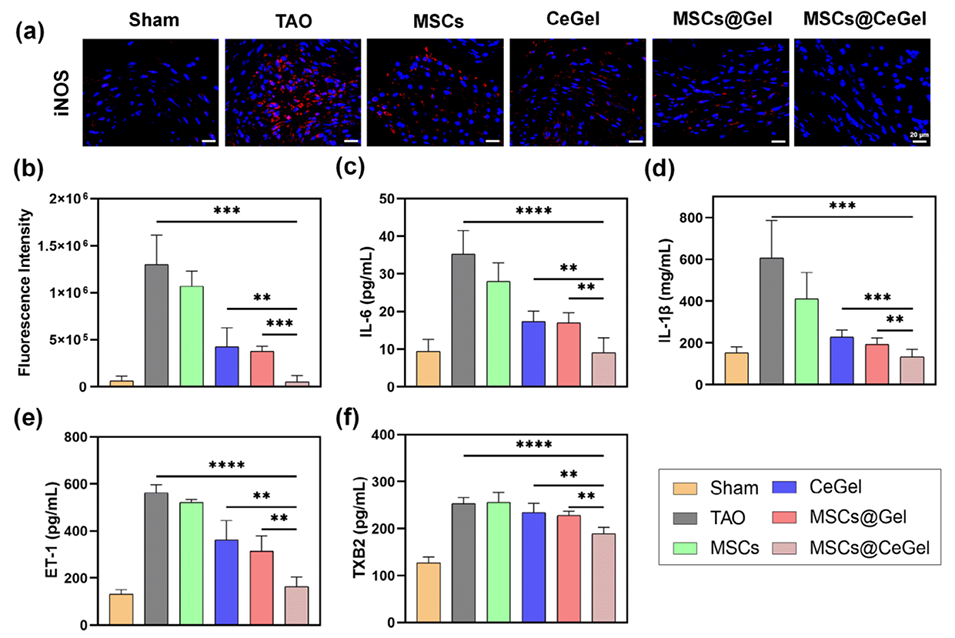
图8.MSCs@CeGel在TAO损伤模型中的治疗机制分析。a,b)大鼠股动脉iNOS的免疫荧光染色。比例尺:20μm。c,d)TAO大鼠血清中IL-6和IL-1水平。e,f)TAO大鼠血浆中ET-1和TXB2水平。这些数据以平均值±标准差表示,n=5。
论文链接:https://doi.org/10.1002/smll.202408748














