单细胞封装因其在细胞分析和治疗方面的潜在应用而成为生物医学中一个有前景的领域。传统技术包括将细胞嵌入交联聚合物中以产生连续的微凝胶,主要适用于贴壁细胞,或者由于其不稳定性,将它们封装在液滴中仅用于短期分析。

近期,有研究人员开发了一种基于双水相系统的单细胞液芯微胶囊技术,通过海藻酸与ε-聚赖氨酸的静电相互作用形成半透膜结构,结合压力驱动与电流体动力雾化工艺优化微胶囊尺寸(<100 μm),并利用磁性纳米颗粒分选系统将单细胞纯度提升至80%。相关研究以“Single-Cell Liquid-Core Microcapsules for Biomedical Applications”为题目发表于期刊《Advanced Healthcare Materials》。该技术成功验证了悬浮细胞和贴壁细胞的长期活力及表型稳定性,为单细胞分析、实时监测和精准细胞治疗提供了高效平台。
本文要点:
1、本研究基于双水相系统(ATPS),通过带相反电荷的聚合物(海藻酸与ε-聚赖氨酸)静电作用,在纯水环境中形成液芯微胶囊。
2、使用压力驱动装置(PDD)和电流体动力雾化(EHDA)技术,可制备直径小于100 μm的微胶囊,并验证其机械稳定性与半透膜特性(膜厚约3.43 μm)。
3、通过优化细胞浓度(20万个细胞/mL),通过上述两种方法制备的单细胞微胶囊占比达25%-27%。
4、此外,开发了基于磁性纳米颗粒(MNPs)的低成本分选系统,将单细胞微胶囊的纯度提升至80%。
5、实验表明,微胶囊对悬浮细胞(THP-1)和贴壁细胞(脐带间充质干细胞)均无毒性,细胞活力、代谢活性及表型(如干细胞标志物CD90/CD73)保持稳定。
6、该技术为单细胞分析、实时监测及细胞治疗提供了新平台,其半透膜特性既能保护细胞,又能确保治疗因子的有效扩散,为精准医疗和疾病机制研究奠定了基础。
为何选择双水相系统(ATPS)结合静电作用生成微胶囊?相比传统液滴或微凝胶技术有何独特优势?
传统液滴技术依赖油相作为分散介质,存在稳定性差(易蒸发或融合)和生物相容性风险(油相残留需复杂清洗),而微凝胶虽稳定但阻碍悬浮细胞的原生环境研究。本文采用ATPS结合静电作用(海藻酸与ε-聚赖氨酸)的优势在于:
1、全水相环境:避免有机溶剂,简化后处理步骤,提升生物安全性。
2、半透膜特性:通过静电交联形成厚度均匀(约3.43 μm)的膜结构,支持营养交换,同时保护细胞。
3、可调机械性能:通过聚合物浓度调控膜弹性,适配不同应用场景。
4、兼容悬浮/贴壁细胞:液态核心模拟细胞原生微环境,避免微凝胶对悬浮细胞的物理限制(如黏附依赖性信号丢失)。
PDD和EHDA的液滴生成机制差异显著影响微胶囊直径的调控,具体如下:
PDD(压力驱动):通过气压直接剪切液流形成液滴,直径主要受气压大小和针头几何参数控制。高压(如1250 mBar)增强剪切力,生成更小液滴(26.78 μm),但低压(300–500 mBar)下直径稳定(约85 μm)。其尺寸分布较窄(标准差±14–22 μm),因机械剪切作用均匀。
EHDA(电场驱动):依赖电场诱导液流形成泰勒锥并破碎,直径受电场强度、流速和针头内径共同影响。细针头(30G)与低流速(1 mL/h)组合下,液滴尺寸显著减小(101.66 μm),但分布更广(±32.54 μm),因电场波动和环境干扰(如温湿度)导致液流不稳定。
综上,PDD适合稳定生产中等尺寸微胶囊,而EHDA在精细调控小尺寸(<100 μm)时更具潜力,但需优化环境控制。
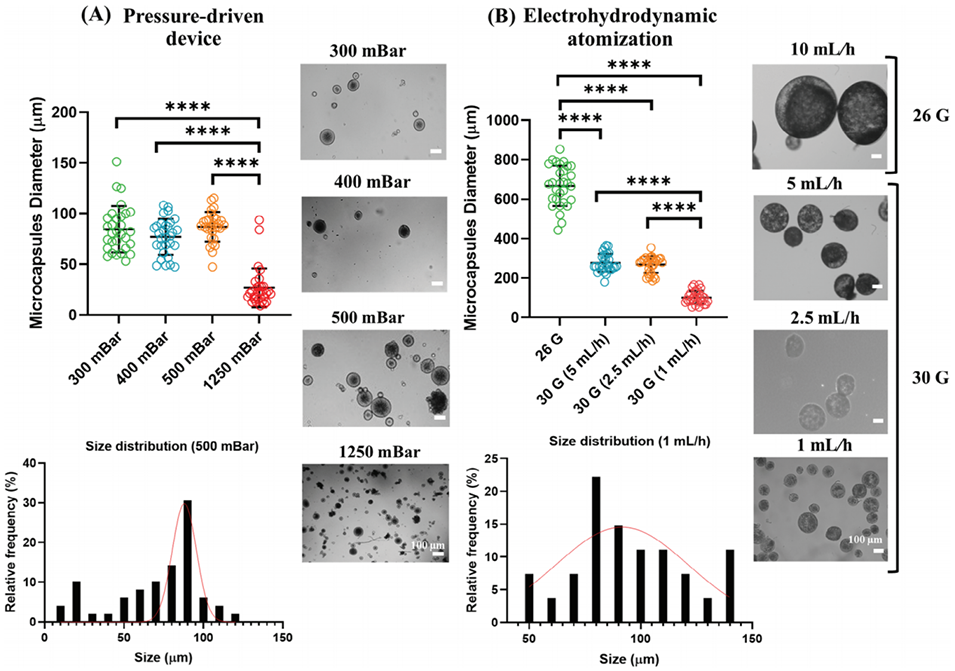
图1.气压、流速和针规(G)对微胶囊直径的影响。
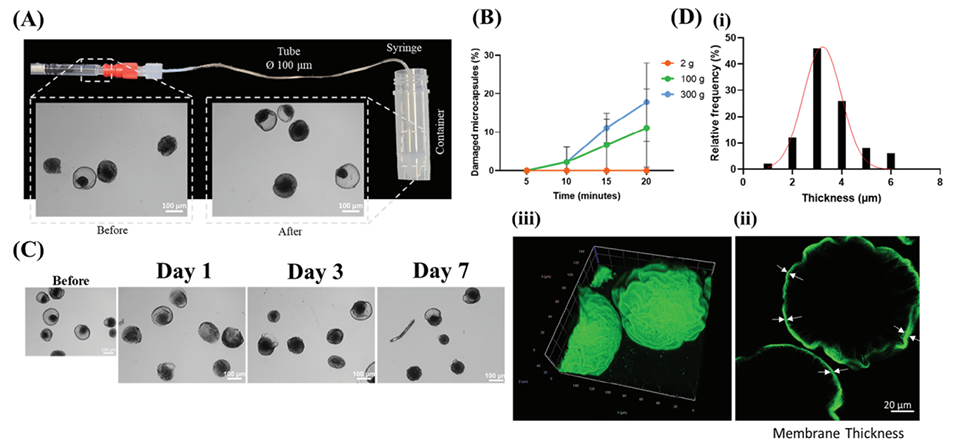
图2.微胶囊表征和稳定性评估。
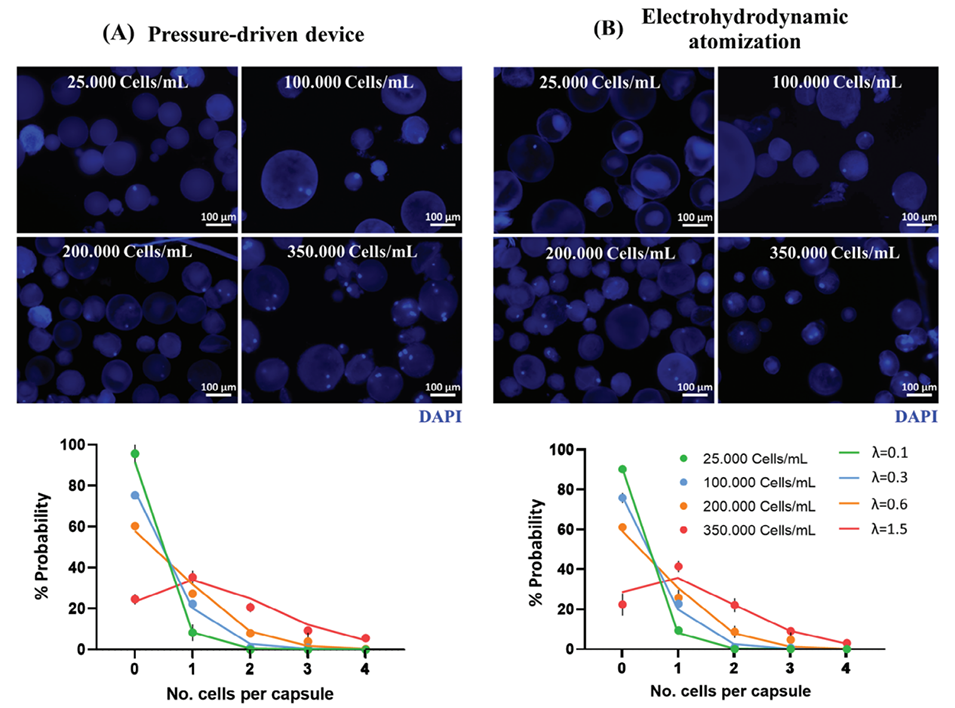
图3.通过(A)压力驱动装置(PDD)(n=100)和(B)电流体动力学雾化(EHDA)设备(n=100)生成单细胞微胶囊的细胞浓度优化。单细胞微胶囊的代表性荧光图像,其中细胞核用DAPI染色,以及不同细胞浓度(点)的实验分布图与对应泊松分布(线)的比较,使用公式(1)计算不同λ值。
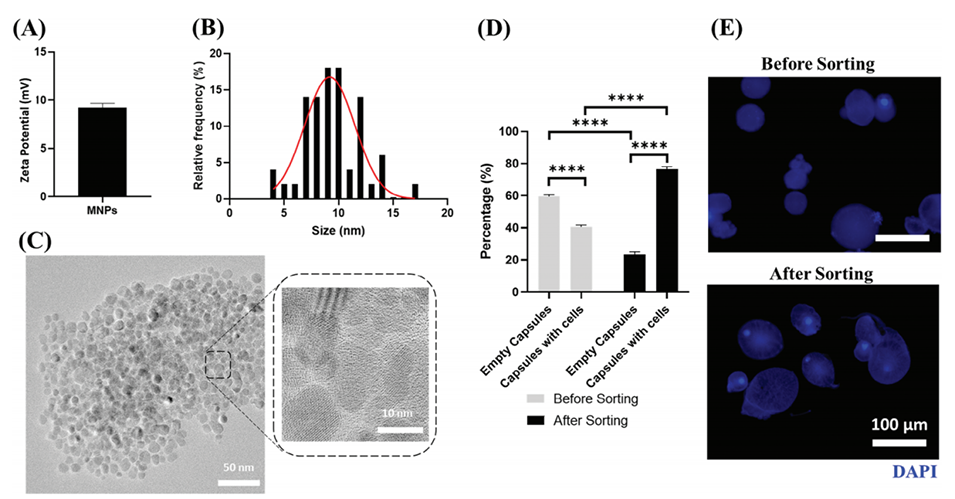
图4.使用MNPs对单细胞液芯微胶囊进行分选。
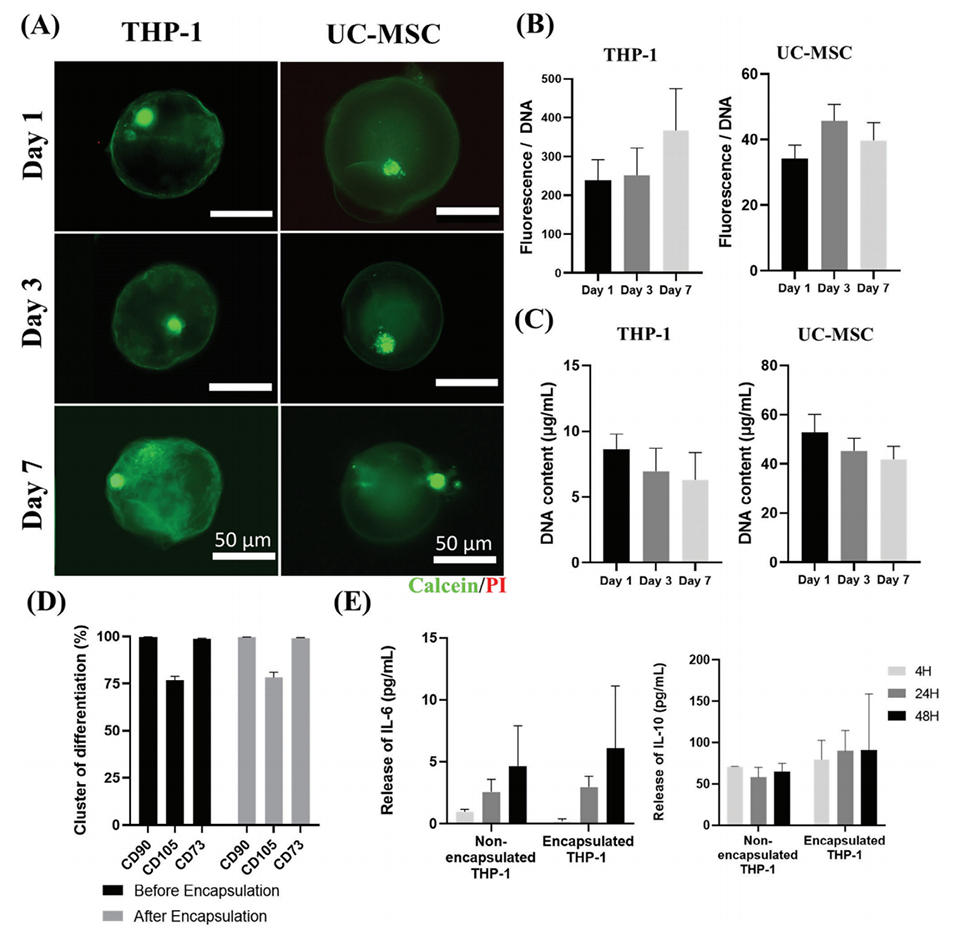
图5.微胶囊的细胞相容性评估。
论文链接:https://doi.org/10.1002/adhm.202403808














