导读:
近期,四川大学化学化工学院李赛教授和生物医学工程学院蒲雨吉副研究员等人通过在两亲性聚氨酯微球表面修饰表儿茶素没食子酸酯(EGCG)-银纳米颗粒和海藻酸钙交联壳层,开发出一种兼具快速止血、抗菌和抗炎功能的复合微球材料。体外实验表明,该材料的全血凝血时间较对照组缩短了50%(从685秒降至328.7秒)。在三种大鼠创伤模型中,该材料不仅显著减少了失血量,还有效缩短了止血时间。此外,EGCG-银纳米颗粒赋予了微球强大的抗菌能力,能够有效抑制细菌增殖,减少炎症反应,并加速感染伤口的愈合。相关研究以“Biodegradable Polymeric Microspheres with Enhanced Hemostatic and Antibacterial Properties for Wound Healing”为题,发表在《Biomacromolecules》期刊上。
本文要点:
1、本研究开发了一种两亲性可生物降解聚酯基分段聚氨酯(SPU)微球,通过表面修饰表没食子儿茶素没食子酸酯(EGCG)-银纳米颗粒和海藻酸钙交联壳层,实现多阶段协同止血及抗菌功能。
2、EGCG的负电荷与Ca2+促凝血特性结合,显著缩短体外凝血时间(SPU@EAg@CaAlg组为328.7秒,较原始SPU微球缩短50%)。
3、在三种大鼠止血模型中(断尾、股动脉损伤、肝损伤),该微球均显著减少止血时间和失血量。
4、EGCG-Ag纳米颗粒赋予微球强效抗菌与抗炎性能,体外实验显示对金黄色葡萄球菌和大肠杆菌的抑制率超过85%。
5、体内感染伤口模型表明,该微球可有效清除细菌并降低促炎因子(TNF-α、IL-6)水平,加速胶原沉积和血管生成,促进伤口愈合。细胞实验验证其良好生物相容性。
6、研究证明,SPU@EAg@CaAlg微球兼具快速止血、抗菌抗炎及促愈合功能,为临床创伤处理提供了高效解决方案。
EGCG-银纳米颗粒和海藻酸钙交联壳对微球性能有哪些具体影响?
EGCG-Ag纳米颗粒的贡献:
抗菌核心:Ag纳米颗粒通过接触杀灭与离子释放机制实现长效抗菌(12小时抑菌率>93%),且EGCG的酚羟基稳定Ag颗粒,减少Ag+爆发释放(SPU@EAg@CaAlg的Ag+释放量较SPU@EAg降低30%)。
促凝与抗炎:EGCG的负电荷激活内源性凝血因子XII,缩短aPTT时间(从对照组120秒降至80秒),同时通过清除自由基抑制氧化应激损伤。
海藻酸钙交联壳的关键作用:
结构稳定性:Ca2+与海藻酸钠羧基形成的离子交联网络(FT-IR显示C-O/C-N键增强),赋予微球湿润环境下的抗溶胀性(吸水率14.7倍),保持多孔结构完整。
功能协同与降解调控:
Ca2+缓释:初期快速释放激活凝血,后期缓慢释放维持促凝活性(肝损伤模型止血时间7秒 vs. 对照组240秒)。
降解屏障:交联壳延缓SPU核心水解(7周后剩余26.8%未降解),避免乳酸快速释放导致的局部pH下降(对照组pH降至5.2,SPU@EAg@CaAlg维持6.5)。
这种微球在临床应用中有哪些潜在优势?
1、功能集成性:传统敷料(如纱布、明胶海绵)仅具备物理止血或单一抗菌功能,而该微球通过“止血-抗菌-促愈”三合一设计,在感染性创面模型中愈合效率提升40%(对照需18天,微球组11天)。
2、生物相容性:壳层修饰使溶血率<4%(传统银敷料常>20%),且降解产物pH稳定(PLA/PCL水解后pH 6.8-7.2),避免局部组织酸中毒。
3、操作适应性:微球粒径100-200 μm(可通过内镜喷洒),适用于微创手术中的不可压迫性出血(如肝脾破裂),而传统粉末易飞散,海绵需加压贴合。
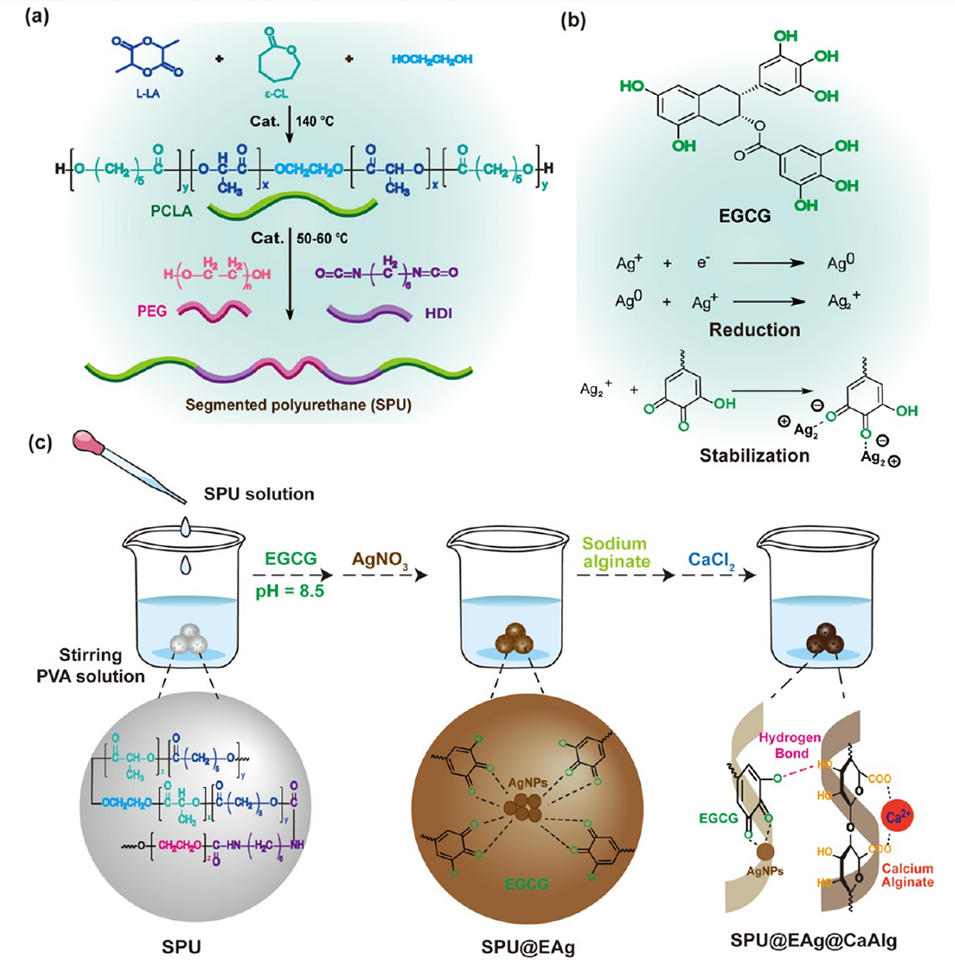
Scheme 1.SPU@EAg@CaAlg微球的制备示意图。
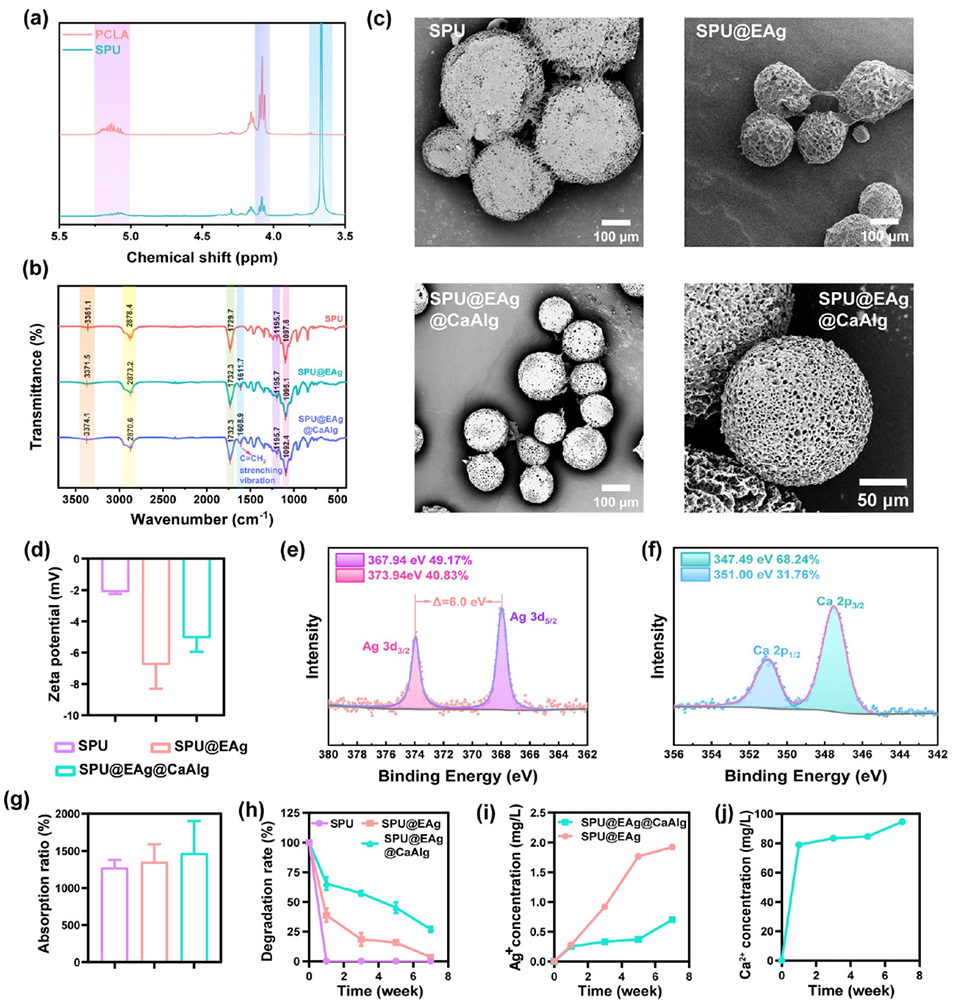
图1.SPU微球的表征。
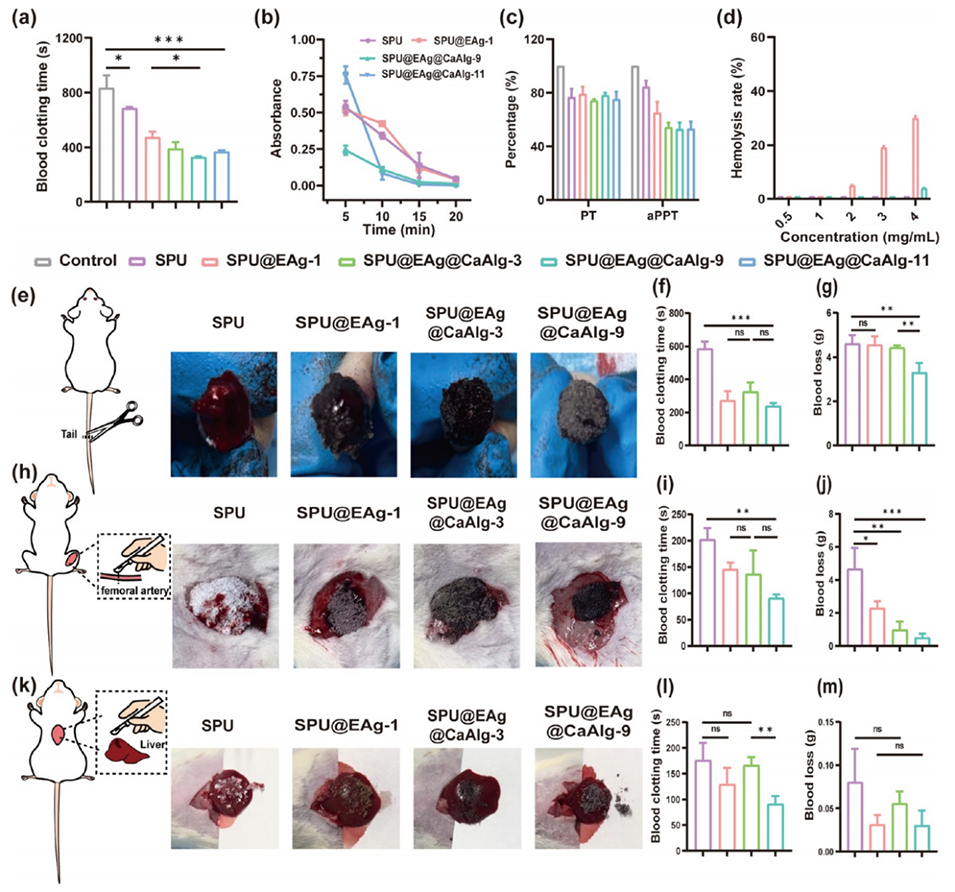
图2.SPU微球的止血性能。
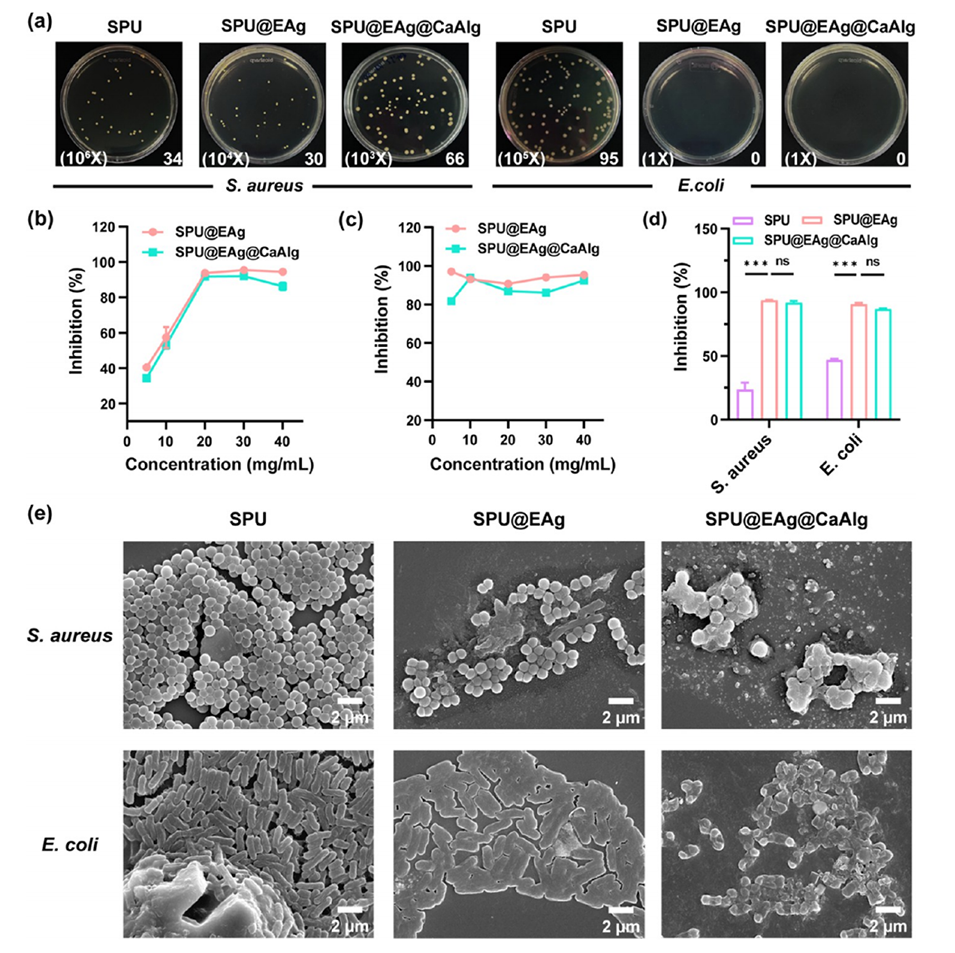
图3.SPU微球的体外抗菌作用。
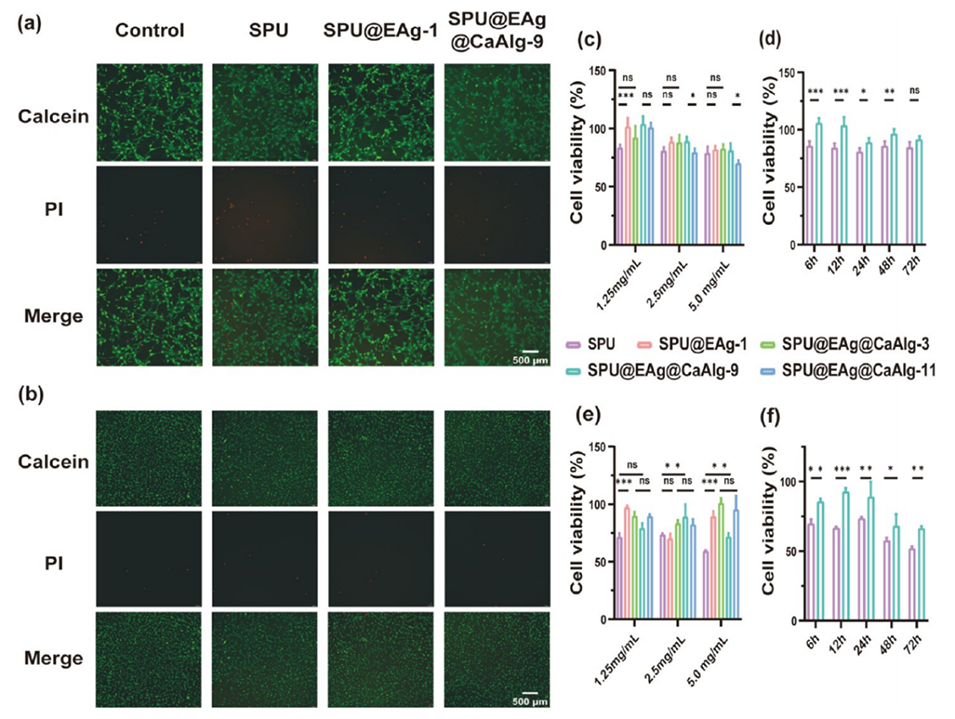
图4.SPU微球的细胞活力。
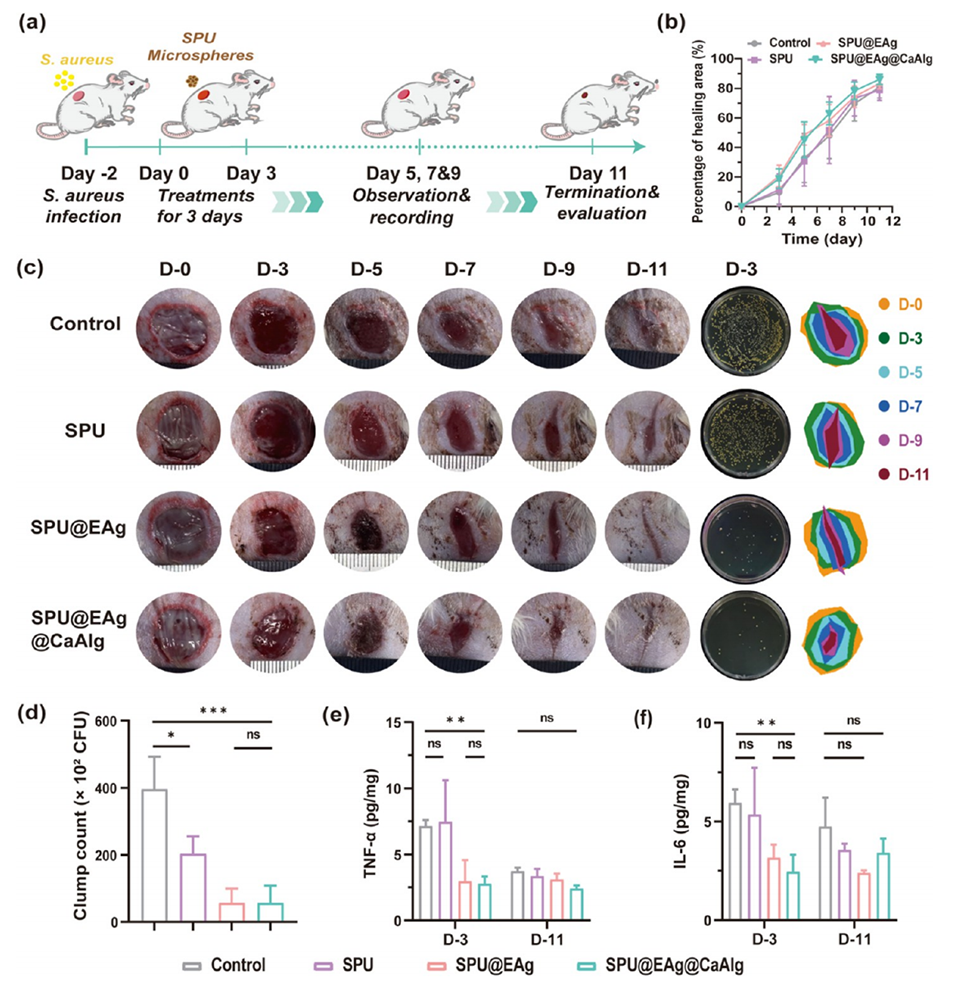
图5.SPU微球的伤口愈合试验。
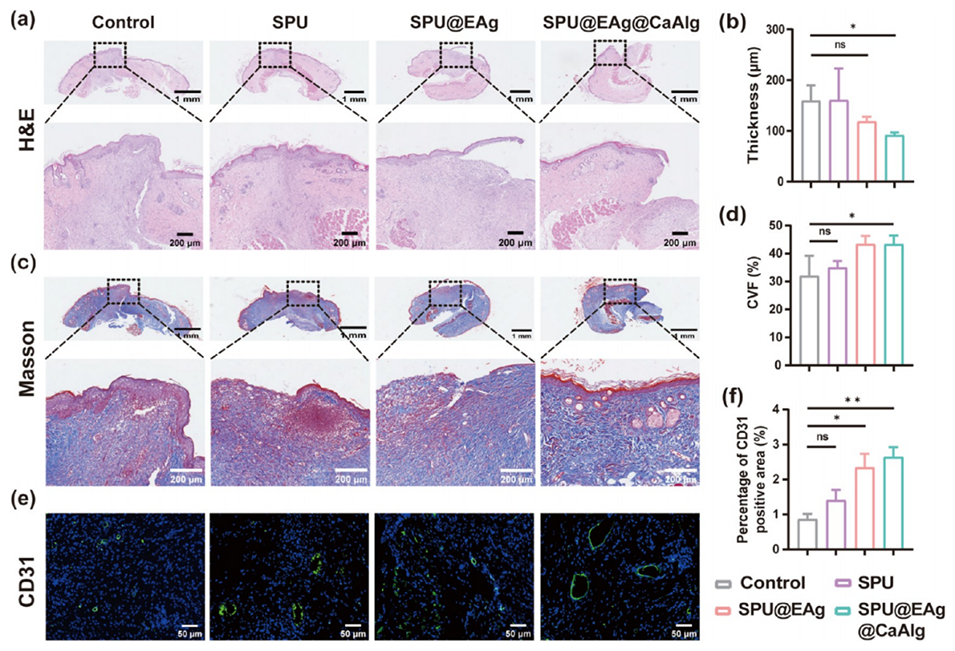
图6.第11天各组感染伤口的组织学分析。
论文链接:https://doi.org/10.1021/acs.biomac.4c01545