随着纳米医学在靶向药物递送领域的快速发展,纳米颗粒(NP)的制备技术显得尤为重要。传统的脂质体作为纳米药物载体,虽然具有较好的生物相容性和药物封装能力,但在体内面临快速清除、组织特异性有限以及目标部位积累不足等挑战。为了克服这些限制,仿生纳米颗粒(BNPs)应运而生。BNPs通过将生物成分(如膜蛋白或整个细胞膜)整合到合成脂质双层中,模拟自然细胞的表面特性,从而增强靶向特异性、延长系统循环时间并提高免疫逃逸能力。然而,不同制备方法对BNPs的结构和功能有显著影响,目前学界仍缺乏针对这些方法的系统性对比分析。

近期,有研究人员以神经元衍生的BNPs为模型,系统对比了湍流射流混合、微流控混合和挤出三种主流制备方法的性能差异。结果发现湍流射流混合和微流控混合制备的BNPs在稳定性、膜蛋白整合效率、批次重现性及细胞靶向性上显著优于挤出法,为纳米靶向药物的工艺优化与规模化开发提供了关键参考。相关研究以“Engineering Biomimetic Nanoparticle Performance Through Fabrication Method Selection: Turbulent Jet Mixing, Microfluidics, and Extrusion”为题,发表在期刊《Small Methods》上。
本文要点:
1、该研究聚焦仿生纳米颗粒(BNPs)的制备方法优化,以神经元来源的BNPs为模型,系统对比了湍流射流混合、微流控混合和挤出三种制备方法的性能。
2、研究发现,湍流射流混合和微流控混合(均为自下而上法)表现更优,能产出稳定性强、膜蛋白整合率高、批次重复性好且靶向性佳的BNPs;而挤出法(自上而下法)因剪切力导致蛋白流失,在各项关键指标上表现不佳。
3、通过高分辨率LC-MS/MS蛋白质组学分析,首次量化了不同方法制备的BNPs膜相关蛋白谱差异。此外,三种方法均能有效封装阿霉素并实现可控释放,但前两种方法制备的BNPs在与SH-SY5Y神经母细胞瘤细胞的同源结合中更具优势。
4、研究结果明确了制备技术对BNPs结构和功能的关键影响,为优化BNPs生产策略提供了切实可行的参考依据,有望推动纳米靶向药物的规模化开发。
仿生纳米颗粒三大主流制备方法对比
特性 | 湍流射流混合 | 微流控混合 | 挤出法 |
单次处理体积 | 200 微升–100 毫升 | 1 毫升–60 毫升 | 1 毫升–10 毫升 |
(2 毫升制剂)废液体积 | 450 微升 | 500 微升 | 750–1000 微升 |
设备复用性 | 可多次使用的混合器 | 一次性微流控芯片 | 可重复使用的挤出过滤器系统 |
材料兼容性 | 广泛兼容多种溶剂 | 溶剂兼容性有限 | 广泛兼容多种溶剂 |
(1 毫升制剂)制备时间 | 约 1 分钟 | 约 1 分钟 | 约 10–45 分钟 |
温度控制 | 不具备 | 具备 | 具备 |
蛋白整合效果 | 与蛋白原料水平相当 | 与蛋白原料水平相当 | 因剪切力和压力导致蛋白负载量低 |
成本 | 中等,需专用设备 | 较高,需专用设备及一次性芯片 | 较低,使用标准实验室设备 |
易用性 | 中等,需培训 | 中等,需操作芯片及培训 | 中等,操作简便但需培训 |
对蛋白/脂质的适配性 | 高,兼容性广泛 | 中等,对溶剂类型敏感 | 有限,对蛋白完整性敏感 |
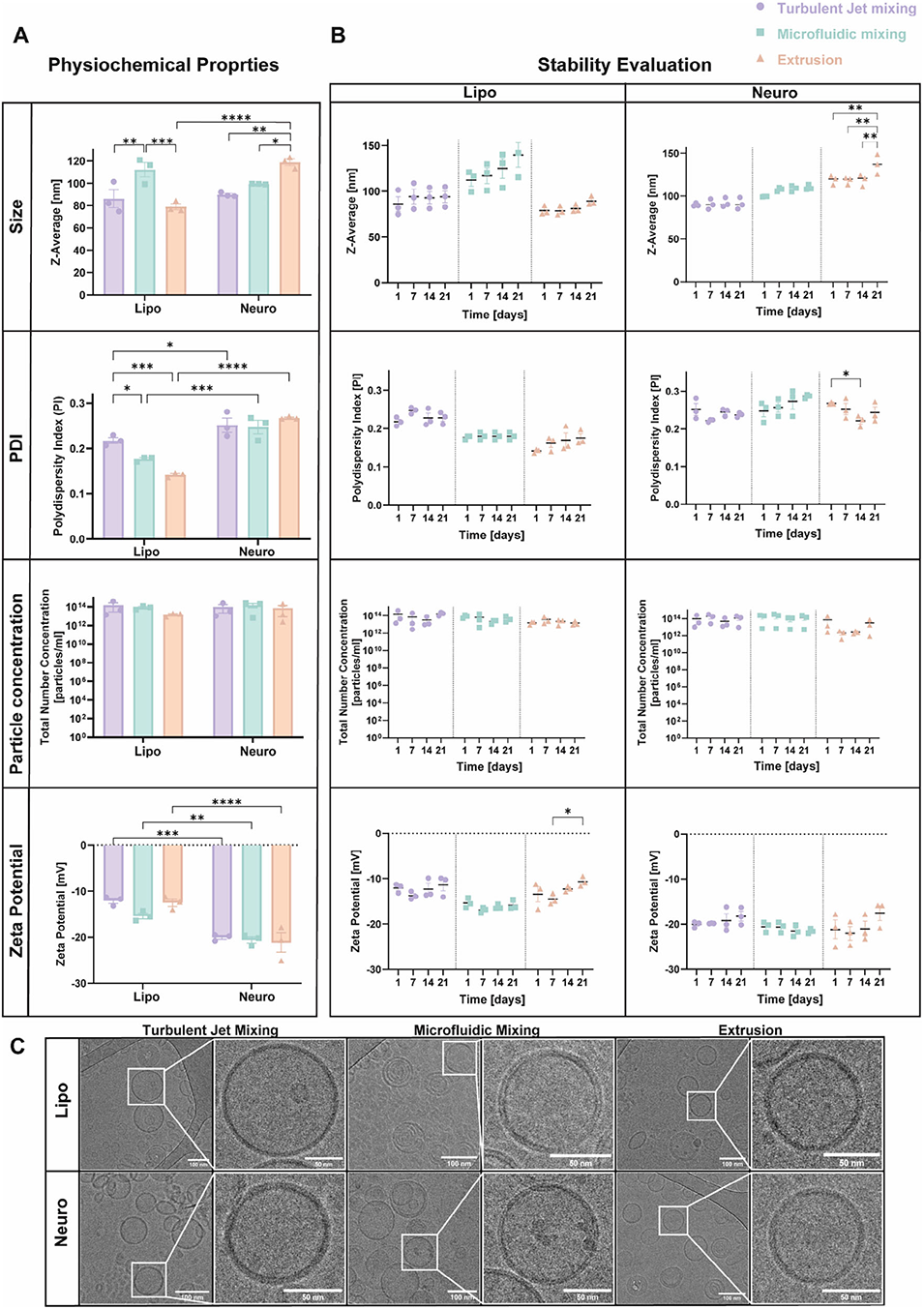
图1 神经小体制剂的理化性质与稳定性
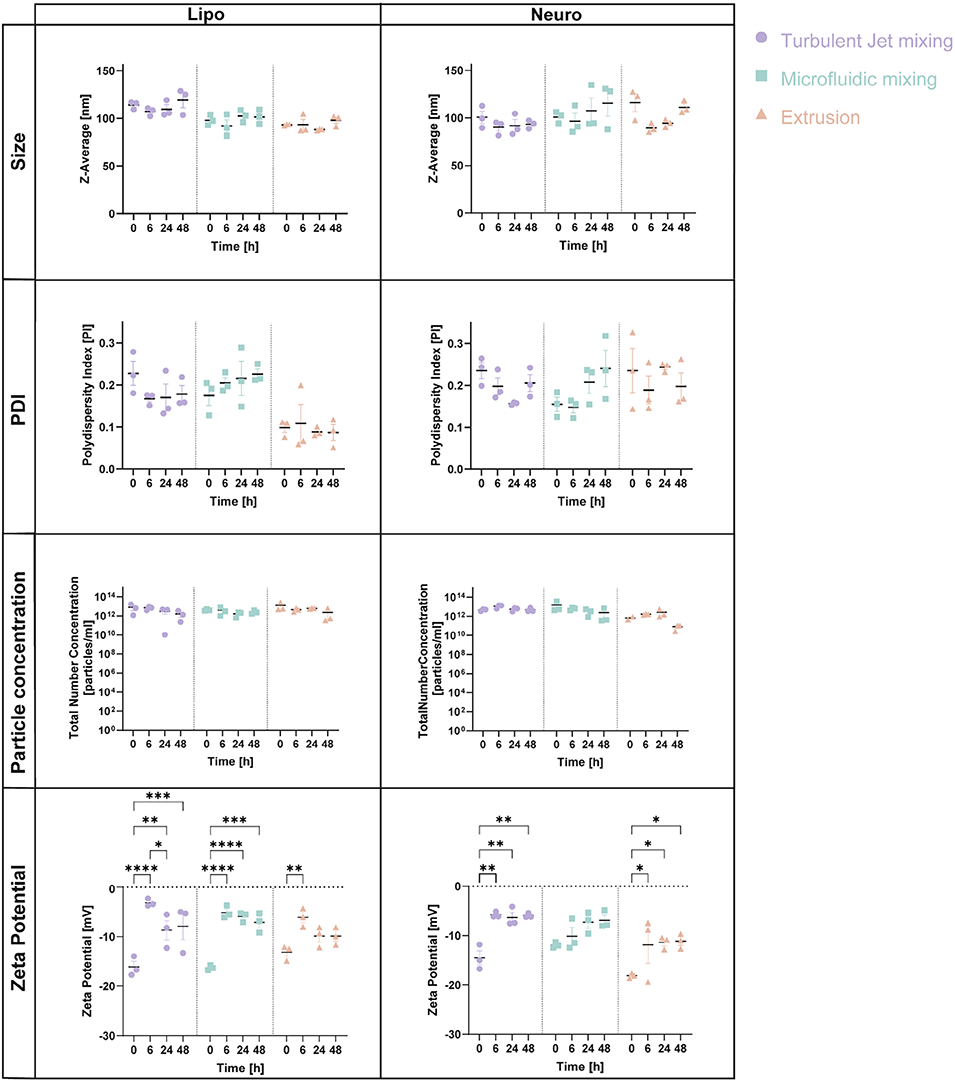
图2 BNPs在生理条件下的稳定性
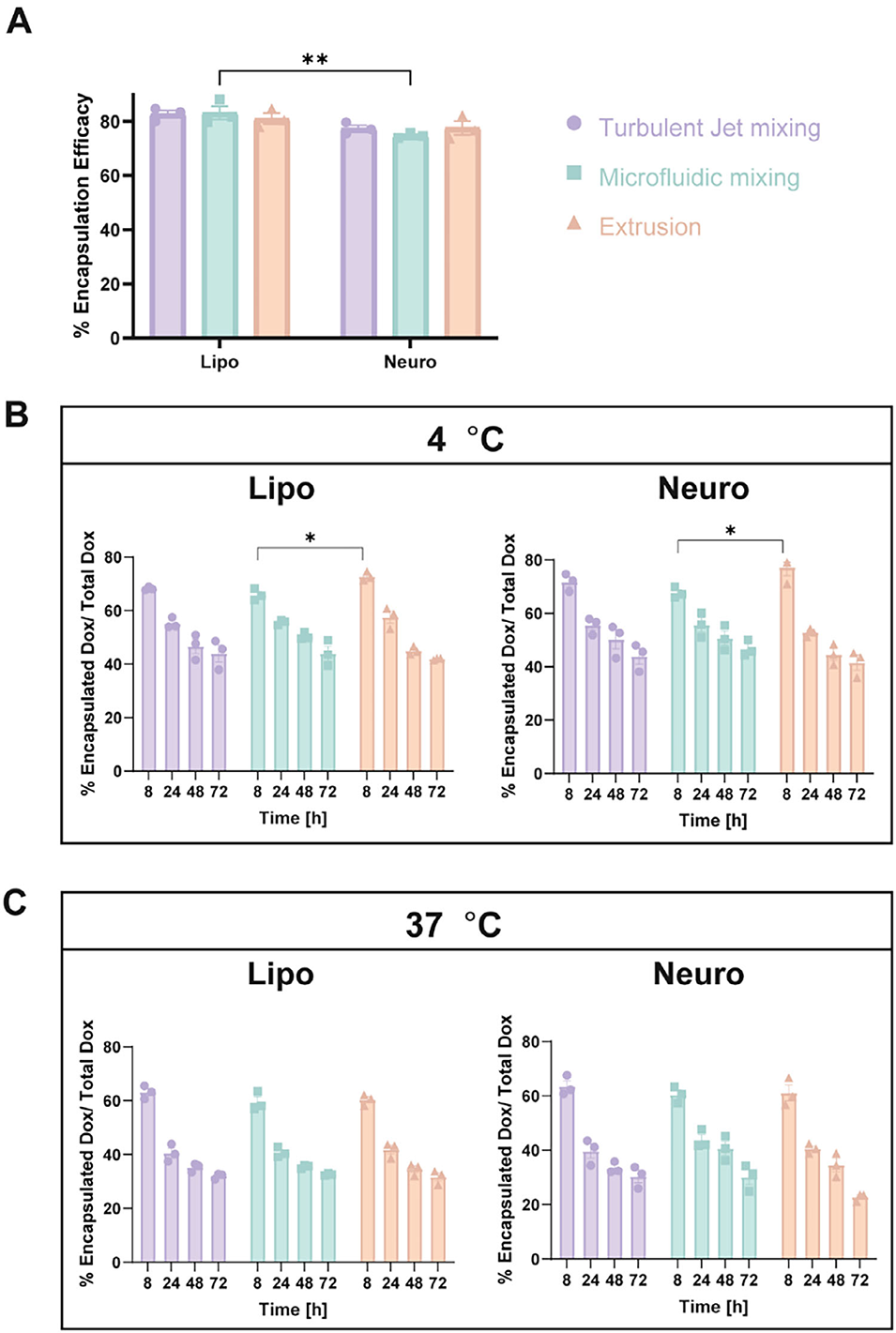
图3 BNPs的阿霉素包封效率与释放行为
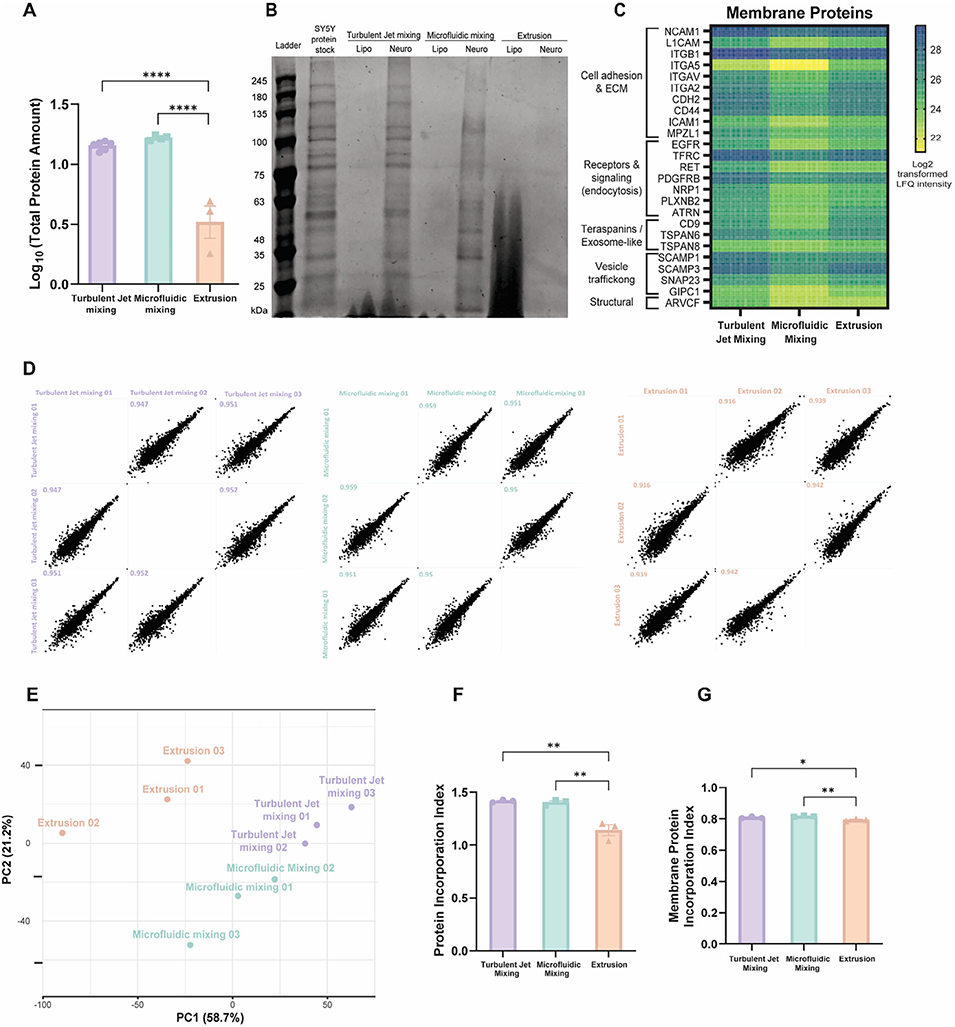
图4 不同方法制备的BNPs的蛋白含量与重现性
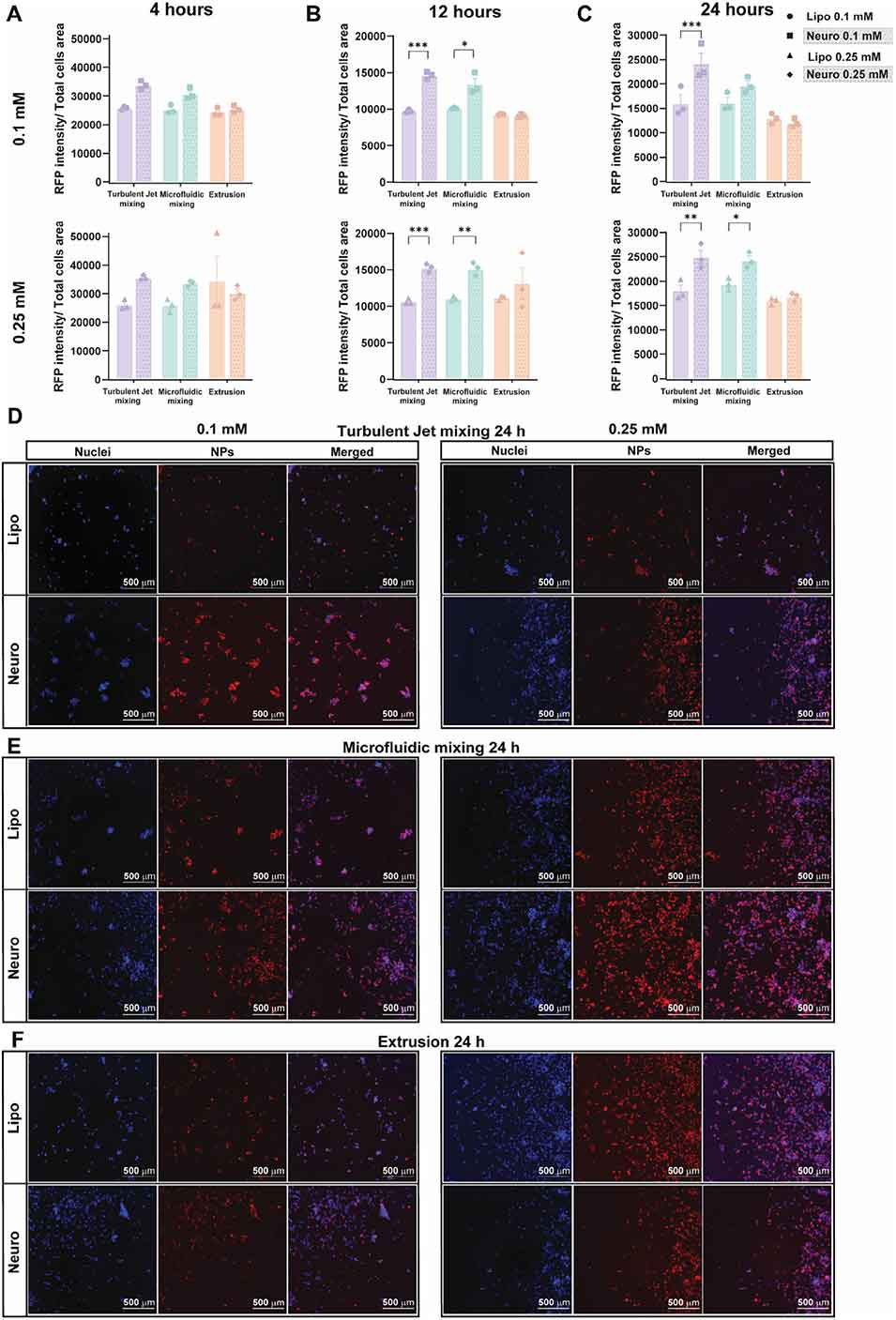
图5 神经小体与SH-SY5Y人神经母细胞瘤细胞的结合作用
论文链接:https://doi.org/10.1002/smtd.202501770
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














