I型胶原蛋白作为细胞外基质(ECM)的主要结构蛋白,为细胞提供机械支持和生化信号,引导细胞粘附、增殖和组织构建。然而,将天然胶原蛋白转化为可重复且可扩展的三维结构材料面临挑战,因为其自组装过程对温度、pH值和加工条件高度敏感,传统方法制备的胶原蛋白材料常常存在架构不均一和生物学性能不稳定的问题。尽管已有多种平台实现了高通量胶原蛋白微凝胶的制备,但大多依赖于化学修饰或严格的工艺参数,牺牲了天然胶原蛋白的结构或生物多样性。

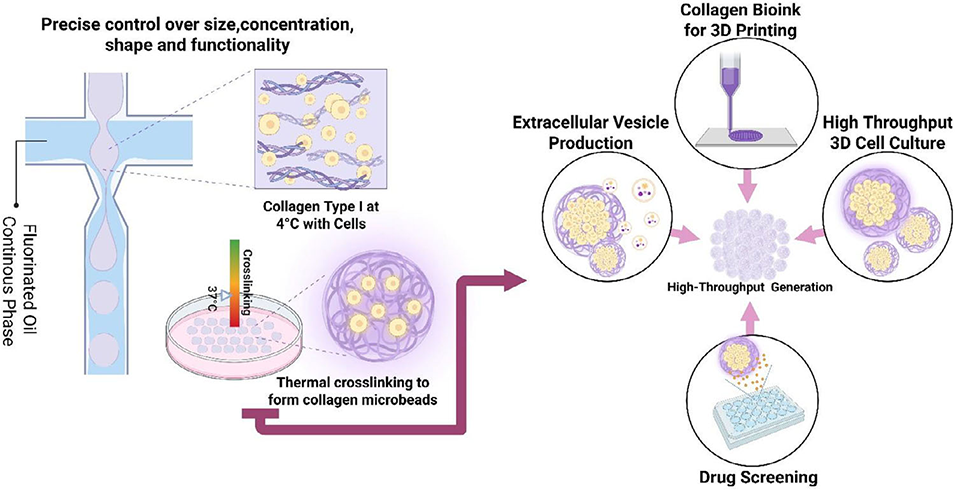
鉴于此,美国佛罗里达大学何梅副教授团队提出了一种压力可调的液滴微流控平台,通过精准调控胶原蛋白浓度与热自组装过程,实现了天然未修饰I型胶原蛋白微珠的高通量制备。该平台突破了传统技术的局限,所制备的微珠在尺寸、纤维结构和机械性能上具有高度可调性,且保留了胶原蛋白的天然三螺旋结构。这些微珠可作为模块化构建单元,无缝整合到3D生物打印、高通量细胞培养、药物筛选及 EV 生产等多个下游场景,为下一代生物制造技术提供了多功能解决方案,有望推动胶原蛋白基材料在生物医学领域的广泛应用。相关研究以“High‐Throughput Generation of Collagen Microbeads for Extracellular Vesicle Production and Therapeutic Delivery”为题目,发表在期刊《Advanced Materials Technologies》上。
本文要点:
1、本研究开发了一种压力可调的微流控平台,实现了高吞吐量生成未修饰的I型胶原蛋白微珠,解决了传统胶原蛋白3D材料制备中存在的规模化、可重复性及生物活性保留等难题。
2、该平台通过调节胶原蛋白浓度(0.25-3 mg/mL)和热自组装过程,可制备尺寸(45-1000 µm)、纤维结构及机械性能(刚度0.6-2.8 kPa)可控的单分散微珠,生成速率超10,000个/分钟,且能保留胶原蛋白天然三螺旋结构。
3、这些胶原蛋白微珠具有多种功能:作为模块化构建单元,可融入海藻酸盐-明胶生物墨水,提升流变稳定性、剪切变稀特性和3D打印保真度,支持细胞21天内增殖13倍;作为独立微生物反应器,可实现多细胞球体形成及持续的细胞外囊泡(EV)分泌与无损收集;还可用于高通量3D细胞培养和药物筛选,如对乳腺癌细胞进行PROTAC药物测试,成功降解目标蛋白HDAC3和HDAC8。
4、该技术整合了可调节性、高吞吐量和功能扩展性,为组织建模、药物测试及治疗性EV生物制造等领域提供了多功能平台,但目前仍局限于实验室规模,需优化以符合GMP标准;未来需开展与其他3D培养系统的对比研究,并探索其体内应用潜力。
该微流控平台在制备胶原微珠方面的核心创新在于开发了一种压力可调、无需化学修饰的微流控系统,能在保持胶原天然三螺旋结构的前提下,实现高通量(>10,000个/分钟)、单分散(45–1000μm)且微结构与力学性能高度可控的胶原微珠制备。
相比现有技术的优势包括:
天然结构保留:仅通过热自组装交联,避免化学修饰或交联剂对胶原生物活性的破坏。
高度可调性:通过调节胶原浓度(25–3mg/mL)与油相压力,可精确控制微珠尺寸、孔隙结构、纤维密度及刚度(0.6–2.8 kPa)。
高通量与一致性:采用多通道微流控芯片,生产速率远超传统批量乳化法,且粒径分布更均匀。
多功能整合:微珠可作为模块化单元直接用于3D细胞封装、生物打印增强、EV生产与药物筛选,实现“一平台多用途”。
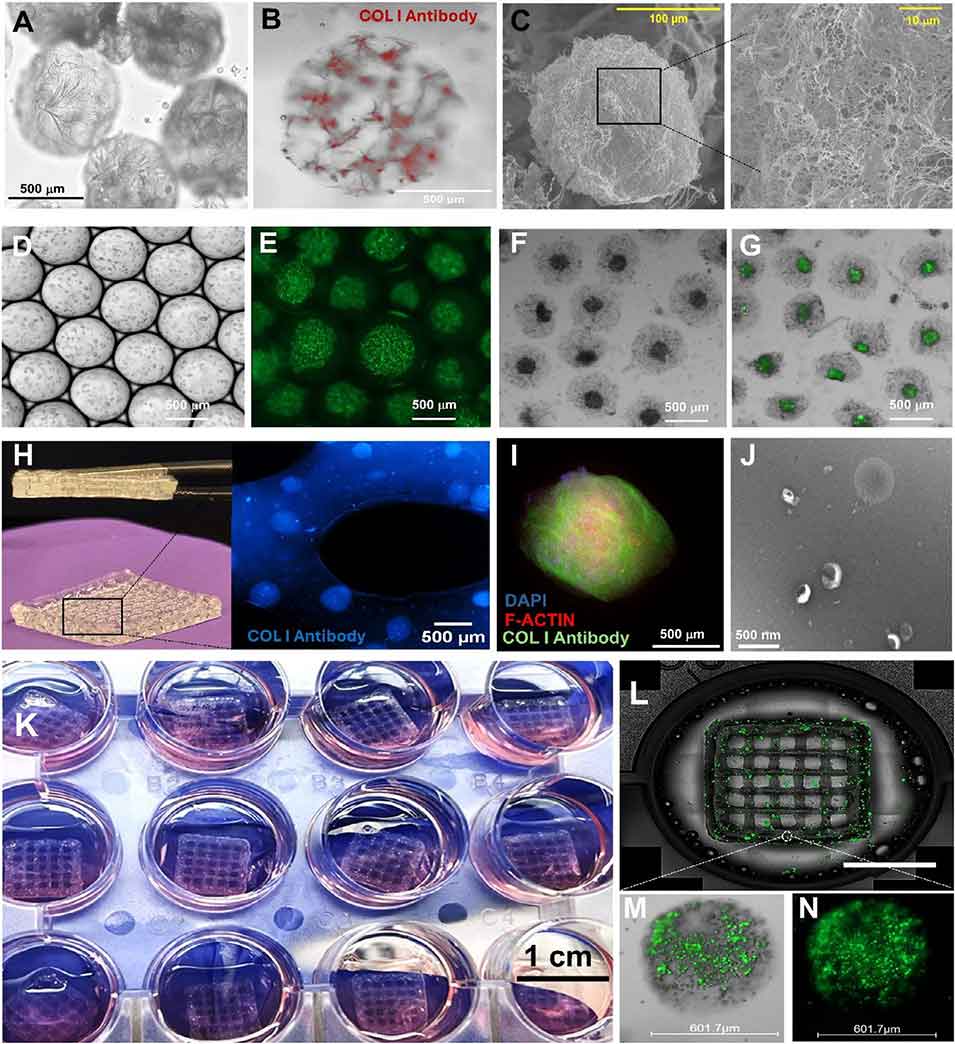
图1 胶原蛋白微珠的高通量制备及其多样化下游应用
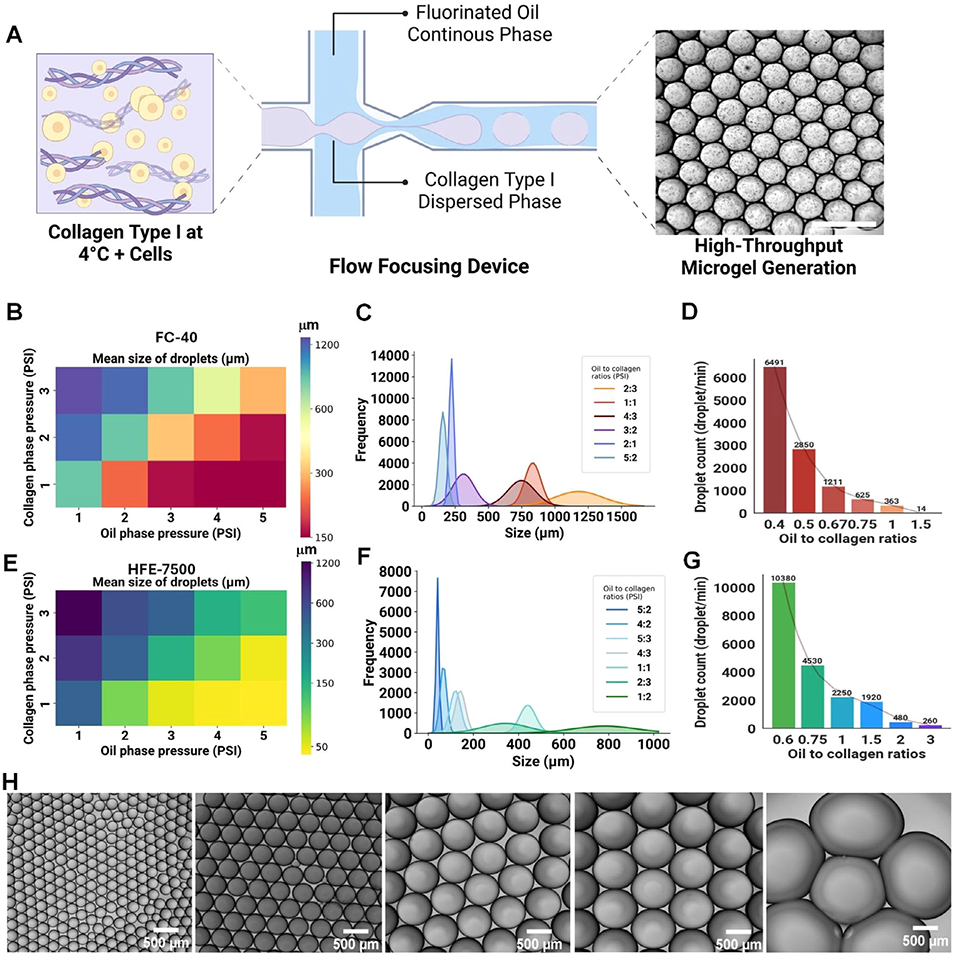
图2 微流控生成单分散I型胶原蛋白微珠
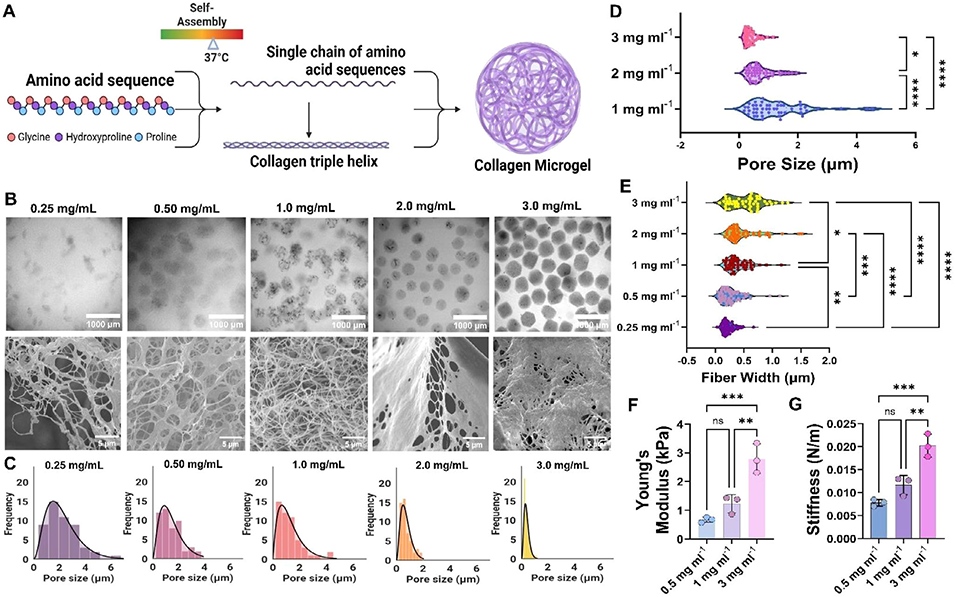
图3 胶原蛋白微珠的热自组装与微观结构调控
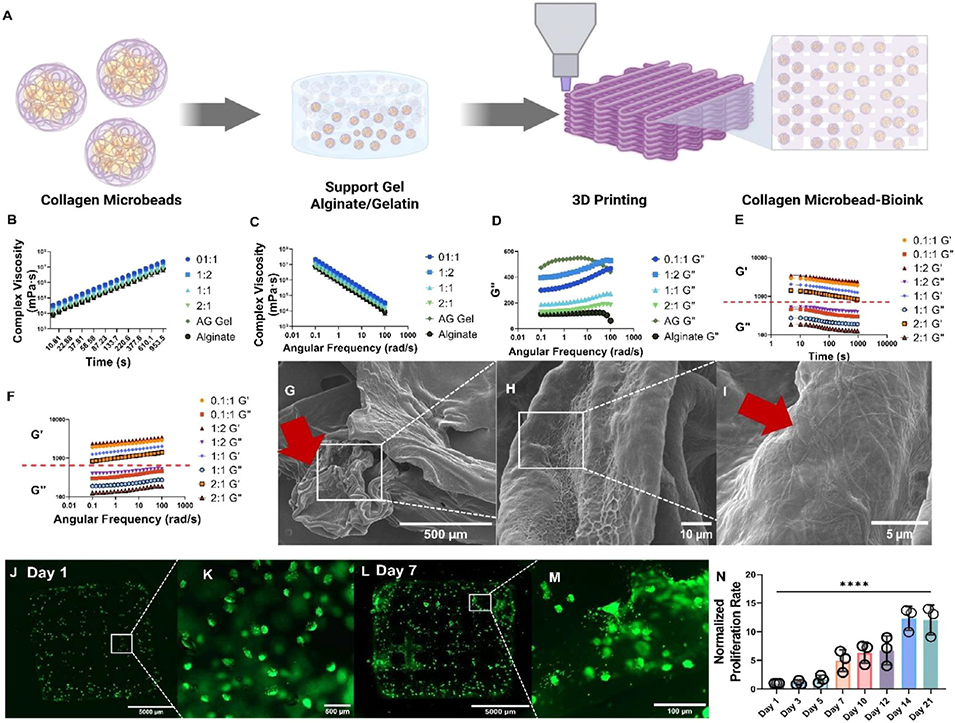
图4 用于3D生物打印的胶原蛋白微珠整合生物墨水的流变学调控与生物相容性
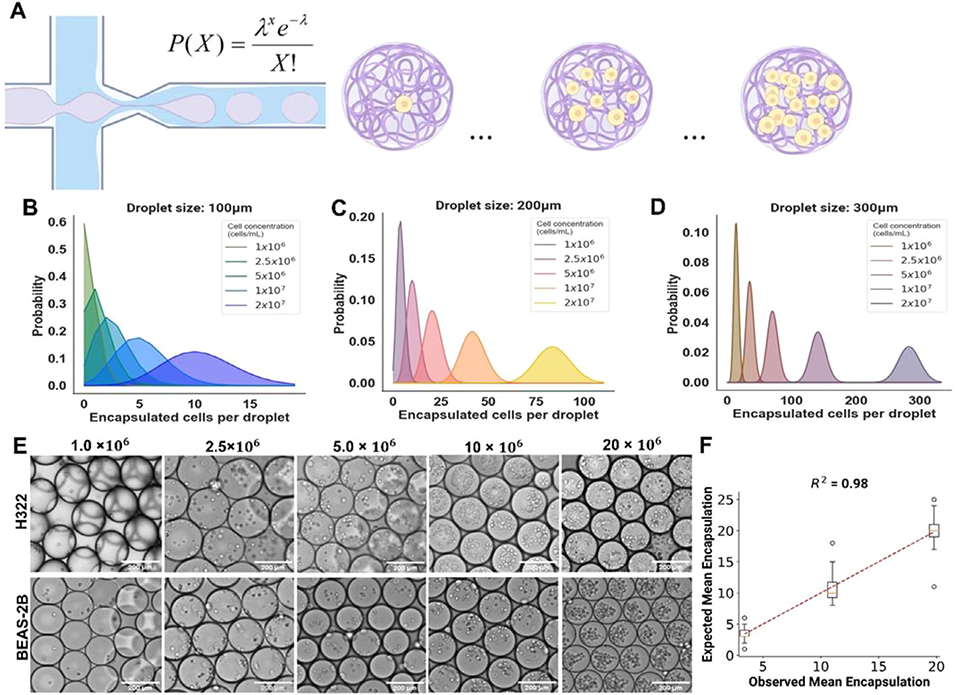
图5 胶原蛋白微珠的高精度细胞封装
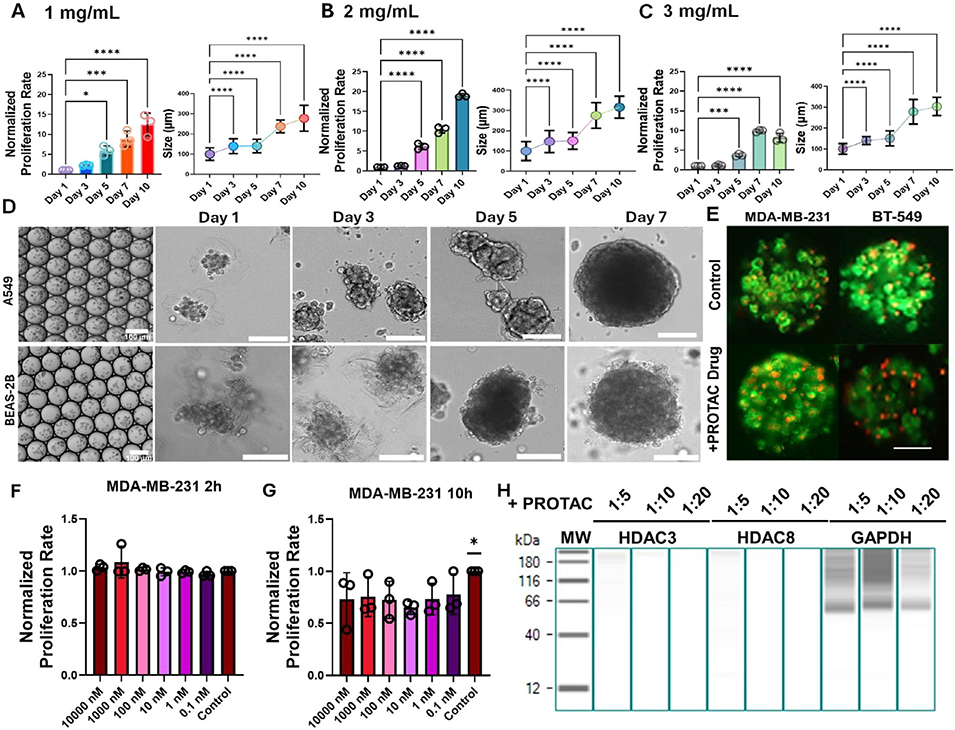
图6 基于胶原蛋白3D微生物反应器的细胞增殖、类球体生长及药物测试
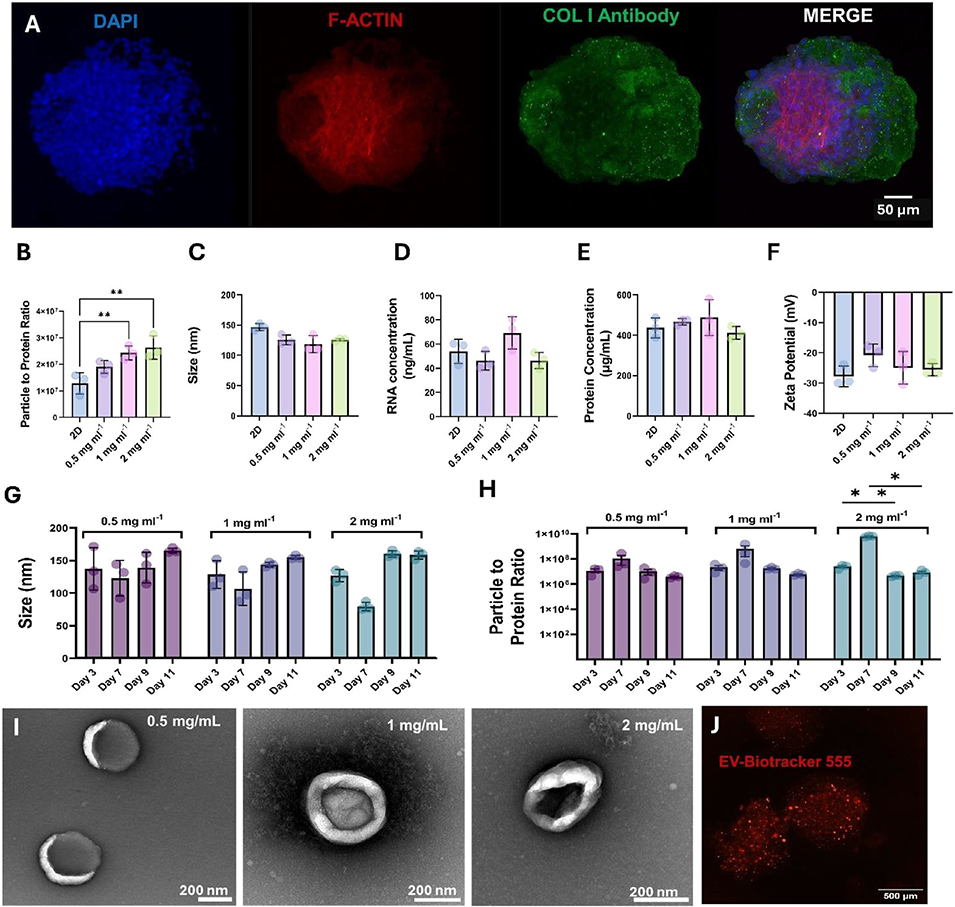
图7 胶原蛋白微珠作为微生物反应器用于持续细胞外囊泡(EV)生产
论文链接:https://doi.org/10.1002/admt.202502276
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














