
导读:
针对肝细胞癌(HCC)一线口服药物索拉非尼存在的水溶性差、生物利用度低、胃肠道不稳定等问题,本研究采用单步液滴微流控工艺,将索拉非尼负载的ZIF-8纳米颗粒封装进pH响应型海藻酸盐微颗粒,构建了纳米-微米复合递送系统。该系统在模拟胃酸环境中可避免药物过早释放,在肠道环境中实现24小时可控缓释,对HepG2肝癌细胞的细胞毒性显著优于游离索拉非尼,且能诱导浓度依赖性凋亡,为HCC口服化疗提供了高效、稳定的递送策略。相关研究以“Microfluidic Encapsulation of Sorafenib-Loaded ZIF-8 Nanoparticles in pH-Responsive Alginate Microparticles for Oral Chemotherapy of Hepatocellular Carcinoma”为题发表于期刊《ACS Applied Bio Materials》。
本文要点:
1、该研究聚焦肝细胞癌(HCC)口服化疗的药物递送难题,提出了一种基于微流控技术的pH响应型纳米-微米复合递送系统。
2、研究将索拉非尼负载到ZIF-8纳米颗粒(SZNPs)中,其平均粒径约72 nm,药物包封率达76%,再通过单步液滴微流控工艺将SZNPs封装进海藻酸盐微颗粒(aMPs),形成纳米-微米复合结构(SZ@aMPs)。
3、通过计算流体动力学(CFD)模拟优化微流控通道内的流体动力学和液滴形成,所得复合颗粒呈球形,水动力尺寸随流速比在76-113 μm间可调,且SZNPs分散均匀。
4、体外药物释放实验表明,该系统在模拟胃酸环境(pH<5.7)中能防止药物提前释放,而在模拟肠道环境(pH7.4)中实现24小时可控缓释。
5、细胞毒性实验显示,SZ@aMPs对HepG2肝癌细胞的抗癌活性显著优于游离索拉非尼,且能有效诱导癌细胞凋亡,浓度越高凋亡效果越显著。
6、该研究证实,这种pH响应型复合递送系统可解决索拉非尼水溶性差、生物利用度低及胃肠道不稳定性等问题,为HCC口服化疗提供了一种高效策略,但仍需进一步开展正常细胞相容性评估和体内实验以验证其生物医学适用性。
SZ@aMPs递送系统中,海藻酸盐与ZIF-8 NPs的pH响应机制如何协同作用,实现索拉非尼的胃内保护与肠道可控释放?
两者通过“双重pH响应”协同完成靶向递送,机制如下:
海藻酸盐(aMPs基质)的pH响应:分子含羧基(-COOH),胃内环境(pH<3.4,低于其pKa)中羧基质子化,形成致密凝胶结构,物理包裹SZNPs,阻止其与胃酸接触,避免ZIF-8降解和药物暴释;肠道环境(pH≥5.7,高于其pKa)中羧基去质子化,凝胶溶胀、降解,逐步释放SZNPs。
ZIF-8NPs的pH响应:肠道弱酸性(7)或肿瘤微环境酸性条件下,ZIF-8的2-甲基咪唑配体质子化,框架降解,缓慢释放包裹的索拉非尼;而在血液环境(pH7.4)中,ZIF-8结构稳定,进一步延缓药物释放,维持长效治疗浓度。
协同效应:海藻酸盐负责“胃内保护+肠道控释”,ZIF-8负责“肠道/肿瘤微环境精准释药”,两者结合实现“胃内稳定→肠道缓释→肿瘤靶向释放”的递药路径。
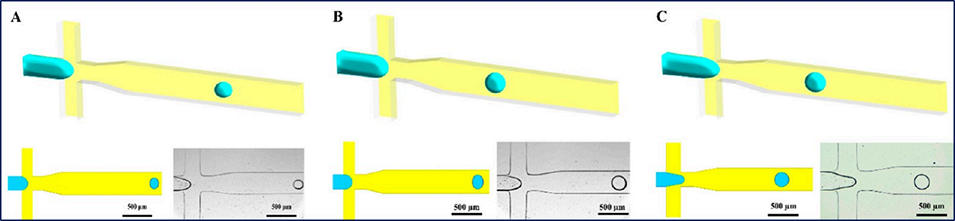
图1 不同毛细管数(Ca)和流速比(Φ)下的数值研究结果。数值研究对应的条件为:(A) Ca=0.024、Φ=0.02;(B) Ca=0.012、Φ=0.04;(C) Ca=0.012、Φ=0.08。
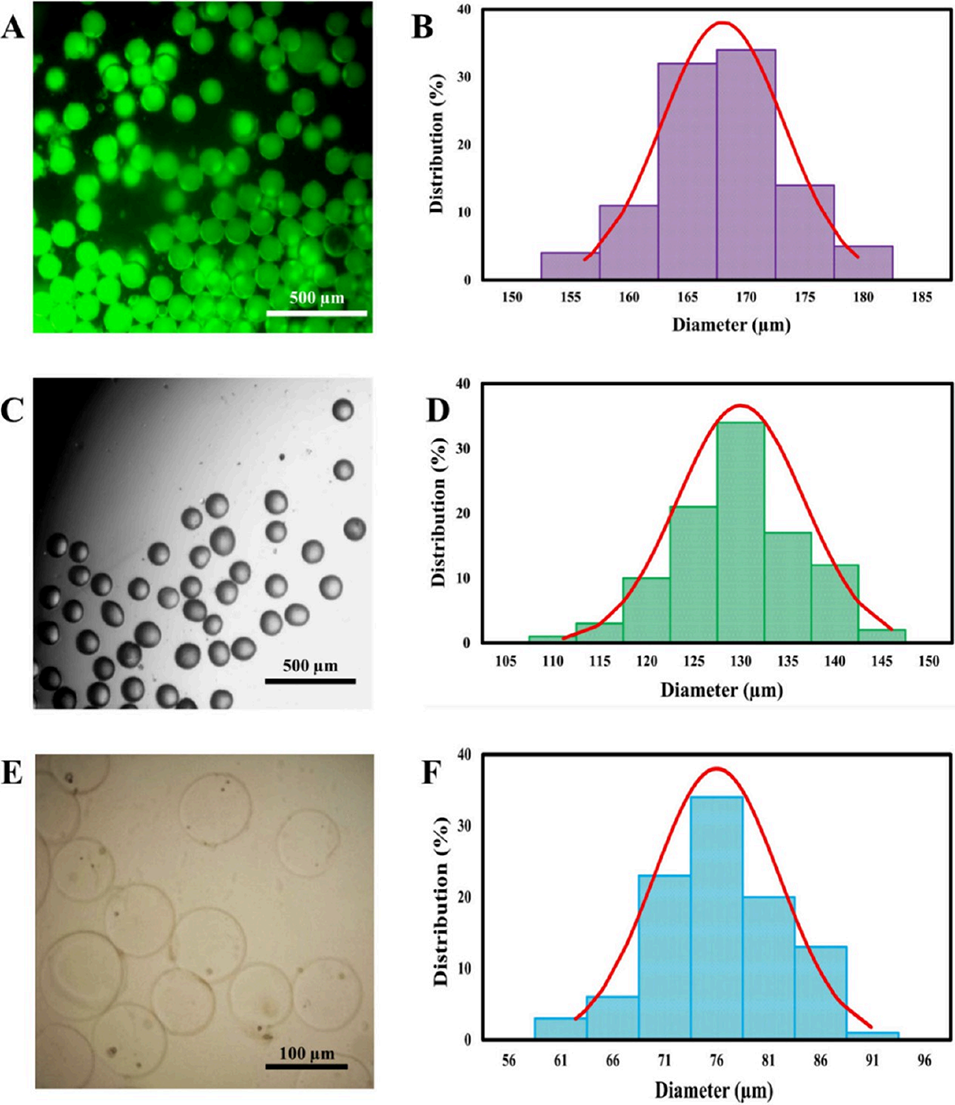
图2 液滴形态与尺寸分布表征。不同处理阶段(Ca=0.024、Φ=0.02)液滴的代表性显微镜图像及对应尺寸分布:(A、B) 初始液滴;(C、D) 未洗涤固化液滴;(E、F) 洗涤后固化液滴。
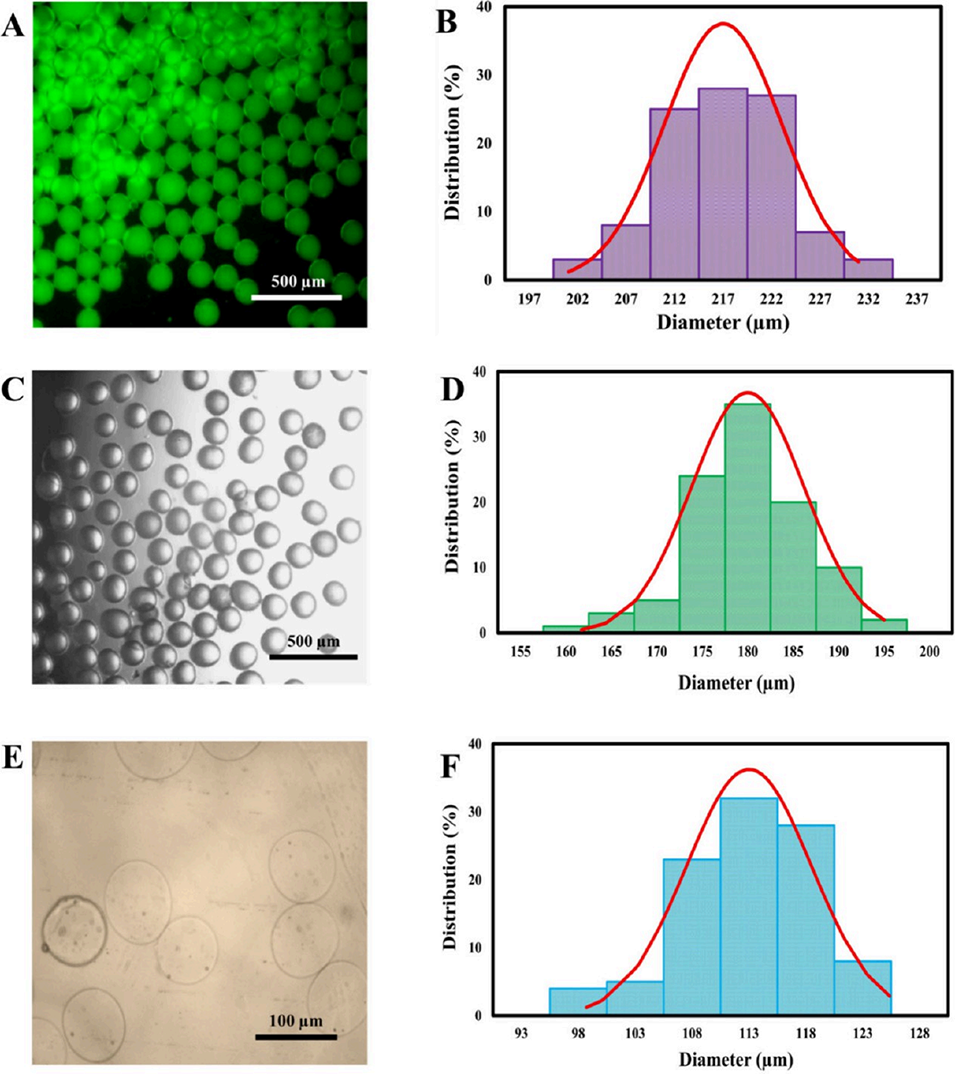
图3 液滴形态与尺寸分布表征。不同处理阶段(Ca=0.012、Φ=0.04)液滴的代表性显微镜图像及对应尺寸分布:(A、B) 初始液滴;(C、D) 未洗涤固化液滴;(E、F) 洗涤后固化液滴。
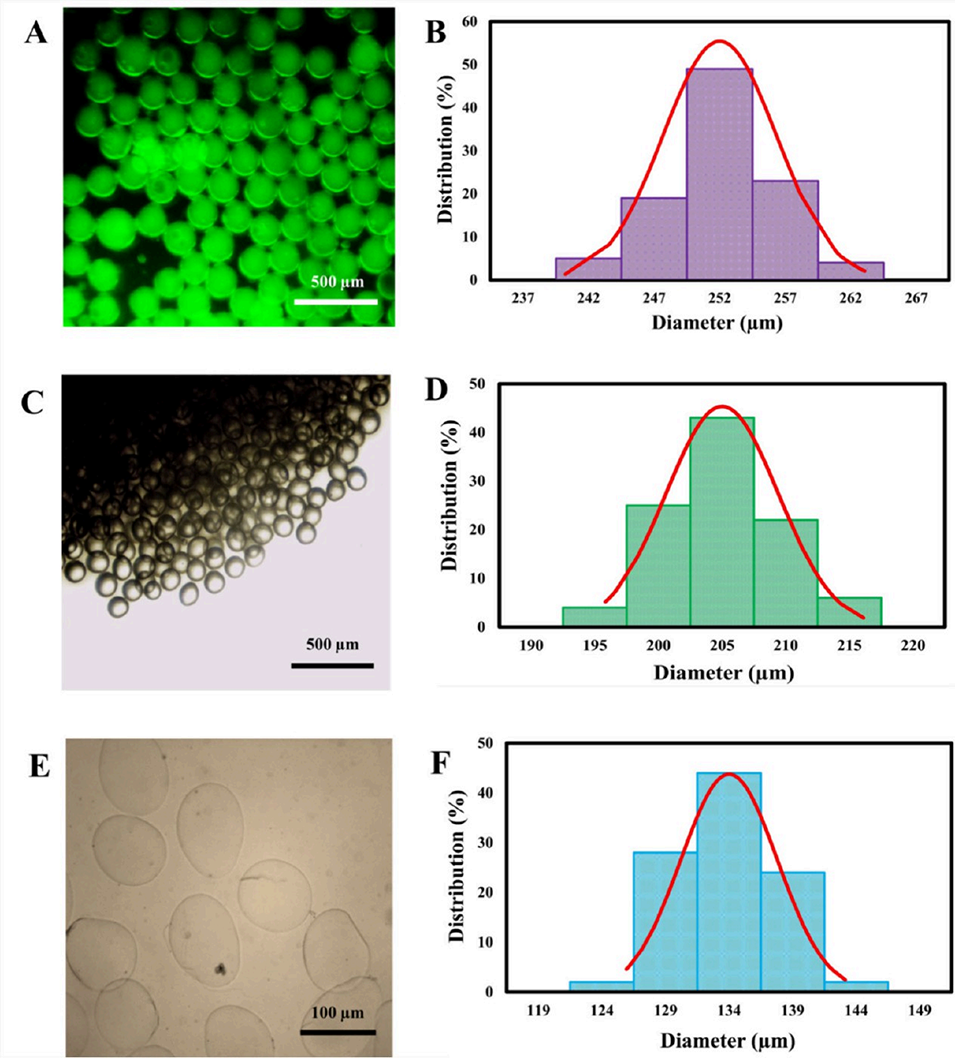
图4 液滴形态与尺寸分布表征。不同处理阶段(Ca=0.012、Φ=0.08)液滴的代表性显微镜图像及对应尺寸分布:(A、B) 初始液滴;(C、D) 未洗涤固化液滴;(E、F) 洗涤后固化液滴。

图5 ZIF-8纳米颗粒的形貌与尺寸表征。(A、B) 低倍和高倍下的代表性场发射扫描电子显微镜(FE-SEM)图像(比例尺分别为 1 μm 和 200 nm);(C) 尺寸分布曲线(平均值 = 72.18 nm,标准差 = 1.1 nm)。
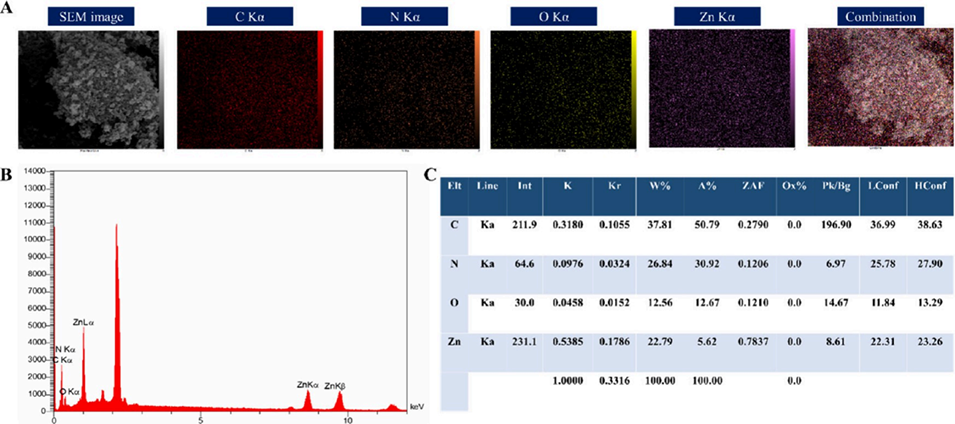
图6 ZIF-8纳米颗粒的元素分析。(A) 能量色散X射线(EDX)元素映射图;(B) 代表性EDX光谱;(C) 定量元素组成表。
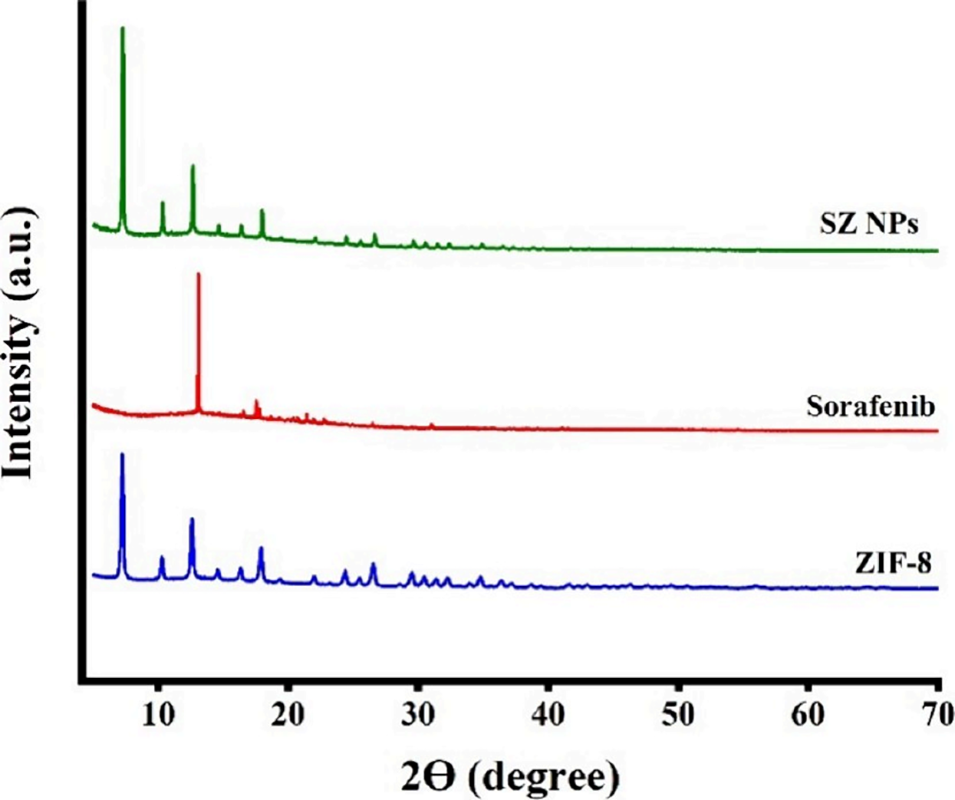
图7 X射线衍射(XRD)分析。纯ZIF-8、游离索拉非尼及合成的SZ纳米颗粒的衍射图谱(衍射角2θ范围为5°≤2θ≤80°)。
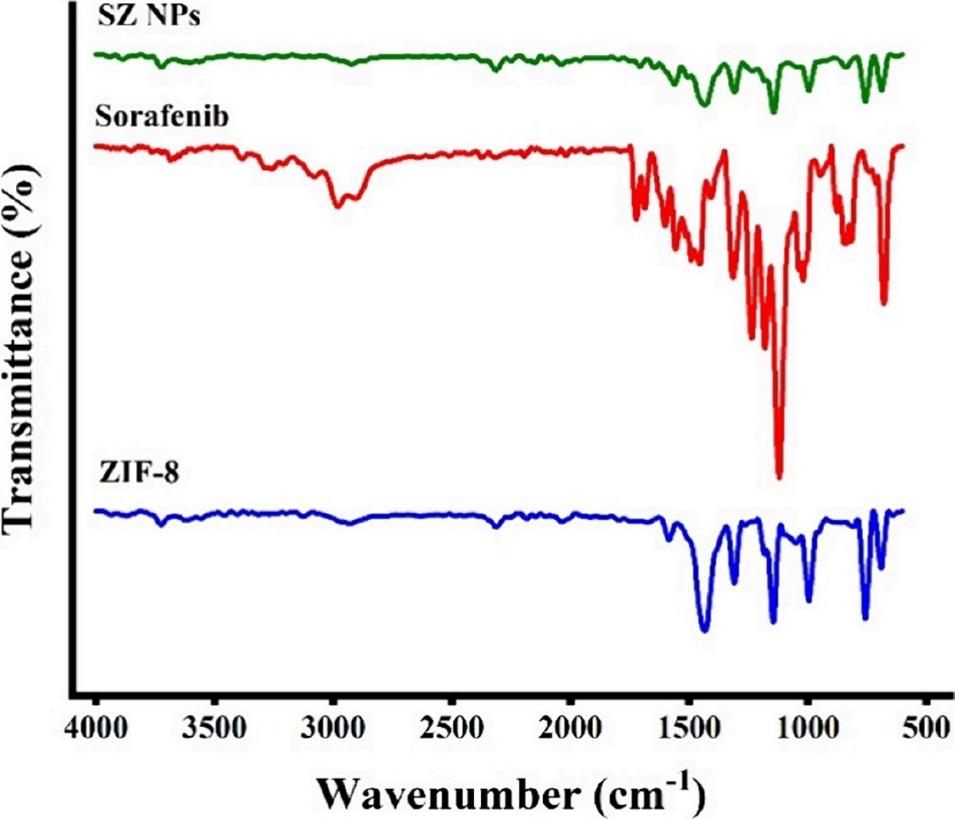
图8 傅里叶变换红外(FTIR)光谱分析。ZIF-8、索拉非尼及SZ纳米颗粒的光谱图(波数范围为4000-500 cm⁻¹)。
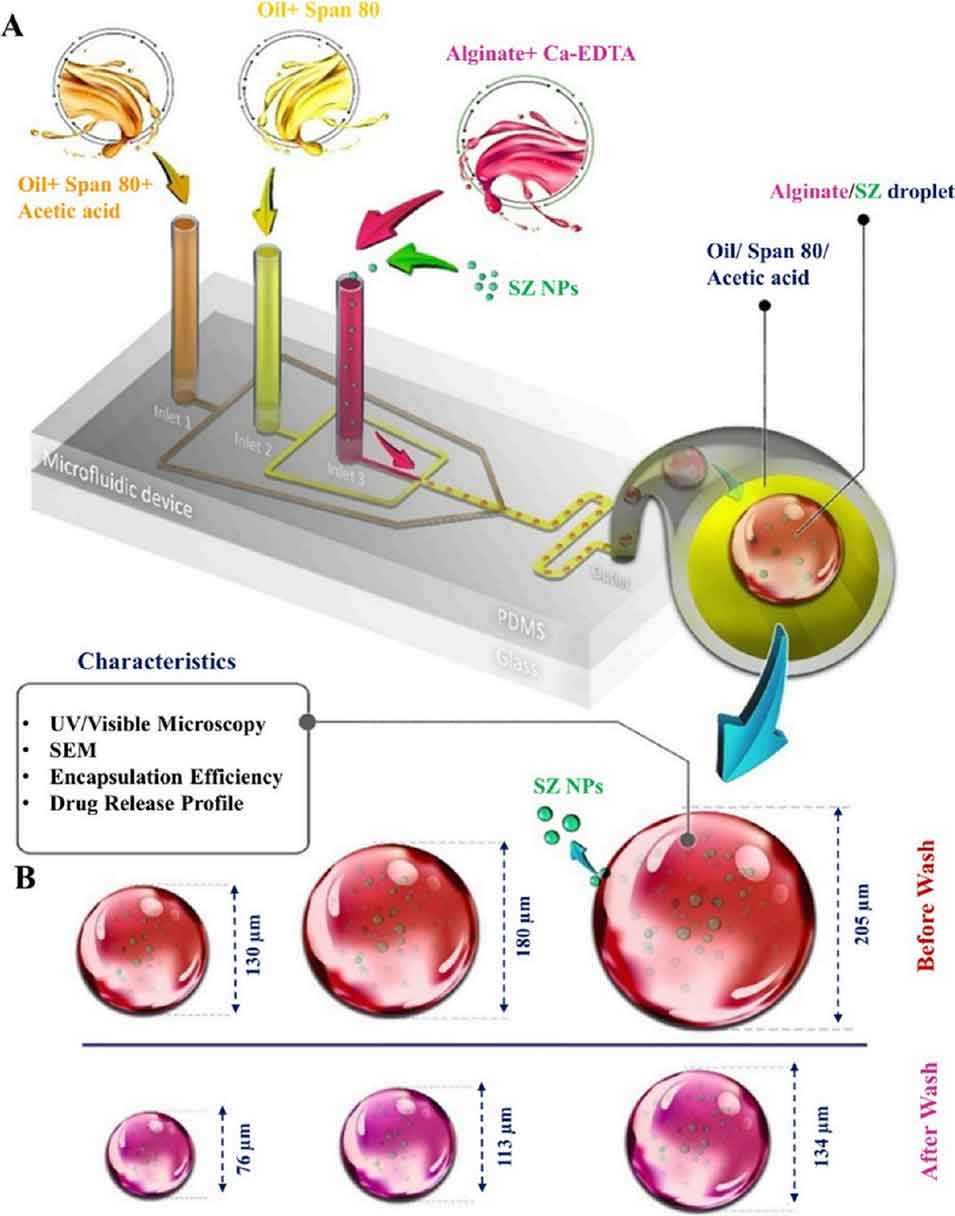
图9 (A) 可调谐SZ@aMPs的微流控制备流程示意图;(B) 微颗粒洗涤前后尺寸变化的示意图(未洗涤时尺寸分别为 130 μm、180 μm、205 μm,洗涤后对应为 76 μm、113 μm、134 μm)。

图10 SZ@aMPs的形貌表征。(A、B) 显示SZ@aMPs整体球形形貌的FE-SEM图像(比例尺分别为2 μm和1 μm);(C、D) SZ@aMPs表面的FE-SEM图像(比例尺分别为2 μm和500 nm)。
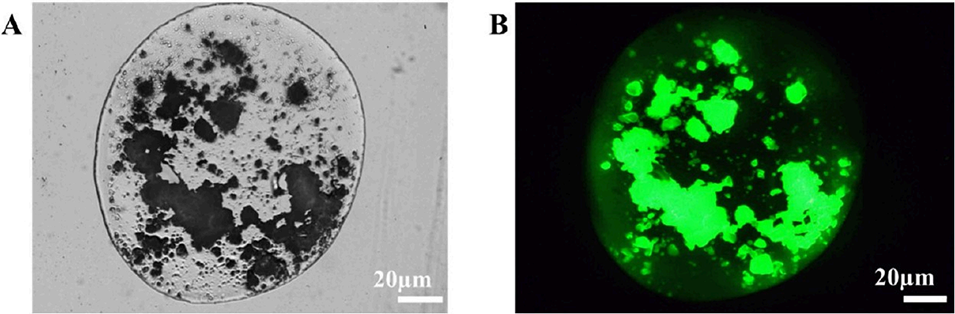
图11 SZ@aMPs的光学显微镜与荧光显微镜图像。(A) SZ@aMPs的明场显微镜图像(比例尺:20 μm);(B) 同一视野下异硫氰酸荧光素(FITC)标记的荧光图像(比例尺:20 μm)。
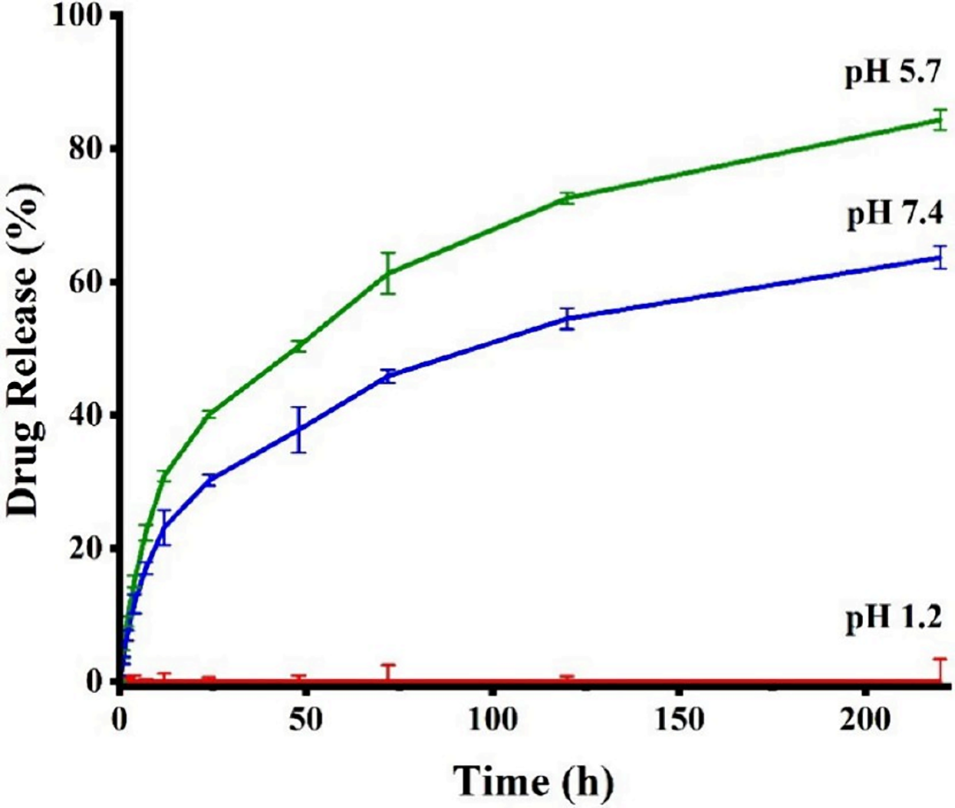
图12 SZ@aMPs的pH依赖性药物释放曲线。不同pH条件(1.2、5.7、7.4)下SZ@aMPs中索拉非尼的累积释放率(时间范围为0-200 h)。
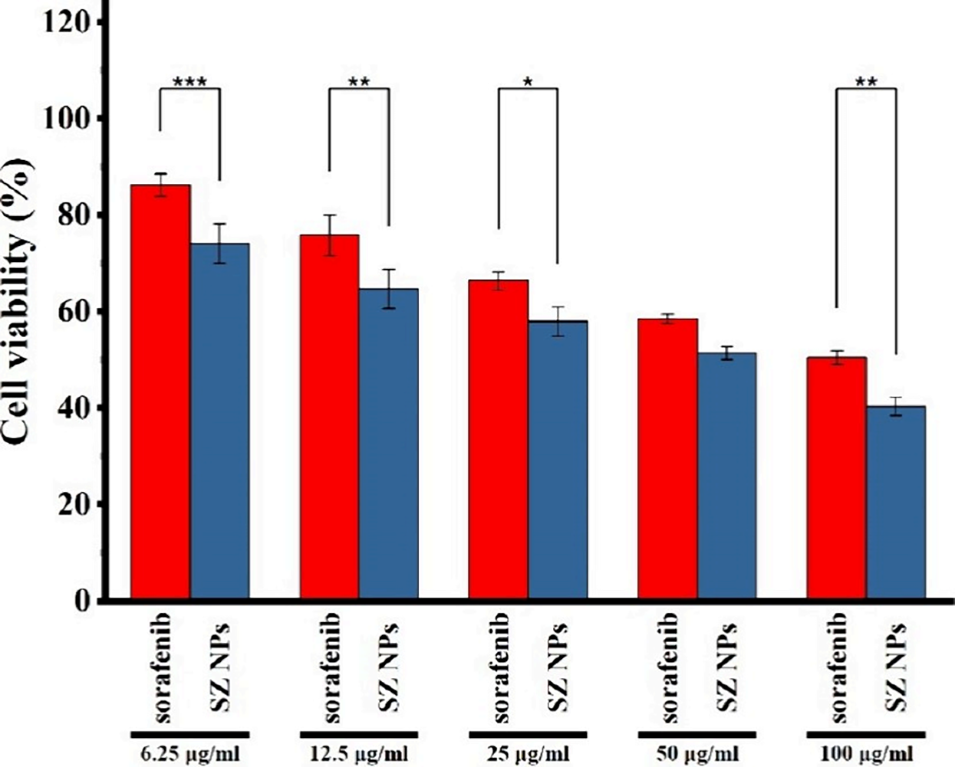
图13 体外细胞毒性评估。HepG2细胞在不同浓度(6.25、12.5、25、50、100 μg/mL)的游离索拉非尼和SZ纳米颗粒中孵育48 h后的细胞存活率。
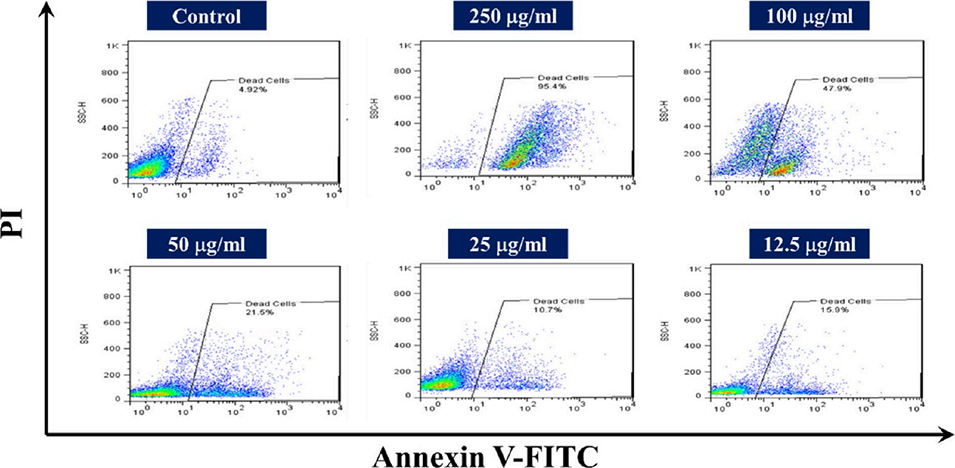
图14 凋亡诱导实验结果。不同浓度(12.5-250 μg/mL)SZ纳米颗粒处理后HepG2细胞的凋亡图像,以未处理的对照组细胞作为对照(检测方法:Annexin V-FITC/碘化丙啶(PI)双染流式细胞术)。
论文链接:https://doi.org/10.1021/acsabm.5c01270
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














