
导读
近期,法国格勒诺布尔阿尔卑斯大学的研究人员开发了一种新型微流控平台,用于建立和监测间充质和胰岛球体以及多能干细胞产生的血管类器官周围内皮网络的形成。相关研究以“A microfluidic platform integrating functional vascularized organoids-on-chip”为题目,发表在期刊《Nature Communications》上。
本文要点:
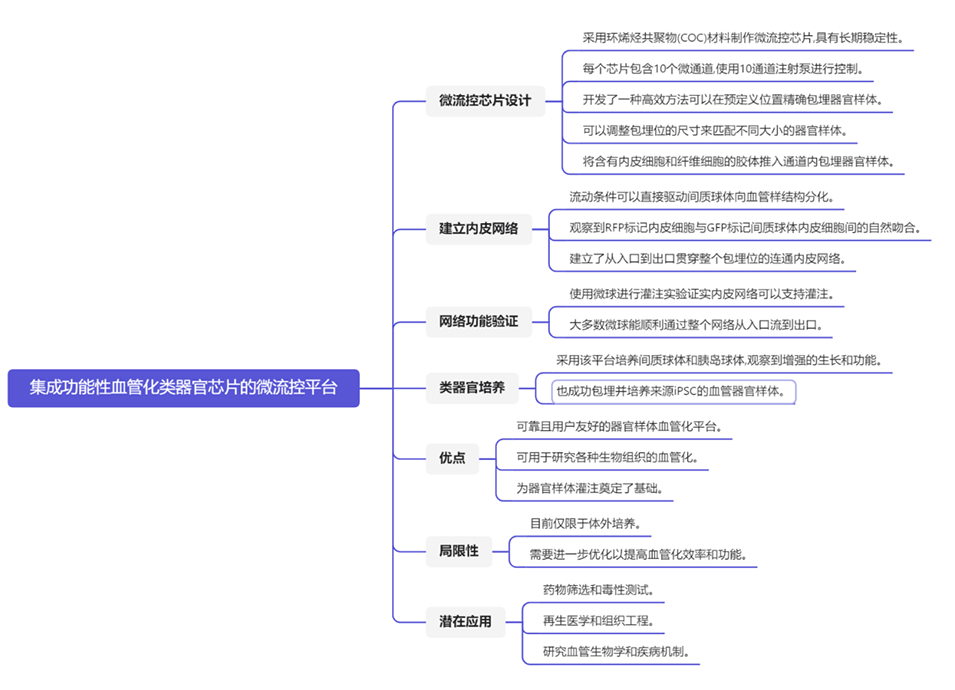
1、该微流控芯片的材料为环烯烃共聚物(COC),其具有长期稳定性好、适合批量生产、光学性能好等优点。
2、研究采用了水力捕获原理,将类器官精确定位和固定在微通道的特定位置。同时将含有HUVEC细胞和间质细胞的胶体注入通道内,将类器官包裹其中。
3、在流动条件下培养间充质球体时,观察到内皮网络的形成明显优于静止条件。同时胶体内HUVEC细胞和球体内HUVEC细胞之间也形成了连接。
4、通过微球流动实验证实,形成的内皮网络可以支持灌注,微球能顺利通过网络各部分。
5、使用该平台培养胰岛球体时,发现其生长、成熟和功能均有所增强。
6、该微流控平台为各种生物三维组织提供了一种可行的血管化模型,为将来利用微流控技术建立类器官灌注奠定了基础。
全文总结/概括:
本研究中使用的微流控芯片相比传统培养方法有哪些优势?
1、精准的组织定位:微流控芯片通过精确的组织定位和微通道设计,可以实现对类器官的精准培养和监测,从而提高实验的可重复性和准确性。
2、模拟体内环境:微流控芯片可以更好地模拟体内的生理环境,包括血管灌注和细胞间相互作用,有助于更真实地观察类器官的生长和功能。
3、高效的血管化:研究结果表明,使用微流控芯片可以更有效地实现类器官的血管化,建立功能性的血管网络,为类器官提供充分的营养和氧气,从而促进其生长和成熟。
使用微流控平台培养类器官的效果如何?
1、互联可灌注内皮网络的建立:该平台成功地在间充质和胰岛球体以及多能干细胞生成的血管类器官周围建立了相互连接的可灌注内皮网络。这些网络为结构提供了血管内灌注,促进了类器官的生长、成熟和血管发育。
2、血管类器官的血管化:该平台展示了血管类器官的有效吻合和可控灌注,以及血管类器官功能的增强。内皮网络形成包围血管类器官的内皮床,并表现出横跨陷阱位点的三维组织。
3、促进芯片上血管类器官的生长和成熟:该平台显示在流动条件下血管类器官的生长和成熟度增强,ECM重塑得到改善,类器官尺寸增大。在该平台上培养的样本的转录组与体内移植的人体血管类器官相似,表明成熟度增强。
4、芯片上血管化胰岛球体的功能增强:该平台显示,当在流动条件下进行芯片上培养并嵌入HUVEC血管床时,胰岛球体在葡萄糖刺激下的胰岛素分泌得到改善,从而产生了功能更强的β细胞微环境。
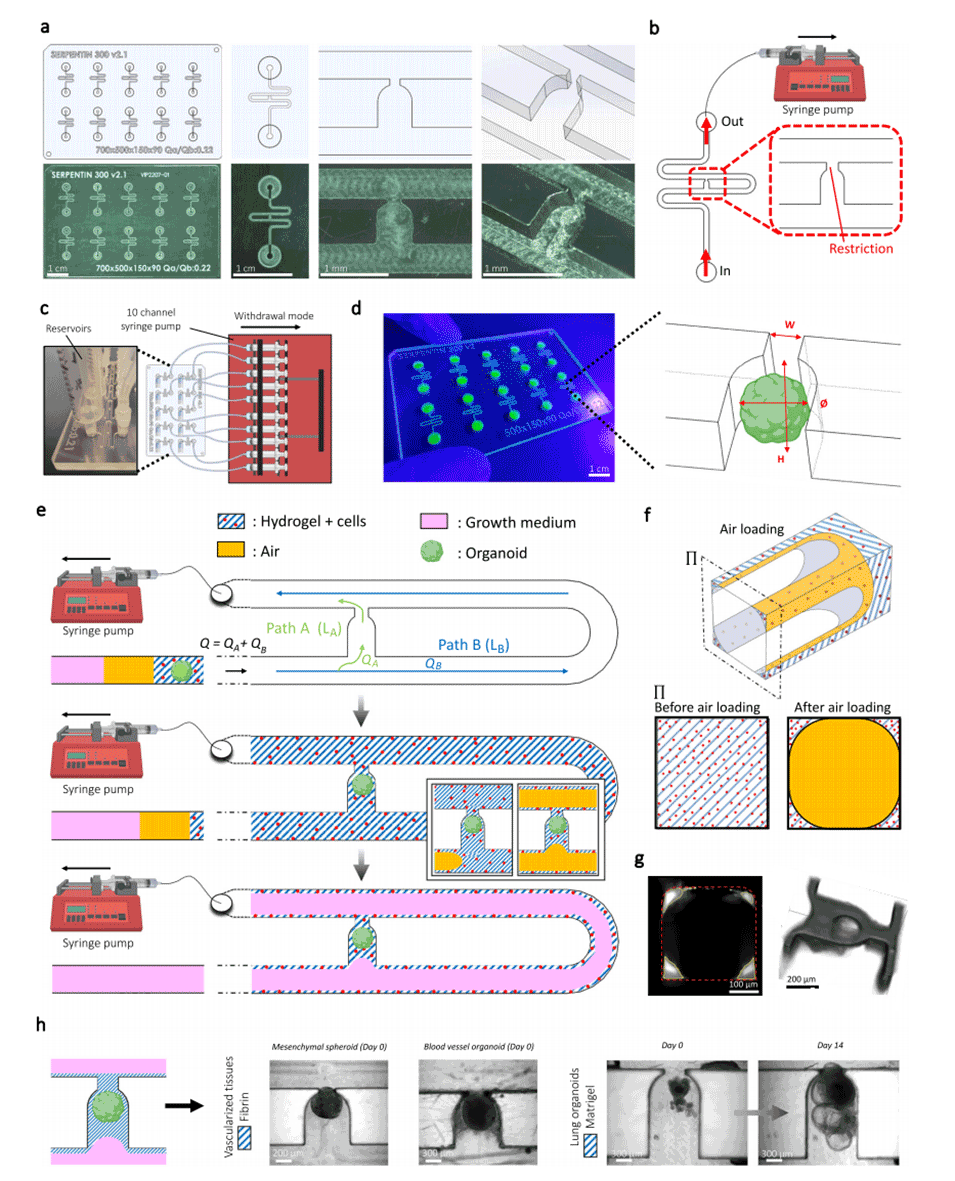
图1.设备设计以及类器官和细胞形态概览。
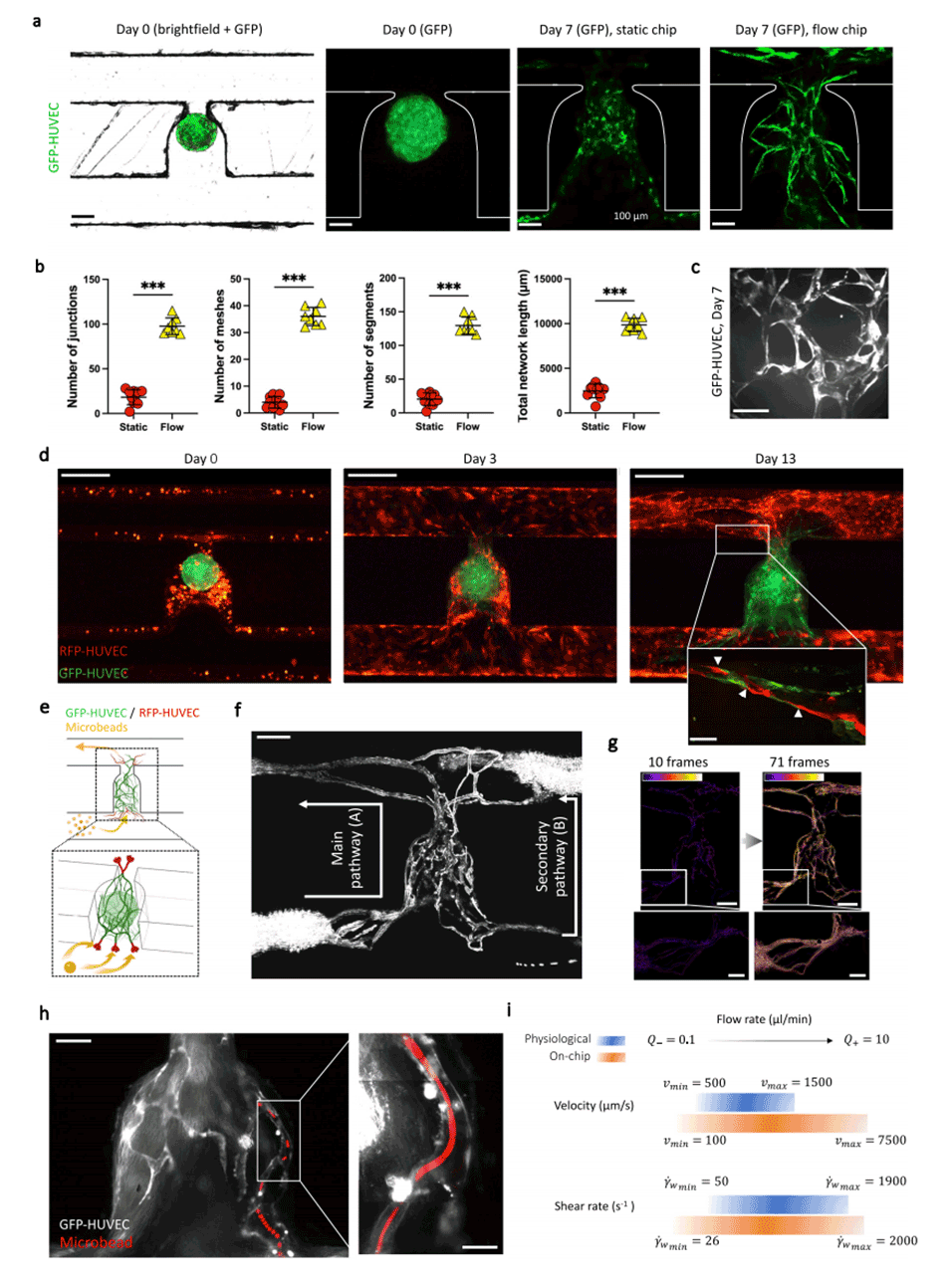
图2.通过间充质球体的功能性血管化生成吻合内皮网络。
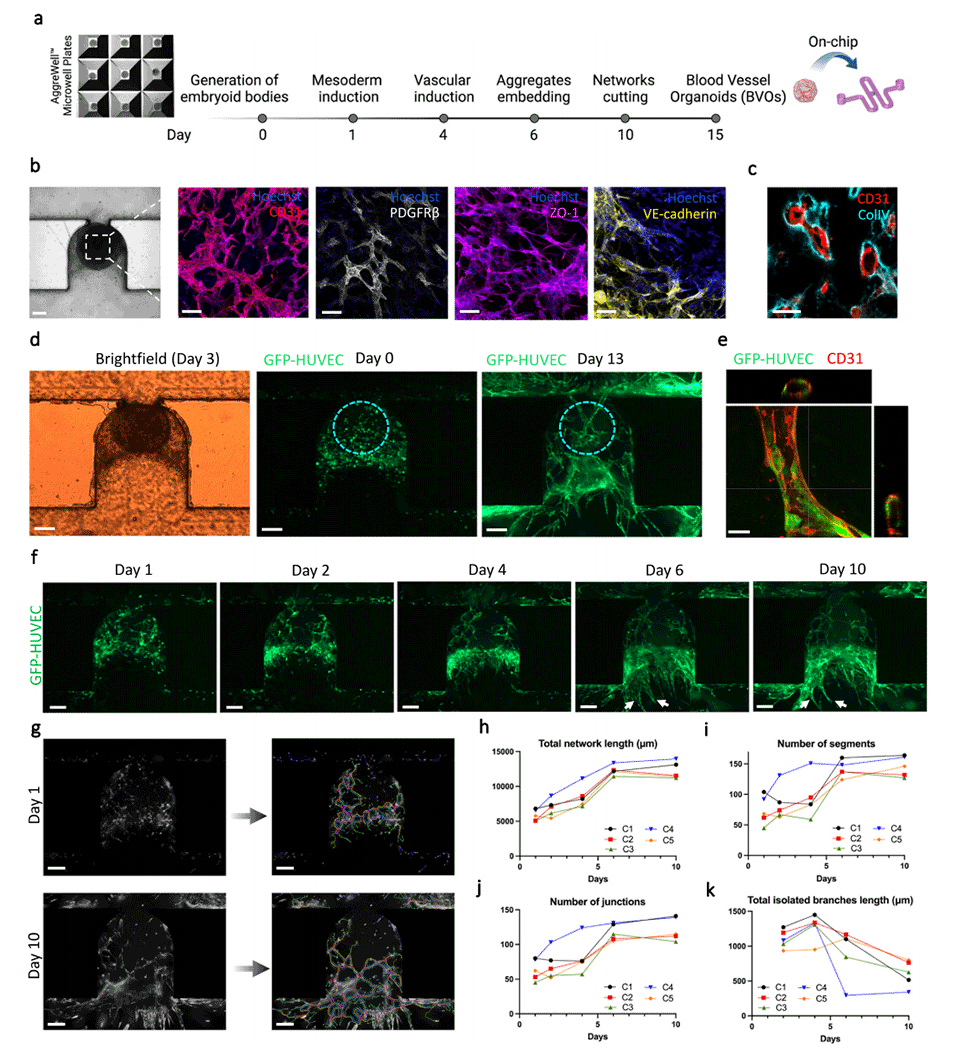
图3.芯片上血管类器官(BVOs)的血管化。
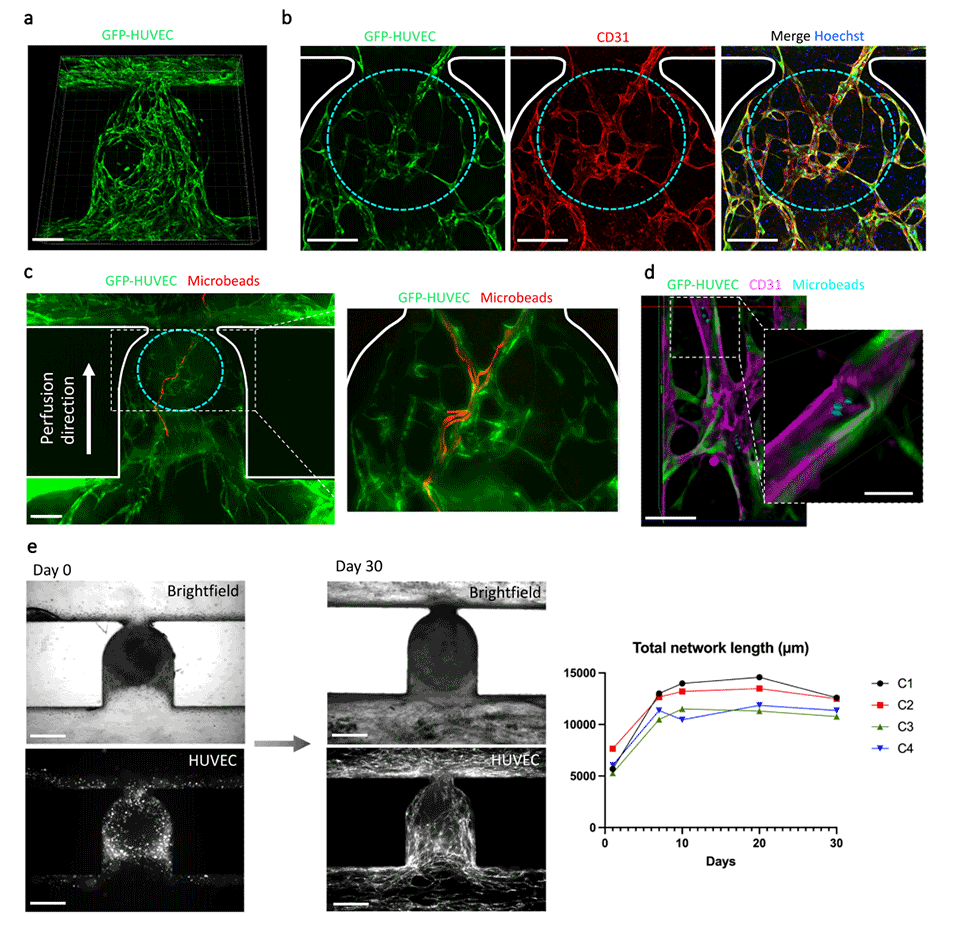
图4.血管类器官可灌注HUVEC内皮网络的建立。
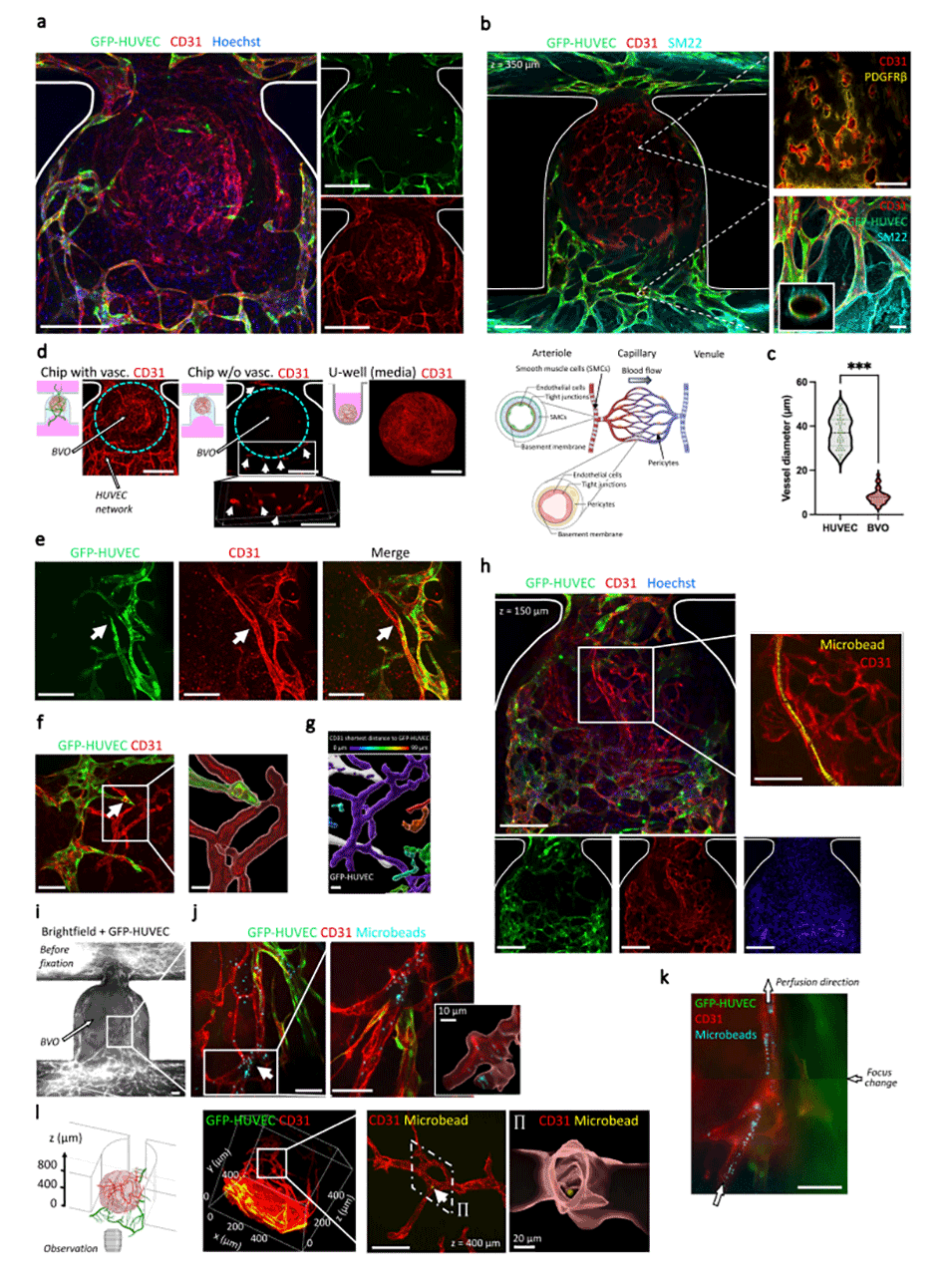
图5.评估HUVEC内皮床与干细胞衍生的血管类器官组织之间的功能性吻合。
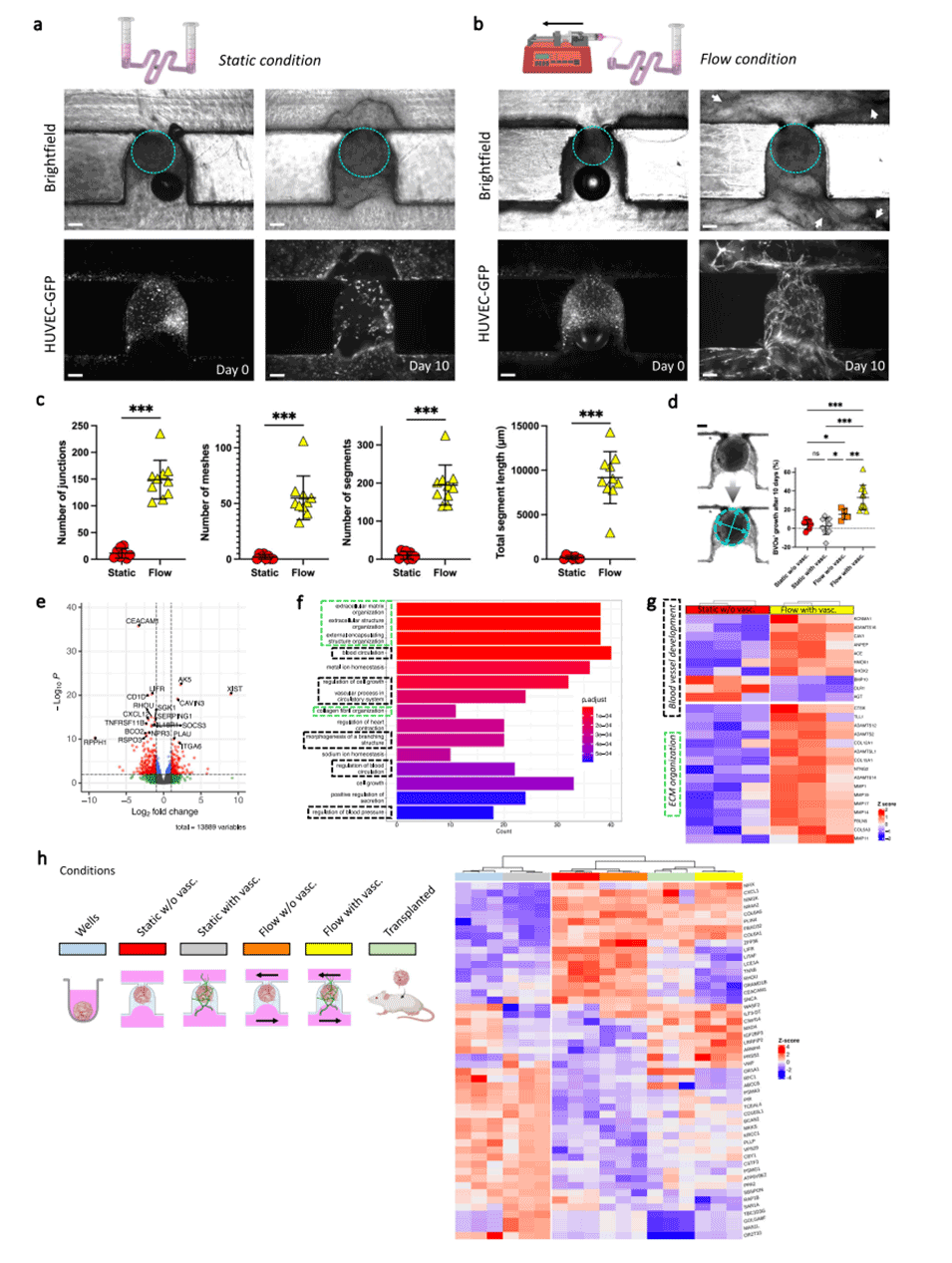
图6.通过流动和血管化促进类器官的生长和成熟。
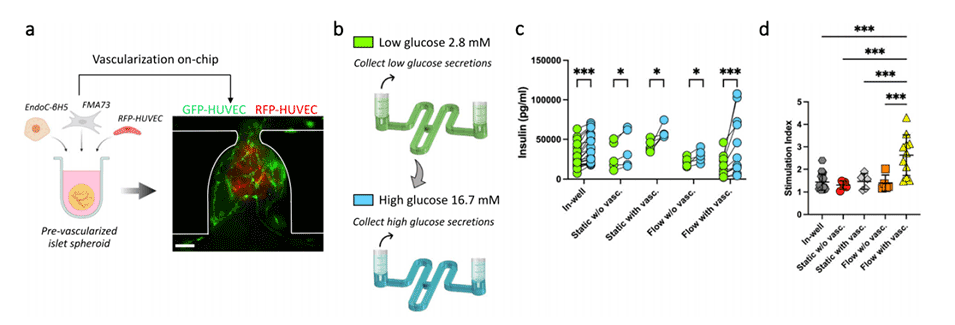
图7.通过流动和血管化增强胰岛球体的功能。
论文链接:https://doi.org/10.1038/s41467-024-45710-4














