
导读
近期,沙里夫理工大学和阿米尔卡比尔理工大学的研究人员利用核壳微流控系统制备负载来曲唑的海藻酸二醛-明胶微凝胶,并探讨了不同因素对载药微凝胶生成的影响,旨在实现乳腺癌治疗药物的可控释放。相关研究以“Production of letrozole-loaded alginate oxide-gelatin microgels using microfluidic systems for drug delivery applications”为题目,发表在《International Journal of Biological Macromolecules》上。
本文要点:
1、本文研究了利用微流控系统生产含有来曲唑的海藻酸二醛-明胶微凝胶,用于药物递送应用。
2、探讨了影响载药微凝胶生产的关键因素,如聚合物类型、药物类型、药物与聚合物的体积比例以及微流控系统的几何形状。
3、研究发现采用海藻酸二醛-明胶体系,特别是体积比例为70-30的微凝胶,具有良好的溶胀比和结构稳定性,以及超过70%的药物负载率。
4、对不同组合的微凝胶进行了药物释放测试,发现70-30体积比的海藻酸二醛-明胶微凝胶具有更受控的来曲唑释放率,符合Higuchi模型和Fick第一扩散定律。
全文总结/概括:
相比单相流体,采用核壳流体有什么优势?
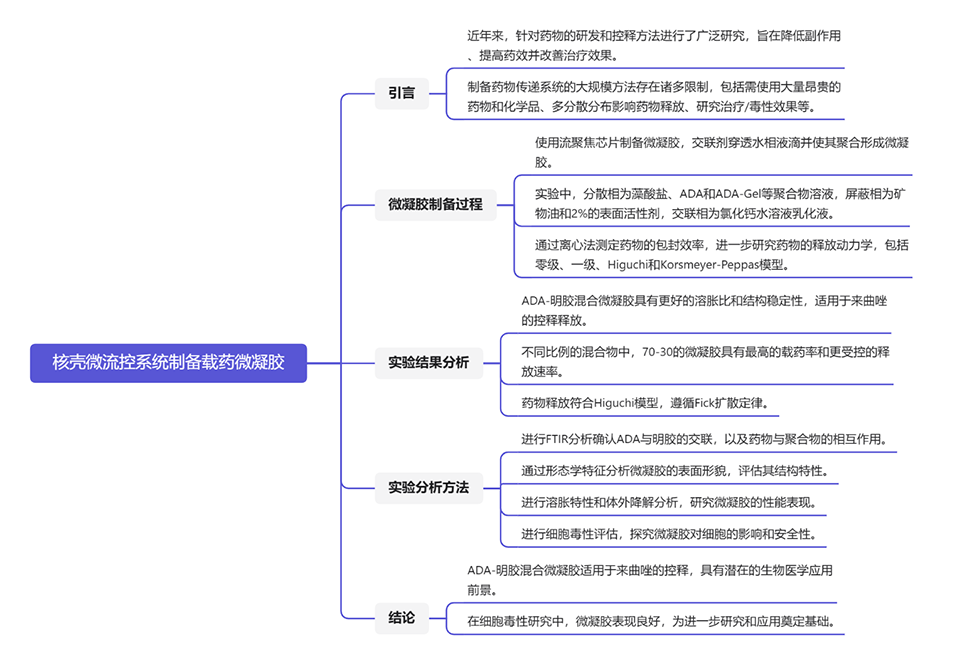
相比单相流体,在微流控系统中采用核壳流体(core-shell fluid)具有以下优势:
1、延迟凝胶过程:核壳流体可以在微流控芯片中形成保护层,有效延迟凝胶过程,有助于控制微凝胶的形成和性质。
2、防止堵塞:核壳流体可以用作包覆层,防止微流控芯片的堵塞,提高了微流控系统的稳定性和可靠性。
3、同时载药:核壳流体有助于在微凝胶形成的同时将药物负载到微凝胶中,提高了药物的载药效率和微凝胶的药物释放性能。
4、控制药物释放:采用核壳流体,可以实现对药物释放的精确控制,有助于提高药物的疗效并减少潜在的副作用。
本研究采用ADA(海藻酸二醛)- 明胶混合物相比单独使用ADA或明胶具有哪些优势?
1、ADA-明胶通过肽键交联,可以实现更稳定和可控的药物释放,比单独使用ADA或明胶具有更好的控释效果。
2、ADA-明胶混合物的降解率可以通过调节组成比例来控制,实现了降解率的调控,这对于组织工程应用很重要。
3、ADA-明胶混合物形成的微凝胶具有更好的形态稳定性和溶胀率,有利于药物的持续释放。
4、细胞生物学实验结果表明,ADA-明胶混合物微凝胶对细胞的细胞毒性更低,生物相容性更好。
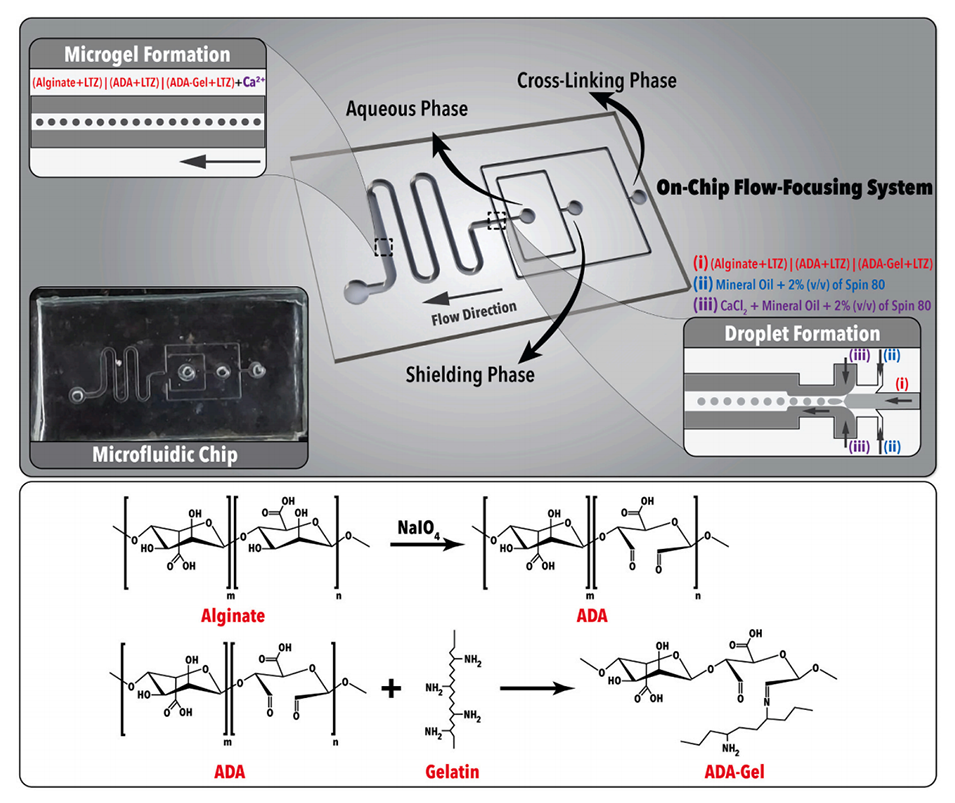
图1.用于生成载药微凝胶的片上流动聚焦系统的示意图,以及ADA和ADA凝胶的化学分子结构。
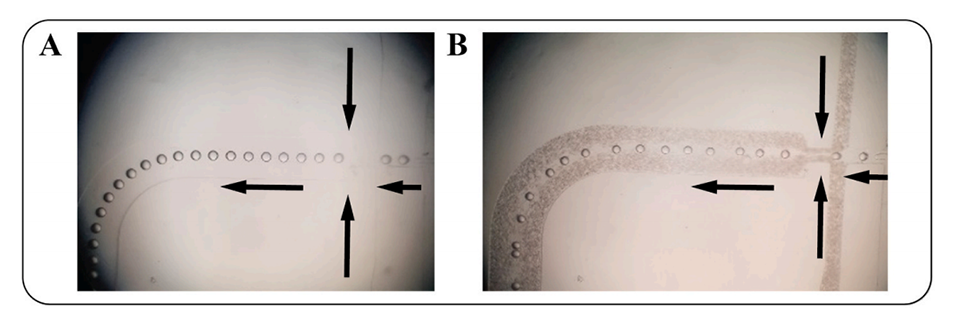
图2.液滴和微凝胶生成。
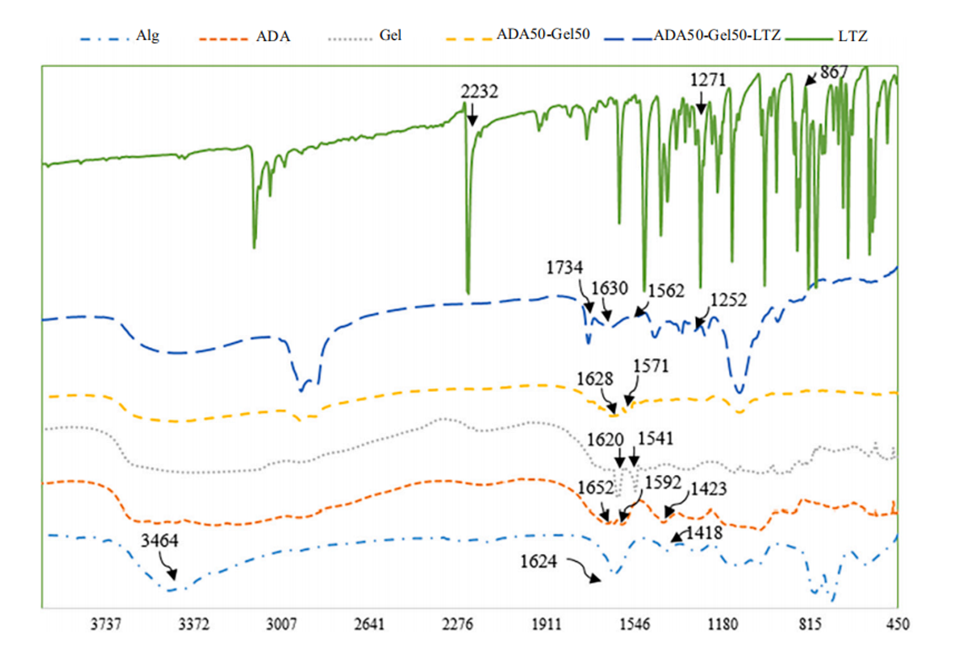
图3.Alg、ADA、Gel、ADA50-Gel50、ADA50-Gel50-LTZ和LTZ的FTIR分析。
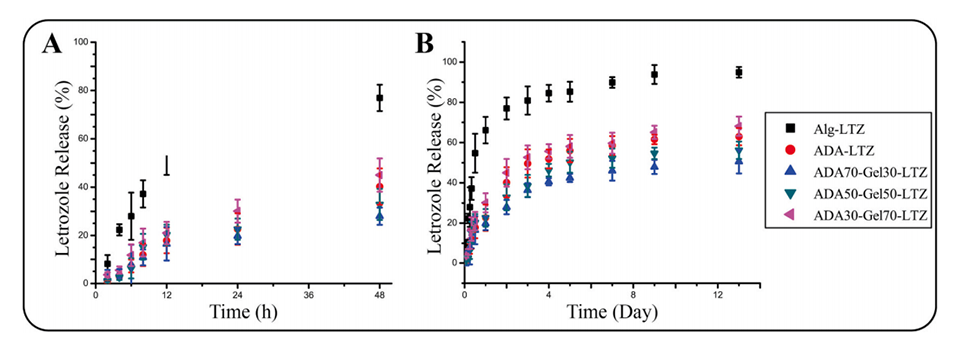
图4.Alg-LTZ、ADA-LTZ、ADA70-Gel30-LTZ、ADA50-Gel50-LTZ和ADA30-Gel70-LTZ样品的LTZ释放率。
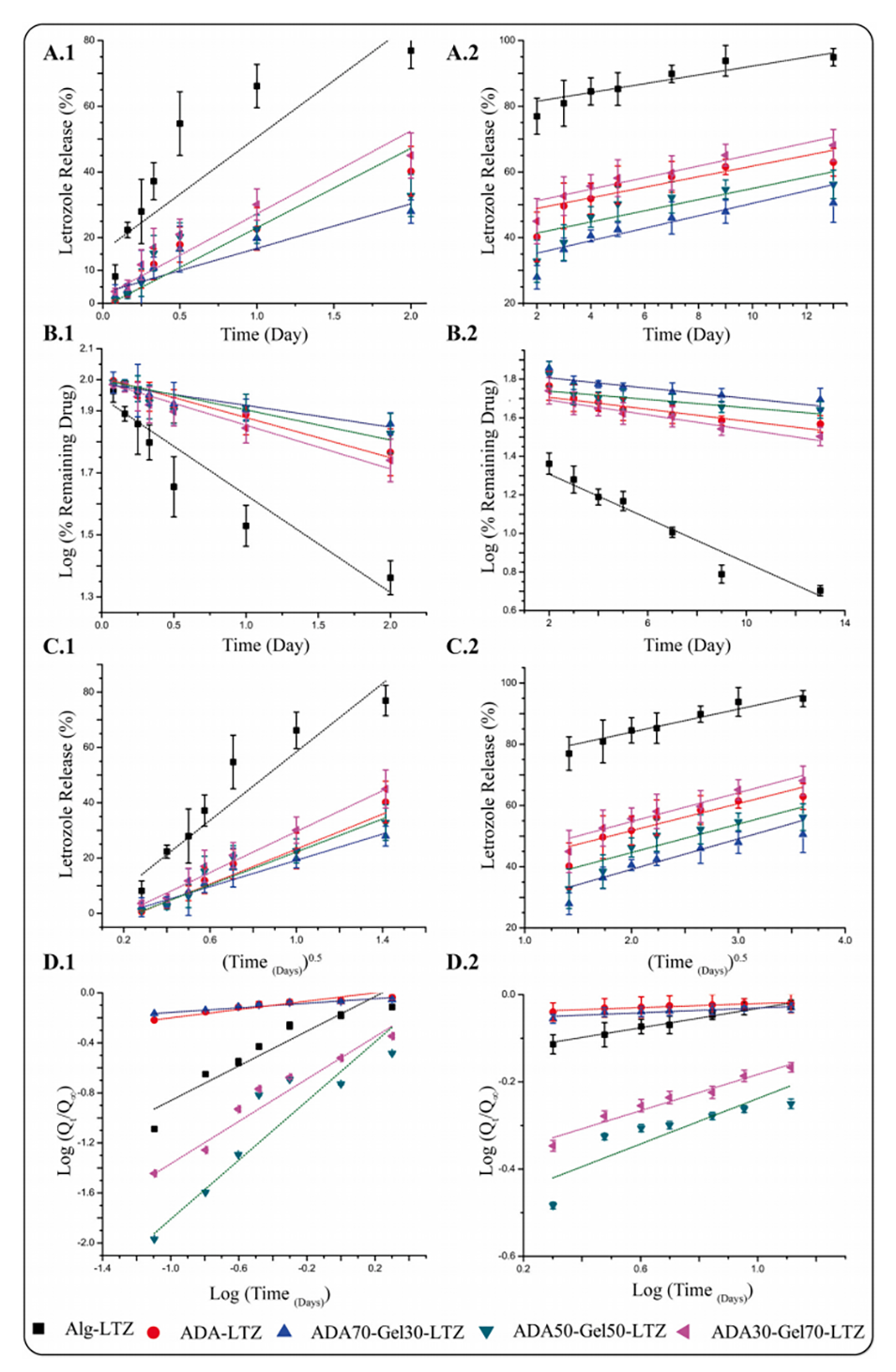
图5.微凝胶的LTZ释放曲线。
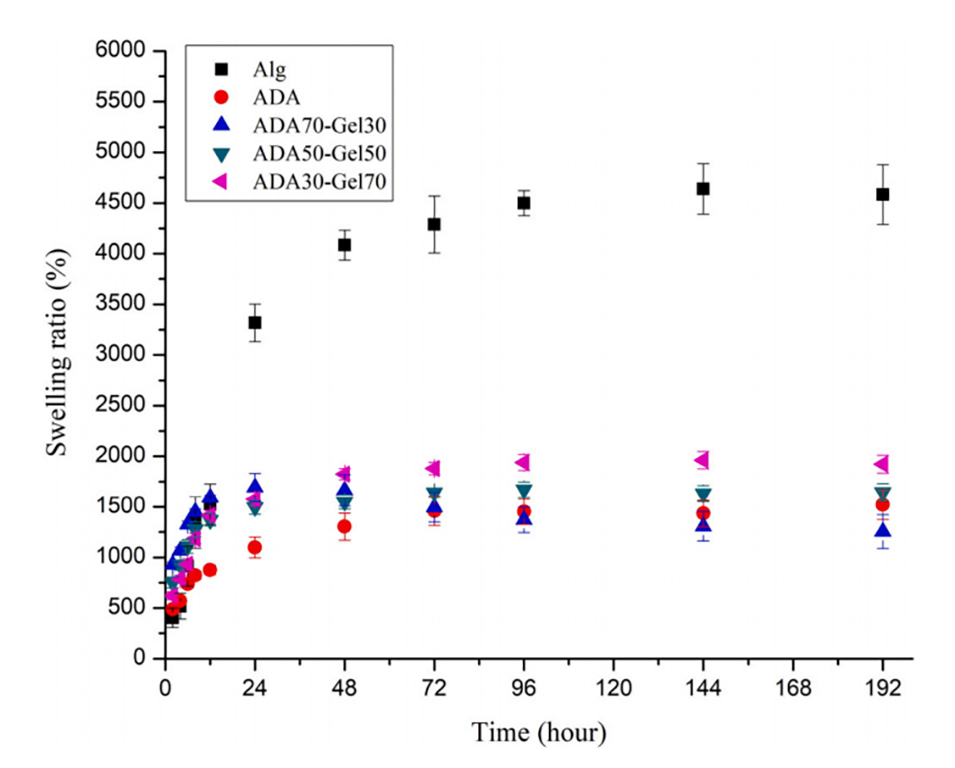
图6.由Alg、ADA和不同比例ADA-Gel制备的不同微凝胶在PBS中的溶胀率(%)与孵育时间的函数关系。
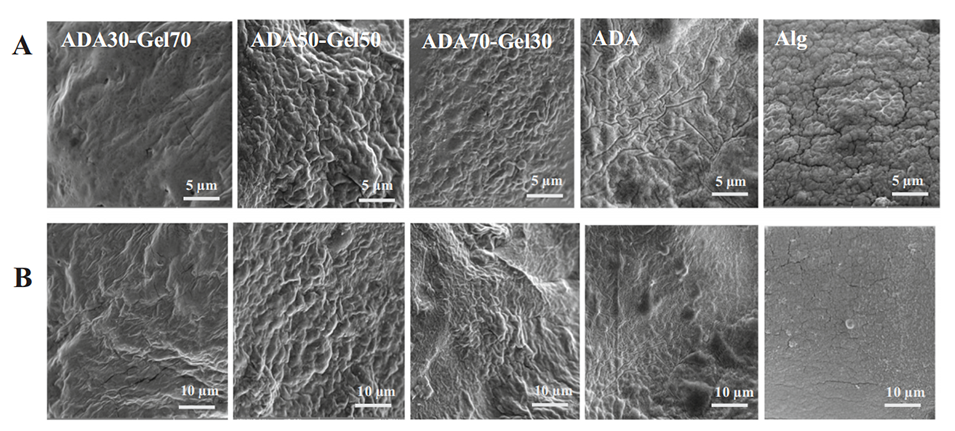
图7.Alg、ADA、ADA70-Gel30、ADA50-Gel50和ADA30-Gel70微凝胶的SEM图像。
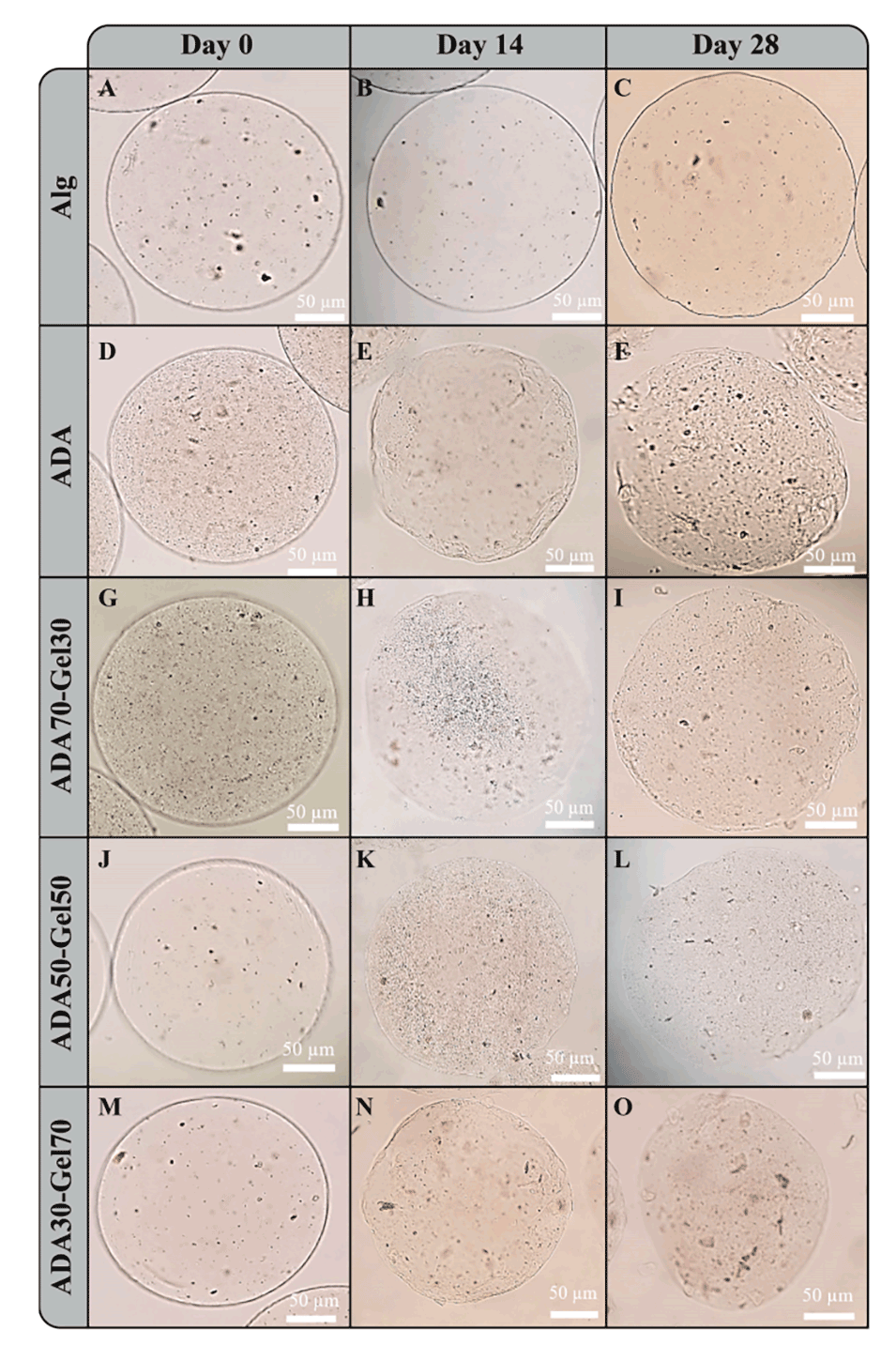
图8.在PBS中孵育0、14和28天后的微凝胶的光学显微镜图像。
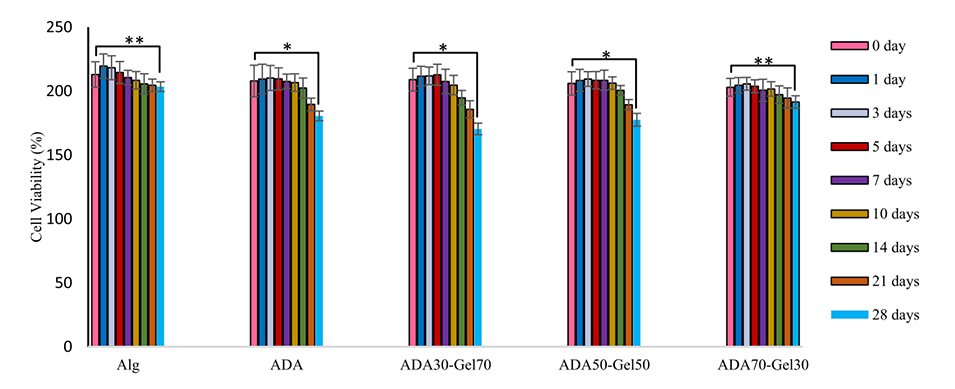
图9.藻酸盐、ADA和不同比例ADA-Gel制备的微凝胶的直径随PBS中孵育时间的变化。星号表示显著差异,*p<0.05和**p<0.01(使用Bonferroni事后检验)。
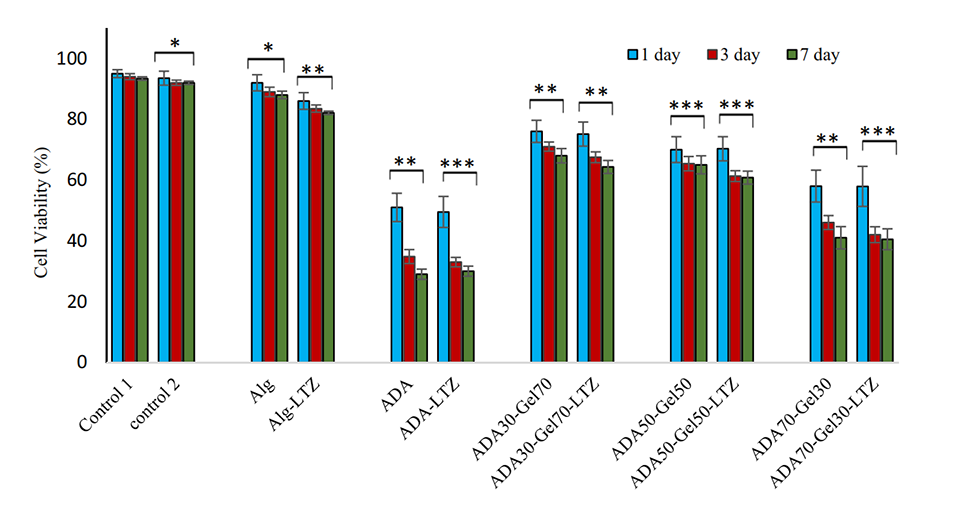
图10.细胞培养1天、3天和7天后,通过MTT分析评估Alg、ADA、ADA70-Gel30、ADA50-Gel50、ADA30-Gel70(有和没有药物)和对照组的微凝胶的细胞活力(%)。星号表示显著差异,*p<0.05,**p<0.01和***p<0.001(使用Bonferroni事后检验)。
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.129685














