
导读:
近期,有研究人员开发了一种名为PANDA(Precision Apheresis for Non-invasive Debulking of cell Aggregates,非侵入性细胞团簇精准分离术)的无标记微流控技术,该技术能够从未经稀释的血液中连续分离出循环肿瘤细胞团簇(CTCCs),具有高通量、低剪切力和高回收率的特点,为癌症研究、早期检测和治疗提供了新的工具。相关研究以“Label‐Free Microfluidic Apheresis of Circulating Tumor Cell Clusters”为题目发表于期刊《Advanced Science》。
本文要点:
1、开发了一种名为PANDA的无标记微流控技术,能够从大量未稀释的血液中持续分离出循环肿瘤细胞簇(CTCCs)。
2、PANDA芯片利用二级横向流动和边缘化效应实现了CTCCs在全血中的高度聚焦,从而在高通量(每小时1升)、低剪切应力(≤15Pa)的条件下分离CTCCs。
3、PANDA芯片从100mL未稀释血液中回收了约24个稀有HeLa细胞簇,回收率超过90%,同时将99.9%以上的血液成分安全返回。
4、分离后的血液细胞学性质和功能未受明显影响,为临床应用奠定了基础。
5、该技术为从大量血液中高效分离CTCCs提供了一种新的解决方案,有助于推进癌症的早期诊断和个体化治疗。
PANDA方法相比现有技术具有以下优势:
1、高通量:PANDA芯片可以以每小时1升的速度处理血液,远高于现有的微流控设备。
2、高回收率:PANDA芯片从100mL未稀释血液中回收了超过90%的稀有HeLa细胞簇。
3、低剪切应力:PANDA芯片中细胞所受的峰值剪切应力保持在15Pa以下,有助于保护脆弱的CTCC的完整性。
4、血液稀释最小:在分离过程中只需要添加少量的缓冲液,从而确保超过99.9%的血液成分可以安全返回,最大程度地减少了对血液的稀释。
5、连续分离:与基于捕获和释放的方法不同,PANDA芯片可以从未稀释的血液中连续分离CTCC,避免了由于长时间滞留或机械变形导致簇破碎的风险。
PANDA芯片通过以下设计来确保最小的剪切应力,从而保护CTCC的完整性:
1、通道尺寸:PANDA芯片的通道深度为110μm,通道宽度为750μm,比典型的微流控设备更大。这使得芯片能以较低的流速(340μL/min)运行,从而维持≤15Pa的峰值剪切应力。
2、鱼骨状结构:通道顶部的鱼骨状凹槽创造了一个二次横向流动,将较大的CTCC聚焦到通道壁附近,那里的剪切应力低于通道中心。
3、多级浓缩:PANDA芯片使用3级或6级浓缩器逐步浓缩CTCC,而不是将其一次性地暴露在高剪切分离步骤中。这种分步方法最小化了脆弱CTCC所经历的峰值剪切应力。
4、最终分离前的稀释:在非平衡惯性分离阵列(NISA)分离器进行最终基于尺寸的分离之前,浓缩的CTCC样品会被缓冲液稀释以降低粘度。这进一步降低了最终分离步骤中的剪切应力。
通过采用这些设计策略,PANDA芯片能够在保持峰值剪切应力低于15Pa的情况下从未稀释的血液中分离CTCC,有助于保护这些脆弱CTCC的完整性和形态。
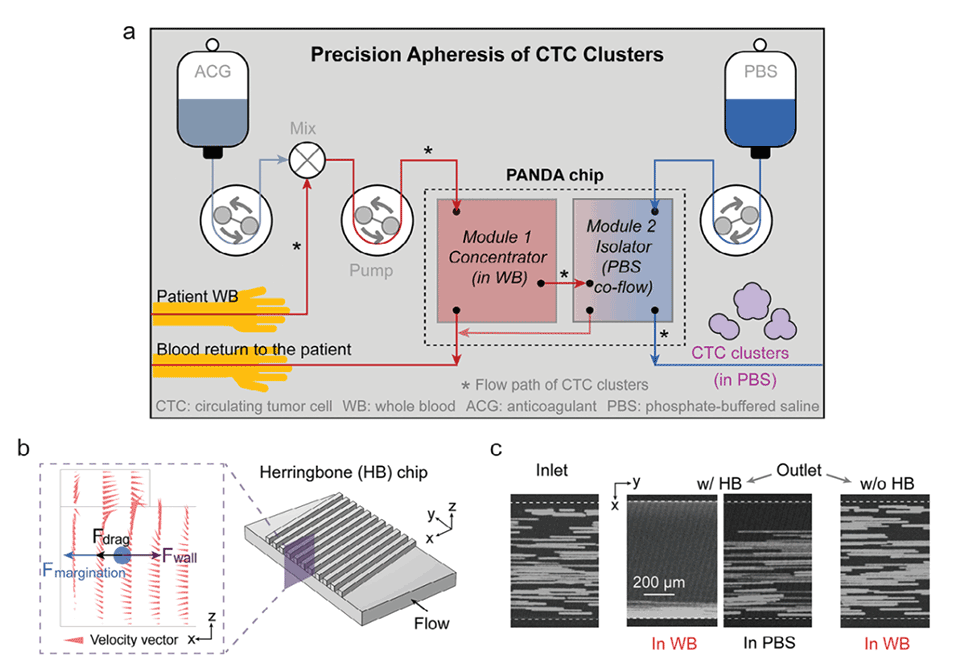
图1.循环肿瘤细胞簇(CTCC)的精确单采。
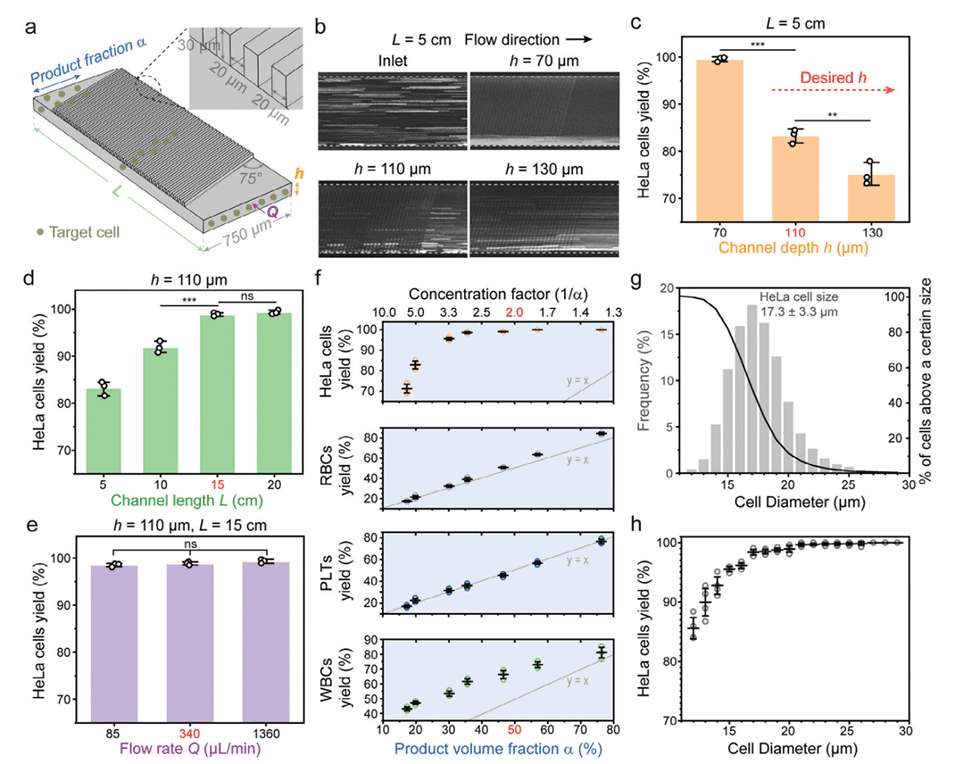
图2.在全血中优化单级浓缩器。
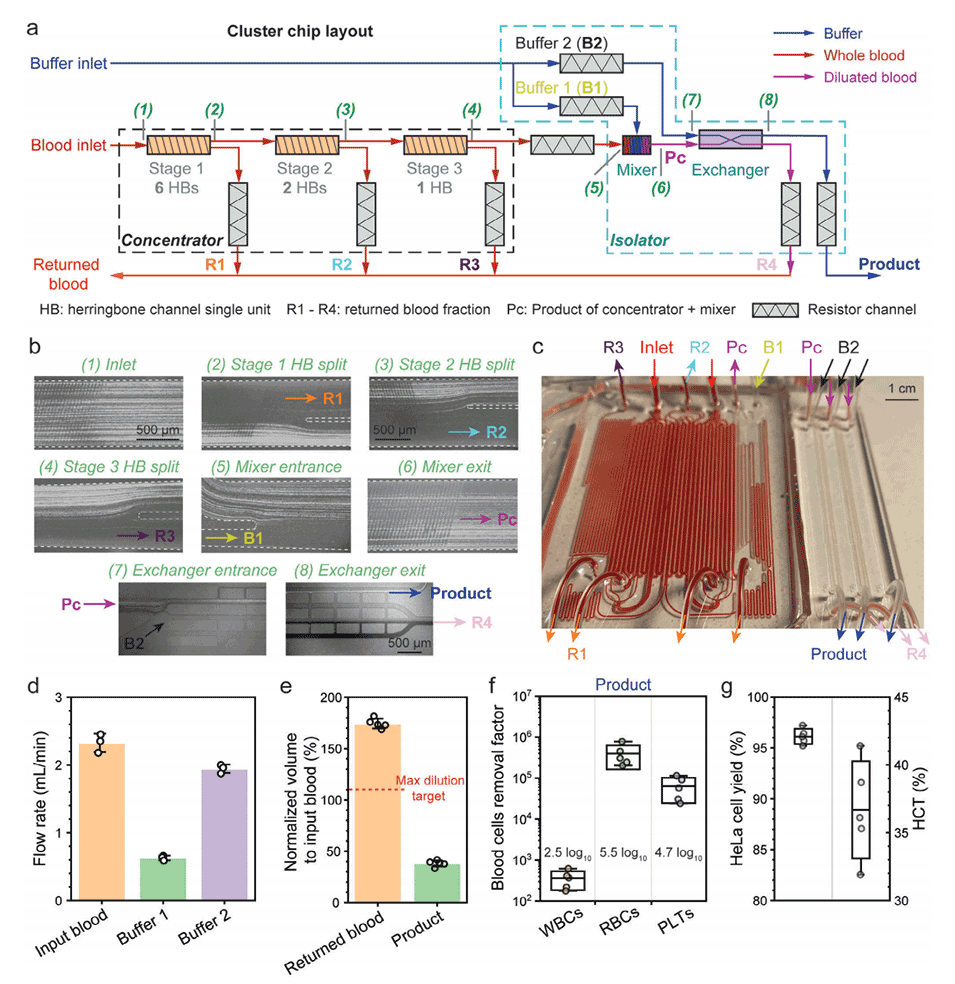
图3.三级浓缩器与分离器的集成。
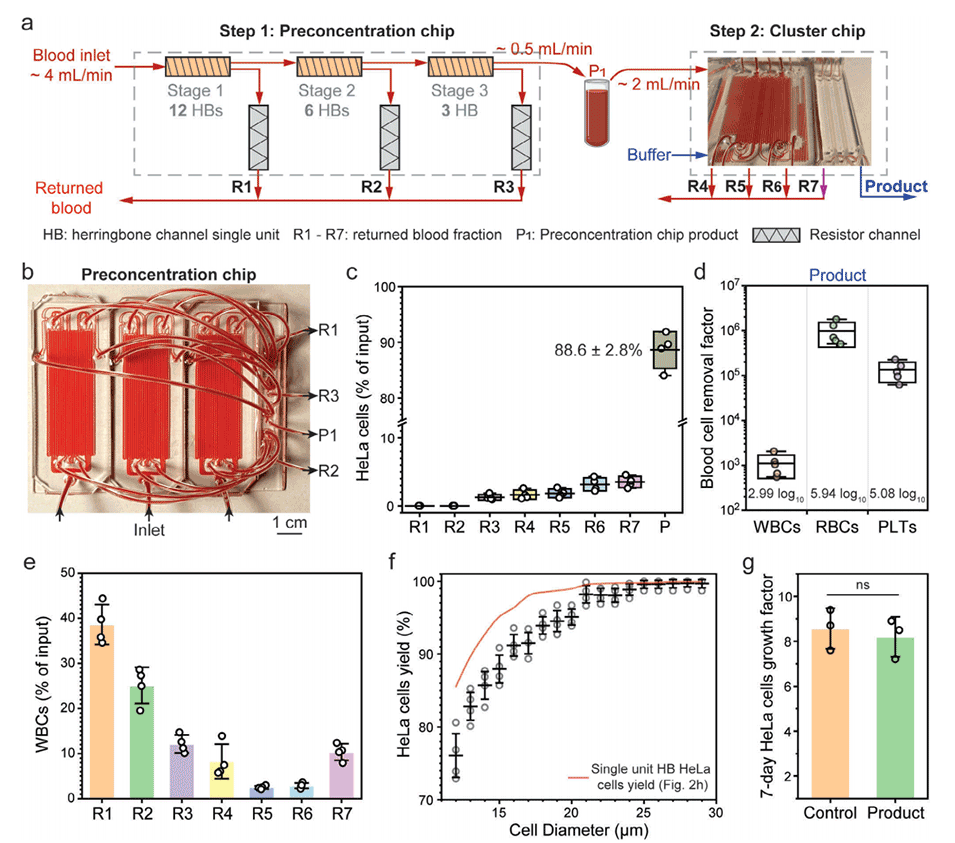
图4.6级浓缩器与分离器的性能。
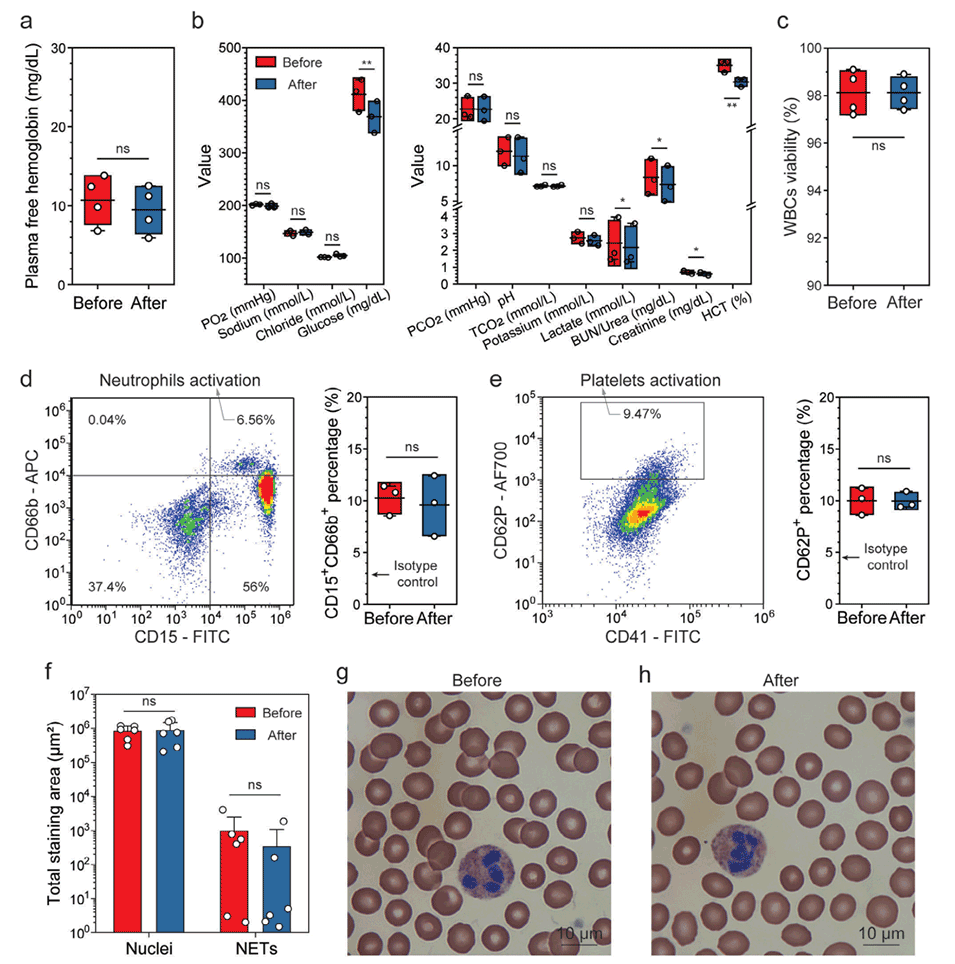
图5.微流控分选前后的体外血液特性评估。
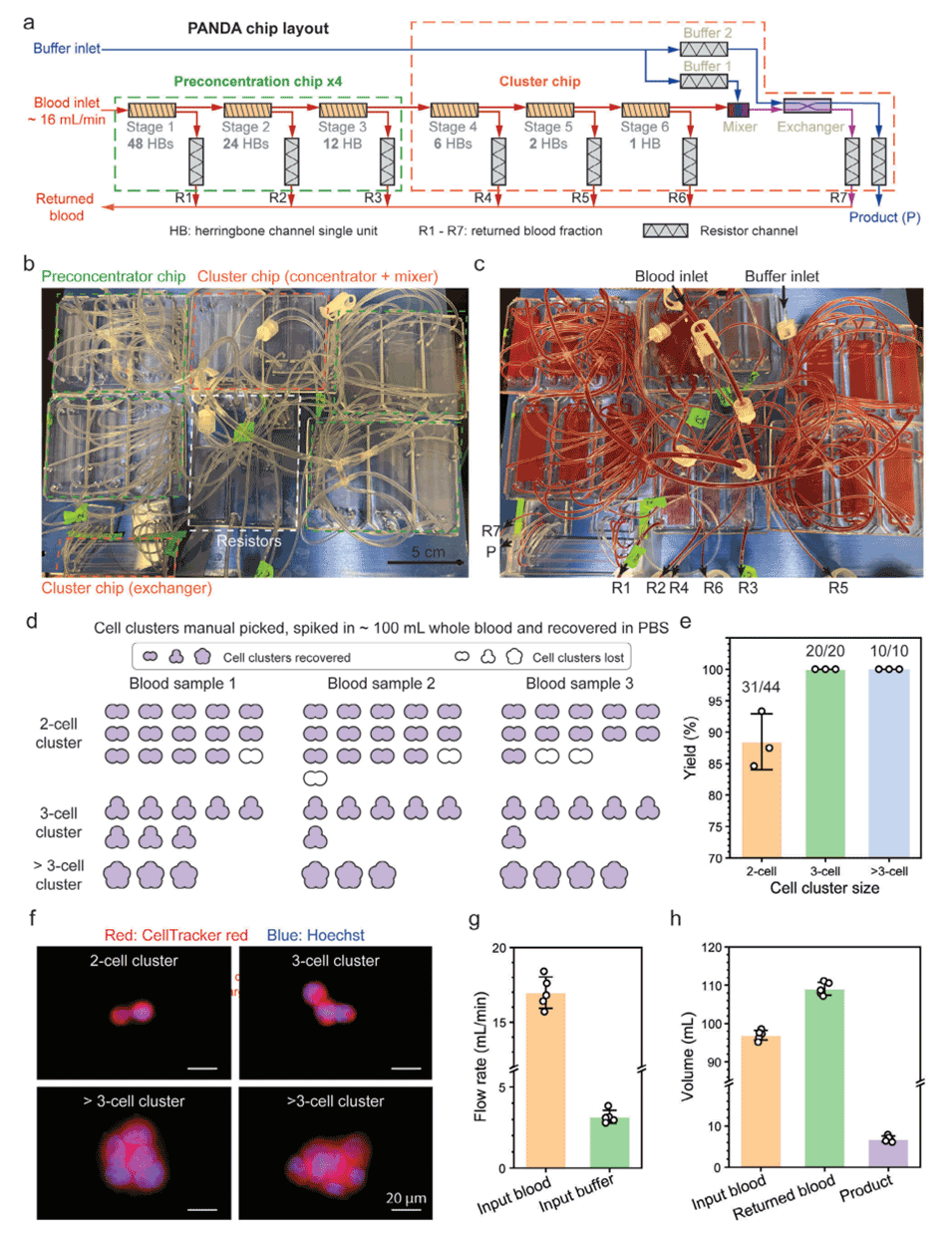
图6.使用PANDA芯片以≈1L/h的速度从全血中连续回收掺入的稀有细胞簇。
原文链接:https://doi.org/10.1002/advs.202405853














