鉴于农药残留对人体健康和生态环境的严重影响,快速、灵敏和便携式的检测方法显得尤为重要。

近期,重庆大学侯长军教授&杨眉副教授团队提出了一种基于三元金属有机框架纳米酶的创新比色传感平台,将其与智能手机和纸基微流控芯片无缝集成,实现了超灵敏、便携和快速的草甘膦(GLY)现场检测。相关研究以“Development of a novel ternary MOF nanozyme-based smartphone-integrated colorimetric and microfluidic paper-based analytical device for trace glyphosate detection”为题目,发表在期刊《Food Chemistry》上。
本文要点:
1、本研究首次报道了一种基于三元金属有机框架(ZnCo-ZIFs@MIL-101(Fe))的新型比色传感平台,实现了对农药草甘膦的超灵敏、可视化和便携式检测。
2、该平台具有0.02~40 μg/ml的宽线性范围和1 ng/ml的检测限,归因于Fe3+、Co2+和Zn2+金属中心的电子杂化,显著增强了复合材料的催化性能。
3、此外,该平台还与智能手机和纸基微流控芯片(μPADs)无缝集成,构建了一种便携式试纸-智能手机传感平台,以实现草甘膦的现场定量检测,理论检测限低至75 ng/ml。
4、该方法在食品和药用植物样品中的应用验证了其可靠性和实用性,为农药残留的现场监测开辟了新的途径。
传统的检测草甘膦的方法,如高效液相色谱(HPLC)、气相色谱(GC)、毛细管电泳(CE)和酶联免疫吸附试验(ELISA)等,虽然可以提供精确的结果,但它们依赖于昂贵的设备、耗时的样品预处理、高昂的检测成本和需要专业技术人员操作,这严重限制了它们在现场检测和实时分析中的应用。
相比之下,本研究提出的基于三元金属有机框架(ZnCo-ZIFs@MIL-101(Fe))的新型检测方法具有以下优势:
1、超高灵敏度:检测限达到1 ng/ml,远低于美国环保局对食品中草甘膦的限量标准(0.05-7 mg/kg)。
2、快速、可视化和便携式:与智能手机和纸基微流控芯片(μPADs)无缝集成,实现了现场定量检测,检测时间短,结果直观。
3、低成本:采用廉价的纸基微流控芯片材料和经济适用的试剂用量,大大降低了检测成本。
4、选择性强:能够有效区分草甘膦和其他干扰物,抗干扰性能优良。
5、实用性强:在蔬菜、水果和中药材等实际样品中的应用验证了该方法的可靠性和实用性。
总之,该新型检测方法克服了传统方法的局限性,为农药残留的现场快速监测提供了一种简单、灵敏、可靠和经济高效的新途径。
该传感平台的工作机制如下:
催化活性:ZnCo-ZIFs@MIL-101(Fe)展现出类过氧化物酶(peroxidase-like)的催化活性,能够催化3,3',5,5'-四甲基联苯胺(TMB)在过氧化氢(H2O2)存在下发生氧化反应,产生蓝色的氧化产物(oxTMB),该产物在652nm波长处有特征吸收峰。
信号变化:当草甘膦(GLY)存在时,它会与ZnCo-ZIFs@MIL-101(Fe)纳米酶发生相互作用,占据活性位点,从而抑制纳米酶的催化活性,导致oxTMB的生成减少,进而使得溶液的颜色变化减弱。
比色检测:通过测量652nm处的吸光度变化,可以定量分析GLY的浓度。随着GLY浓度的增加,溶液的颜色从深蓝色逐渐变浅,通过比色分析可以检测GLY的存在和浓度。
智能手机集成:该平台与智能手机集成,利用手机摄像头捕捉反应溶液的颜色变化,并通过自主研发的“Pesticide Detection”应用程序分析RGB值,将颜色变化转换为数字信号,实现对GLY的半定量分析。
纸基微流控芯片(µPADs):该平台还与纸基微流控芯片集成,构建便携式试纸条-智能手机传感平台,通过在µPADs上的反应区域添加不同浓度的GLY,利用智能手机捕获图像并分析,实现对GLY的现场快速检测。
综上所述,这个传感平台通过纳米酶的催化活性变化和智能手机的颜色识别技术,实现了对草甘膦的灵敏检测,具有成本低、操作简便、检测快速等优点,适用于现场快速检测和食品安全监测。

图1.(A)Zn/Co-ZIFs@MIL-101(Fe)的SEM图像和(B-G)EDS图像;(H)Zn/Co-ZIFs@MIL-101(Fe)与GLY孵育后的SEM图像和(I-O)EDS图像。
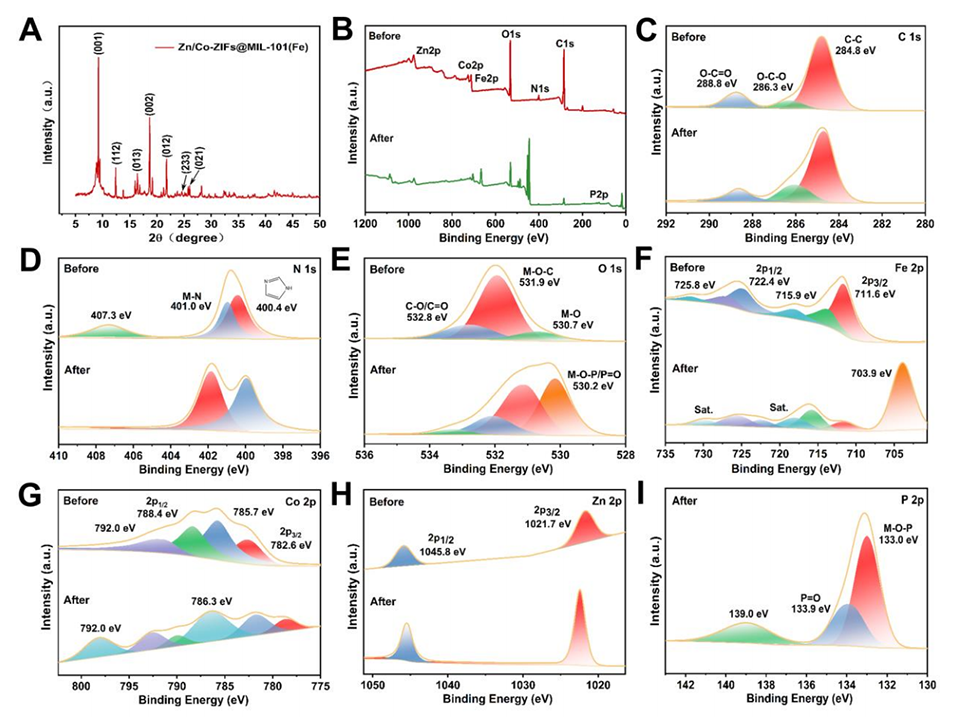
图2.(A)Zn/Co-ZIFs@MIL-101(Fe)与GLY孵育前后的XRD图谱和(B)XPS全扫描光谱,以及(C)C1s、(D)N1s、(E)O1s、(F)Fe2p、(G)Co2p、(H)Zn2p和(I)P2p的高分辨率光谱。
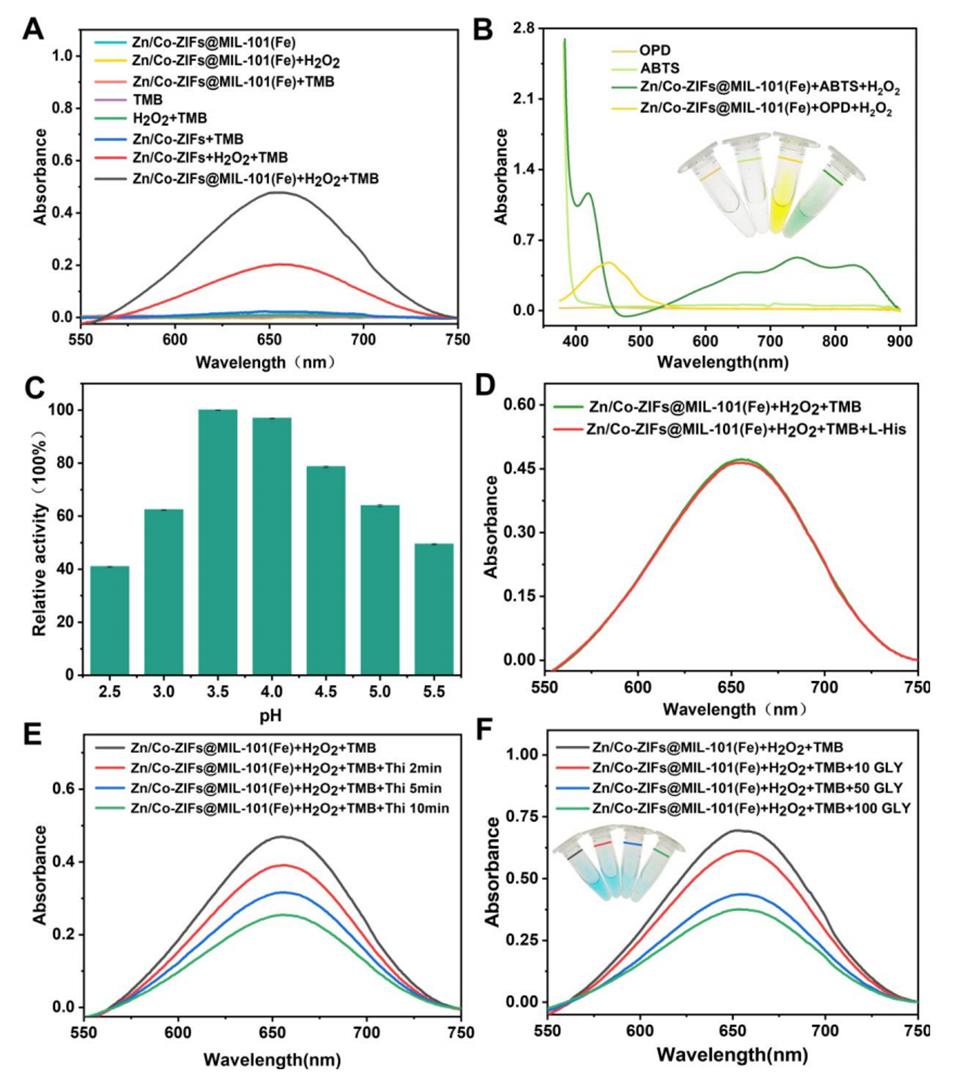
图3.(A)Zn/Co-ZIFs和Zn/Co-ZIFs@MIL-101(Fe)在NaAc-HAc缓冲液、TMB、H2O2和H2O2+TMB+NaAc-Hc缓冲体系中的紫外-可见光谱;(B)H2O2存在下,Zn/Co-ZIFs@MIL-101(Fe)在20mM ABTS和OPD溶液中的紫外-可见吸收光谱,以及仅ABTS和OPND溶液的光谱;(C)在L-His存在或不存在的情况下进行1O2验证试验;(D)硫脲存在或不存在时的·OH验证分析。
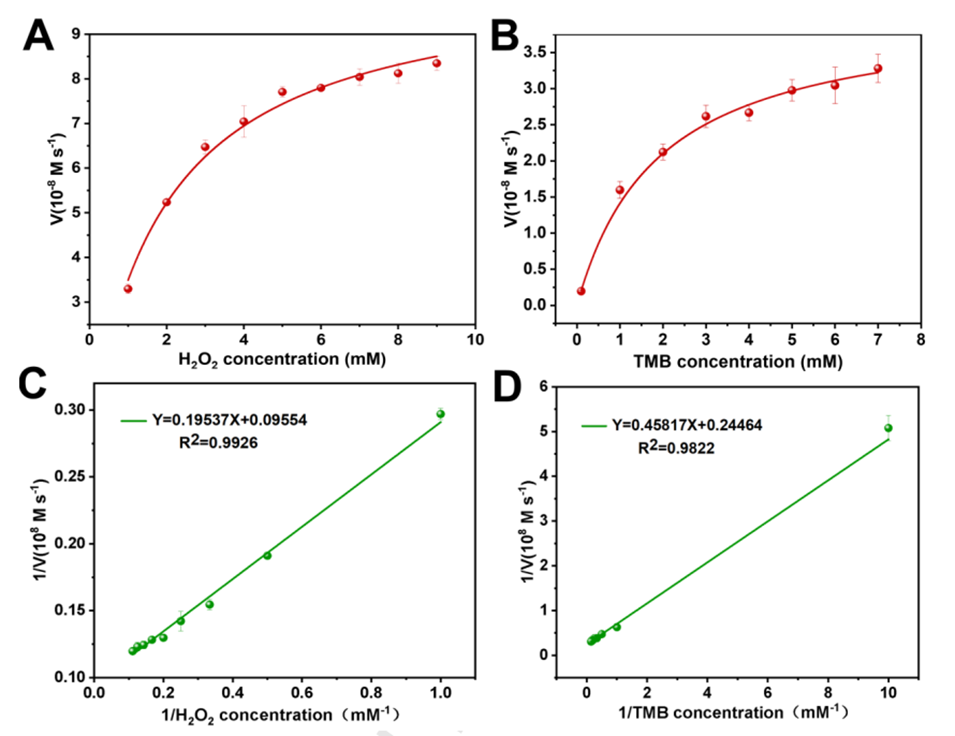
图4.Zn/Co-ZIFs@MIL-101(Fe)对H2O2(A)和TMB(B)的稳态动力学曲线;H2O2(C)和TMB(D)的相应双倒数图。
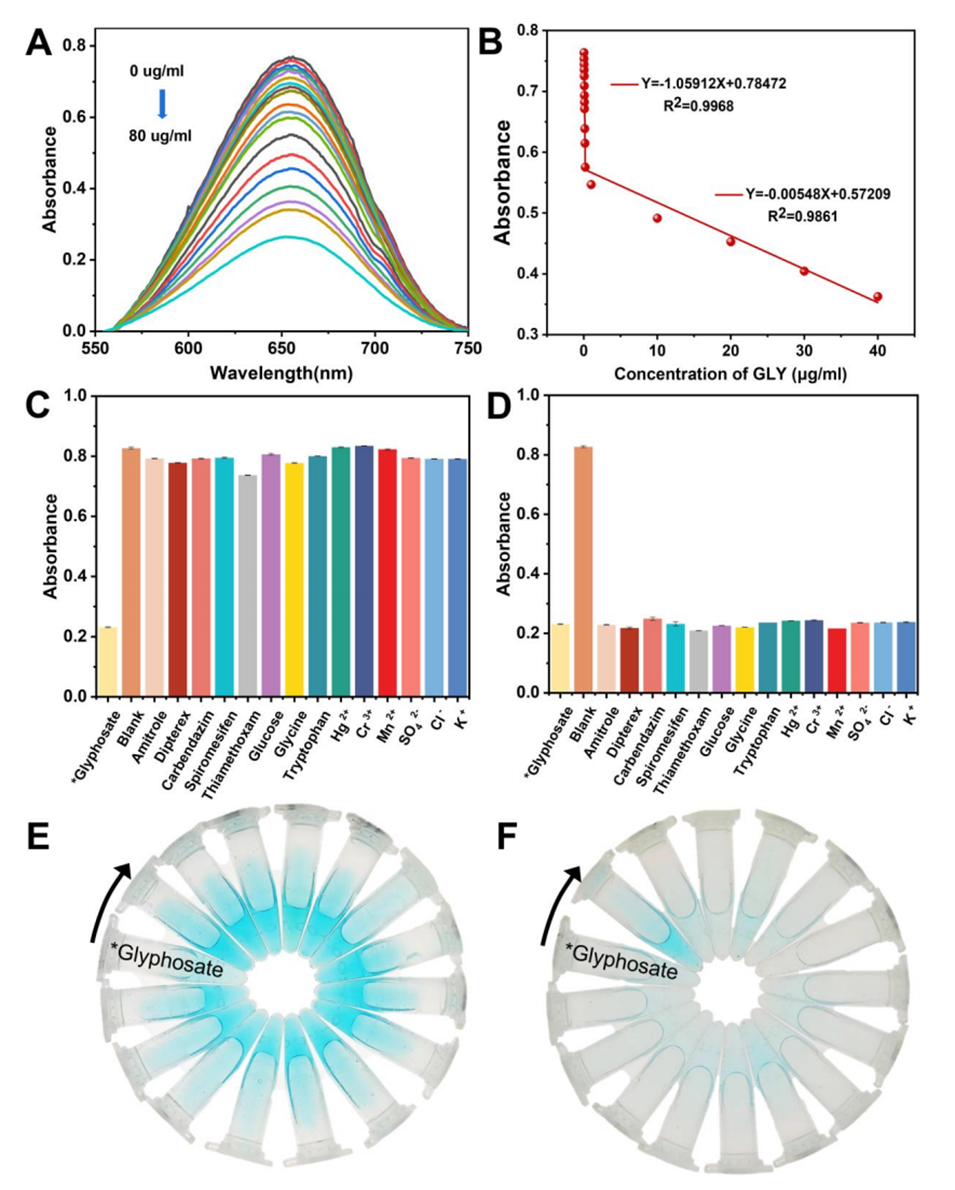
图5.不同浓度的GLY存在下,比色模式Zn/Co-ZIFs@MIL-101(Fe)+H2O2+TMB传感系统的紫外-可见吸收光谱(A)和相应的线性拟合曲线(B);(C)存在GLY等干扰时的直方图和(E)相应的溶液颜色变化;(D)GLY与其他干扰共存时的直方图及(F)对应的溶液颜色变化。
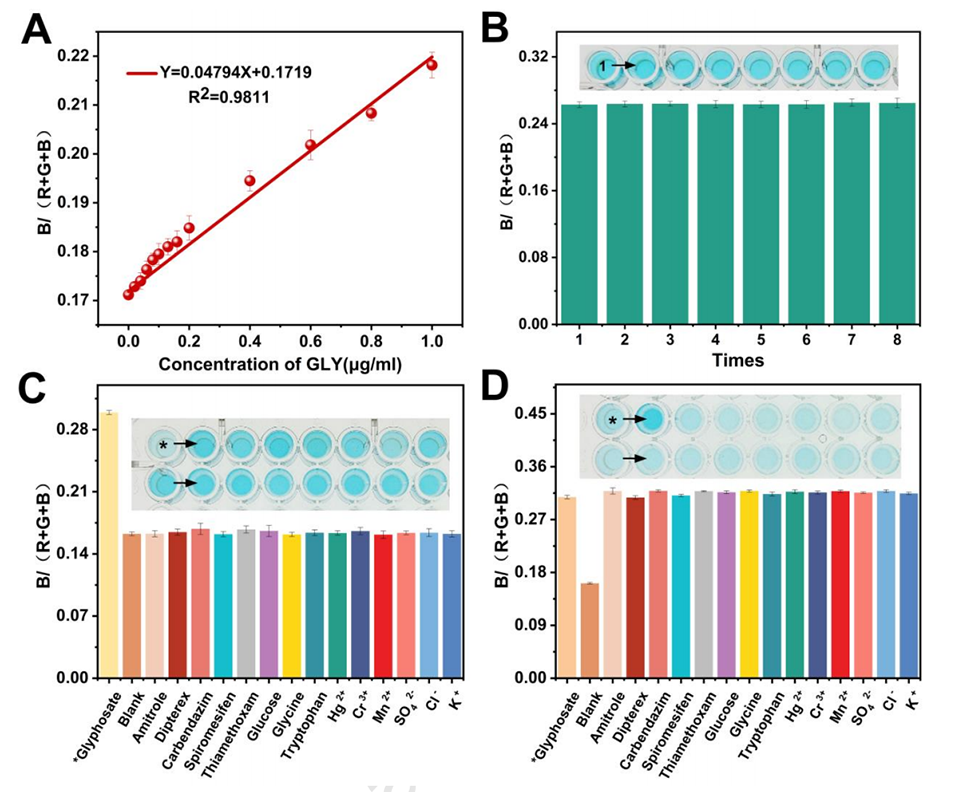
图6.(A)B/(R+G+B)与GLY浓度之间的线性关系;(B)基于Zn/Co-ZIFs@MIL-101(Fe)的智能手机检测技术的再现性;(C)存在GLY等干扰时的直方图和相应溶液颜色变化;(D)GLY与其他干扰共存时的直方图及对应的溶液颜色变化。
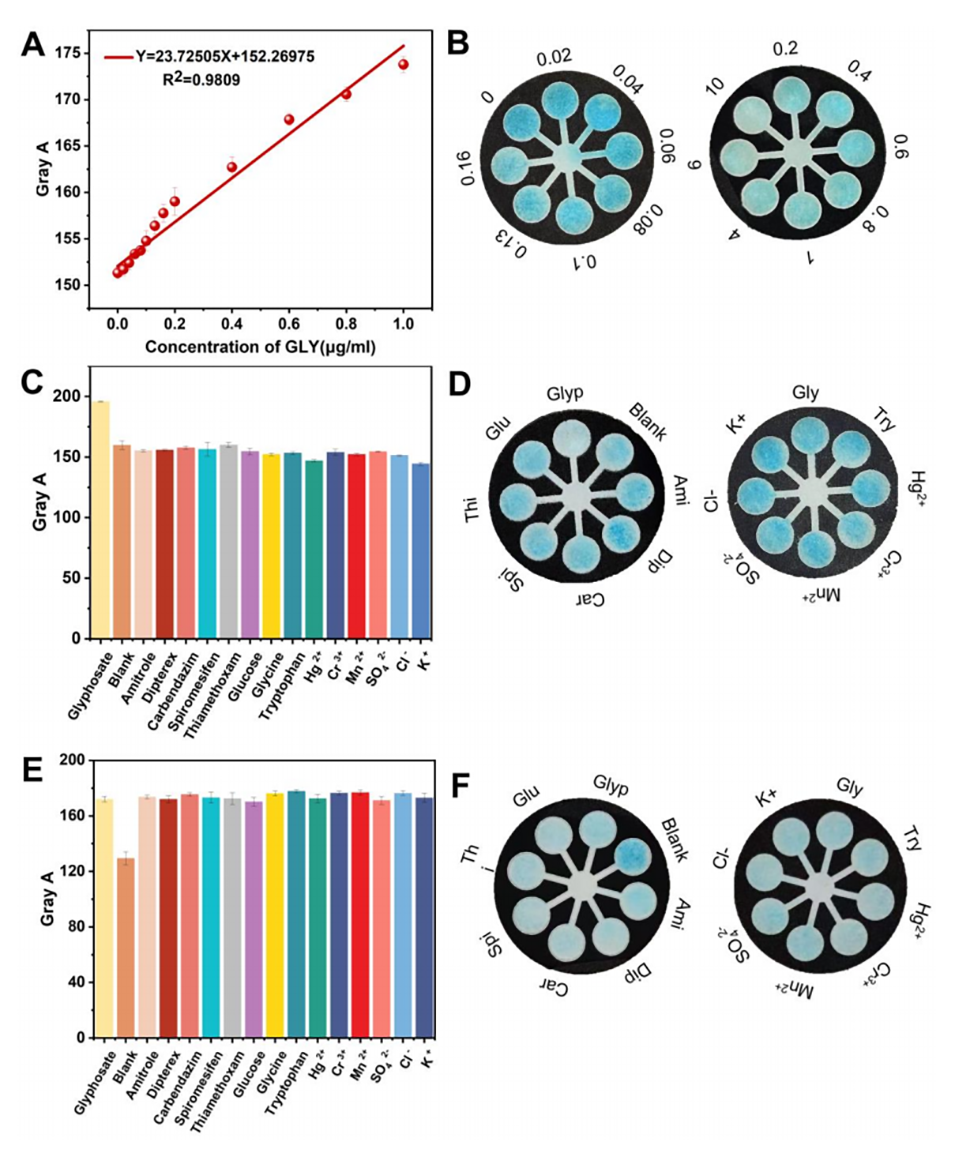
图7.(A)灰度A与GLY浓度之间的线性关系和(B)µPAD检测区的颜色变化图像;(C)µPAD的选择性和(D)µPAD检测区的颜色变化图像;(E)µPAD的干扰和(D)µPAD检测区的颜色变化图像。
论文链接:https://doi.org/10.1016/j.foodchem.2024.141780














