随着益生菌作为功能性食品成分的应用日益增多,如何有效保护益生菌免受不利条件影响并提高其在胃肠道中的活性成为了研究的热点。传统的益生菌包埋方法,如乳化固化、简单凝聚和复合凝聚,存在难以控制尺寸和形态,稳定性和重现性较差等局限性。而新兴的微流控技术以其能够精确控制液滴尺寸和形态、产率稳定和可重复性增强等优势,为制备单分散颗粒提供了新的可能性。

近期,中国海洋大学张兰威教授、林凯副教授等人将半胱氨酸的巯基引入壳聚糖,采用微流控技术制备了单分散性巯基改性壳聚糖微球,通过细菌表面和黏液层的半胱氨酸残基之间的巯基/二硫键交换反应,实现了益生菌粘附和黏液粘附的双重功能。相关研究以“Microfluidic fabrication of encapsulated probiotic microspheres using cysteine-modified chitosan with dual functions of bacterial adhesion and intestinal mucosal adhesion”为题目,发表在期刊《Food Hydrocolloids》上。
本文要点:
1、本研究采用微流控技术制备了包埋益生菌的半胱氨酸修饰壳聚糖微球,旨在提高益生菌在肠道中的粘附性和存活率。
2、通过将半胱氨酸的巯基接枝到壳聚糖上,与细菌表面和黏液层的半胱氨酸残基形成二硫键,实现益生菌粘附和黏膜粘附的双重功能。
3、实验结果表明,两歧双歧杆菌FL-276.1对巯基壳聚糖膜的粘附率比未改性的壳聚糖膜提高了1.33倍。
4、微流控技术制备的半胱氨酸修饰壳聚糖微球粒径分布均匀,对FL-276.1具有较高的包埋效率(80%)及增强的模拟胃肠道消化抗性(存活率高达92%)。
5、采用人结肠上皮细胞系HT-29细胞进一步验证巯基壳聚糖微球的粘附作用。结果表明,巯基壳聚糖微球在HT-29细胞上的粘附数量是壳聚糖微球的2.27倍。
6、该研究为开发具有双重粘附功能的益生菌载体提供了新思路,有望增强益生菌在胃肠道消化和肠道粘附后的存活率和功能。
半胱氨酸修饰的壳聚糖微球能够增强益生菌对肠黏膜的粘附性,主要原因包括以下几点:
1、巯基引入与二硫键形成:通过在壳聚糖上引入巯基(-SH),这些巯基能够与肠道粘液中的富含半胱氨酸的糖蛋白亚基进行巯基-二硫键交换反应,形成稳定的共价键连接。这种化学结合显著增强了益生菌与肠黏膜的粘附能力。
2、双重粘附功能:半胱氨酸修饰的壳聚糖不仅能与肠道粘液中的半胱氨酸残基结合,还能与益生菌表面的半胱氨酸残基结合,从而实现益生菌的双重粘附功能。这种双重粘附机制提高了益生菌在肠道中的定植能力。
3、电位降低与静电相互作用:半胱氨酸修饰能够降低微球表面电位,使其更有利于与带负电的肠黏膜发生静电相互作用,进一步提高粘附能力。
综上所述,半胱氨酸修饰的壳聚糖微球通过化学结合和静电相互作用等多种机制,显著增强了益生菌对肠黏膜的粘附性和定植能力。
使用微流体技术进行益生菌包埋的优势包括:
1、可控的粒子尺寸和形态:微流控方法可以制备出单分散、尺寸可控的载益生菌微球,这是传统包封方法难以实现的。
2、稳定的产率和重复性:与先前的包封方法相比,微流控方法可以提供稳定的产率和增强的重复性。
3、提高益生菌的保护效果:微流控制备的微球可以更好地保护封装的益生菌,抵御胃酸环境和肠道消化酶的破坏,有助于维持益生菌的存活和功能。
4、增强肠道粘附性:通过在微球基质中引入半胱氨酸,微流控方法可以制备出具有黏膜粘附性的载体,增强益生菌在肠道黏膜上的粘附和滞留时间,从而提高其健康效应。
总之,微流控技术为制备具有可控性能、增强保护作用和黏膜粘附能力的益生菌载体提供了一种有效的平台,这对于益生菌的有效递送和功能发挥至关重要。
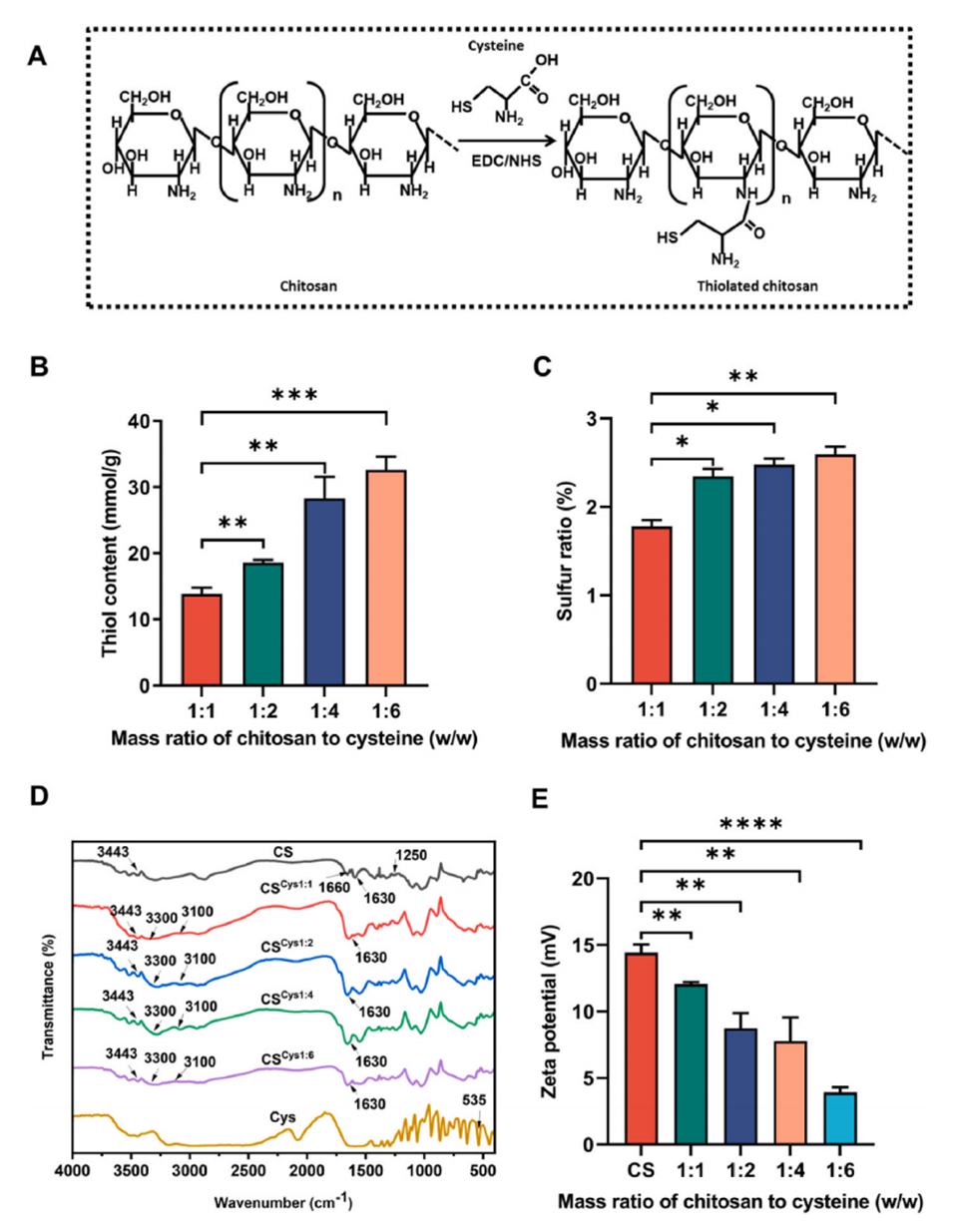
图1.巯基化壳聚糖偶合物的表征。
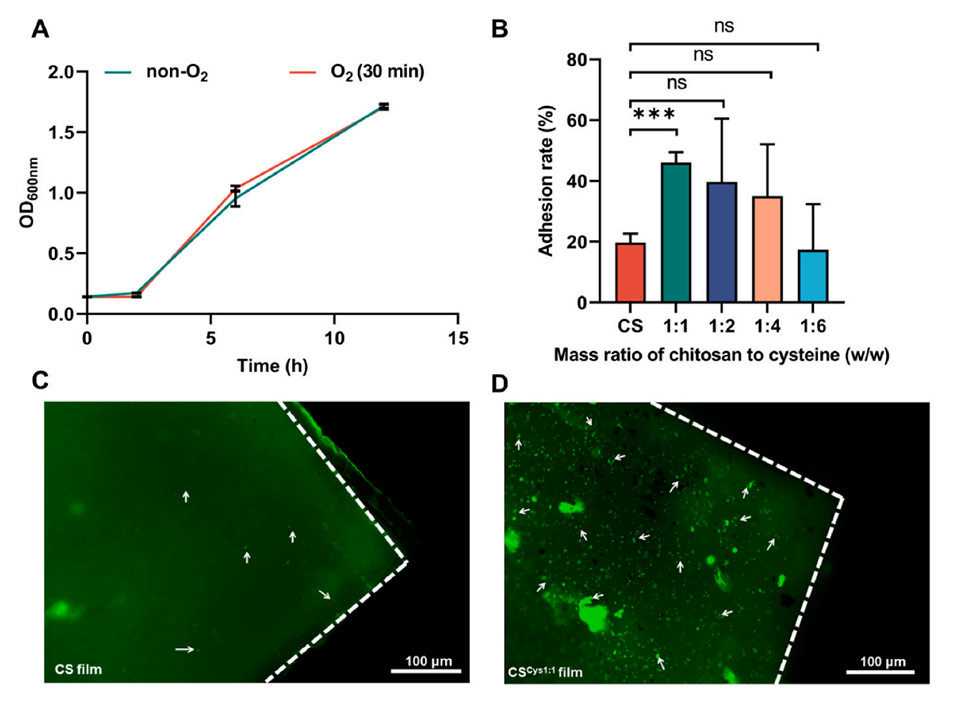
图2.FL-276.1对CSCys1:1薄膜的粘附增强。
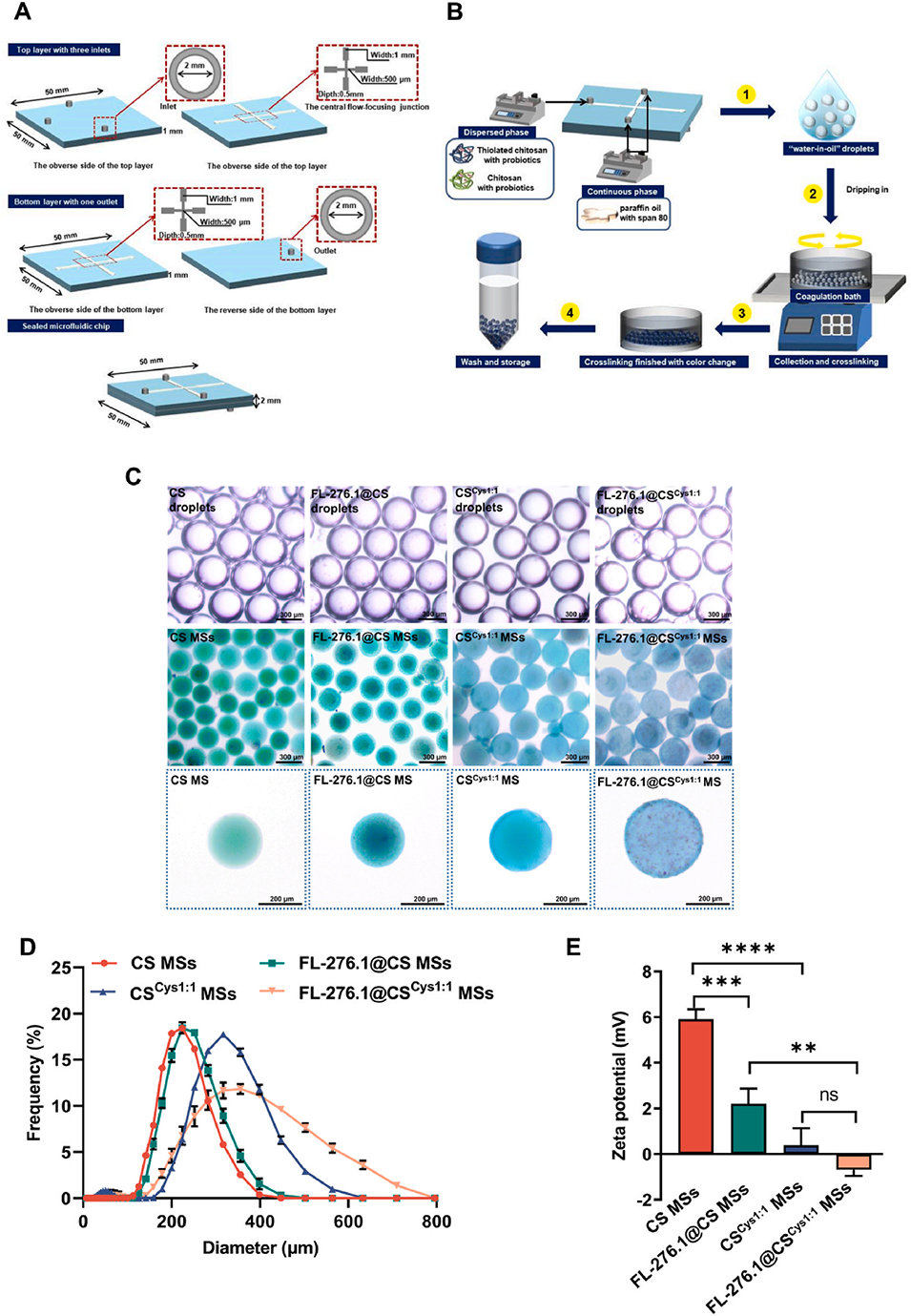
图3.FL-276.1@CS MSs和FL-276.1@CSCys1:1 MSs的表征。
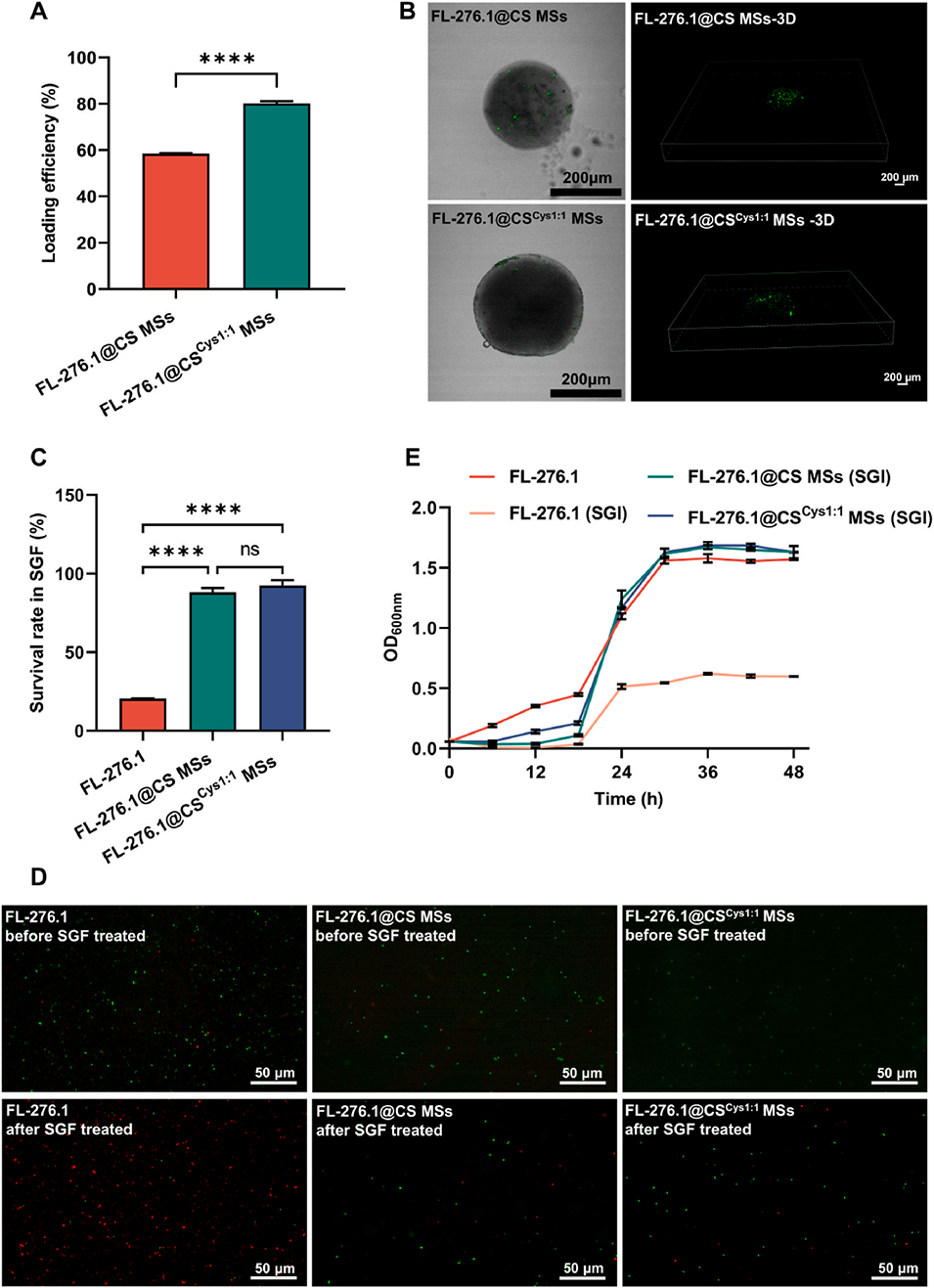
图4.FL-276.1@CS MSs和FL-276.1@CSCys1:1 MSs的封装效率和胃肠道耐受性。
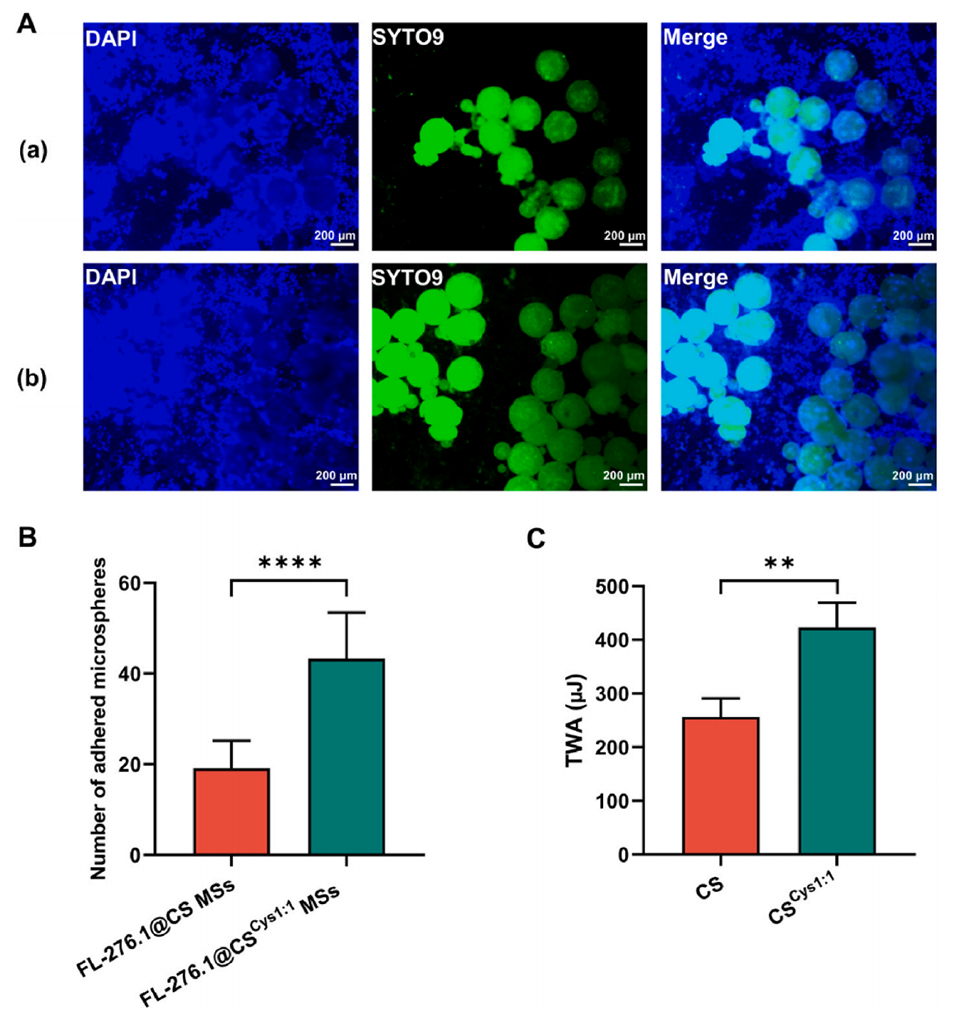
图5.FL-276.1@CS MSs和FL-276.1@CSCys1:1 MSs对人结肠细胞系HT-29细胞和猪大肠组织的体外粘附试验。
论文链接:https://doi.org/10.1016/j.foodhyd.2023.109602














