椎间盘(IVD)变性会导致局部乳酸积累、pH值降低、炎症通路激活,从而破坏椎间盘的稳态。为了解决这些问题,药物的智能和准确释放尤为重要。

近期,南京医科大学附属常州第二人民医院骨科农鲁明、高共鸣等人采用微流控技术开发了一种pH响应性甲基丙烯酸酯化透明质酸(HAMA)微球,能够智能释放IL-1 Ra以调节椎间盘退行性变的炎症微环境,并通过体外和体内实验验证了其在促进椎间盘再生和抑制炎症中的潜力。相关研究以“pH-Responsive Modified HAMA Microspheres Regulate the Inflammatory Microenvironment of Intervertebral Discs”为题目,发表在期刊《ACS Applied Materials & Interfaces》上。
本文要点:
1、本研究利用微流控技术构建了酸敏释放甲基丙烯酸酯化透明质酸(HAMA)微球,通过微球表面的席夫碱化学键合,可作为椎间盘变性 (IVDD) 的靶向药物递送系统,实现智能药物释放。
2、研究中使用的白细胞介素-1受体拮抗剂(IL-1 Ra)是一种天然存在的抗炎拮抗剂,具有出色的广谱抗炎作用,但其生物半衰期较短(4-6小时)。通过使用牛血清白蛋白纳米颗粒(BNP),可以显著改善IL-1 Ra的缓释性能。
3、改性的HAMA微球具有良好的可注射性和多孔性,通过席夫碱键实现了纳米颗粒的高效均匀负载。
4、通过将改性HAMA微球-BNPs(改性MS)转运到退行性髓核,可以显著逆转炎症微环境,证实了其作为IVDD靶向给药系统的巨大潜力。
HAMA微球在椎间盘退变药物递送中具有以下优势:
1、良好的生物相容性:HAMA作为一种天然聚合物,具有优良的生物相容性和生物降解性,能够减少对周围组织的免疫反应,适合用于生物医学应用。
2、高效的药物负载能力:通过席夫碱化学键合,HAMA微球能够有效负载抗炎药物和纳米颗粒,确保药物在目标部位的高浓度释放,提高治疗效果。
3、优异的注射性和孔隙率:HAMA微球具有良好的注射性,便于通过微创手术直接注入到椎间盘退变部位。同时,其多孔结构有助于药物的均匀分布和持续释放。
4、pH响应性释放:HAMA微球能够根据椎间盘退变过程中局部酸性环境的变化,智能调节药物释放。这种pH响应性确保了药物在炎症微环境中能够持续释放,从而有效抑制炎症反应。
5、促进组织再生:HAMA微球不仅递送药物,还能够通过促进椎间盘细胞增殖和细胞外基质(ECM)合成来帮助恢复椎间盘的功能和结构,这对于延缓退变进程和促进组织修复具有重要意义。
IL-1受体拮抗剂(IL-1 Ra)在治疗椎间盘退变(IVDD)中发挥着重要作用,主要体现在以下几个方面:
1、抗炎作用:IL-1 Ra是一种天然的细胞因子受体拮抗剂,能够特异性地结合IL-1受体,阻断IL-1β的活性。IL-1β是椎间盘退变中主要的促炎细胞因子,通过抑制IL-1β,IL-1 Ra能够减弱炎症级联反应,降低局部炎症。
2、恢复微环境平衡:椎间盘退变会导致炎症微环境的形成,破坏细胞外基质(ECM)的合成与降解平衡。IL-1 Ra通过抑制炎症介质的表达,促进ECM成分(如II型胶原蛋白和聚糖)的合成,从而帮助恢复椎间盘的结构和功能。
3、减少细胞凋亡:在酸性炎症环境中,椎间盘细胞(NPCs)容易发生凋亡。IL-1 Ra能够显著降低由炎症引起的细胞凋亡,促进细胞存活,从而支持椎间盘的再生。
4、持续释放机制:IL-1 Ra被包裹在具有pH响应特性的改性HAMA微球中,这种微球能够在酸性环境中智能释放IL-1 Ra,从而实现局部高浓度的释放,显著增强其治疗效果。
5、调节氧化应激:IL-1 Ra还可以通过抑制活性氧(ROS)的产生,降低氧化应激,从而减轻细胞损伤和退变。
综上所述,IL-1 Ra通过抑制炎症、促进ECM合成、减少细胞凋亡和调节氧化应激等多种机制,为椎间盘退变的治疗提供了有效的策略。
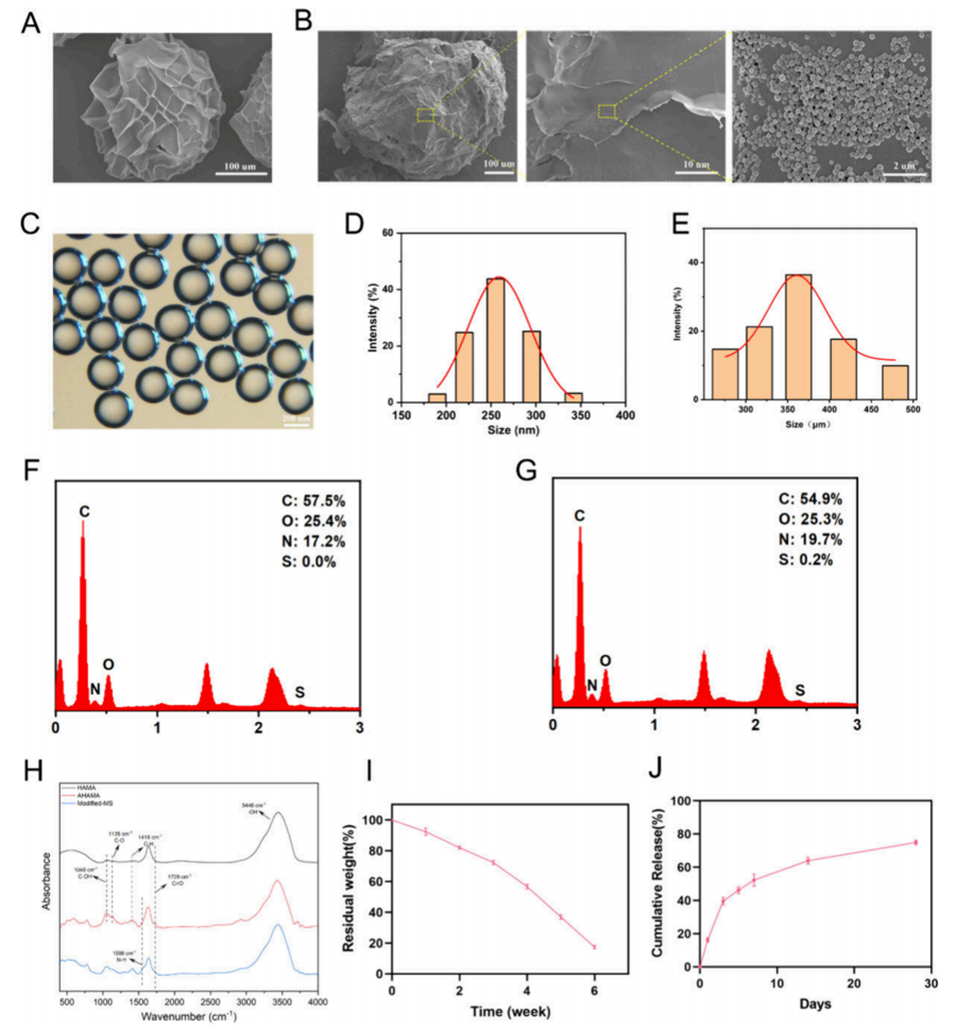
图1.改性MS的表征。
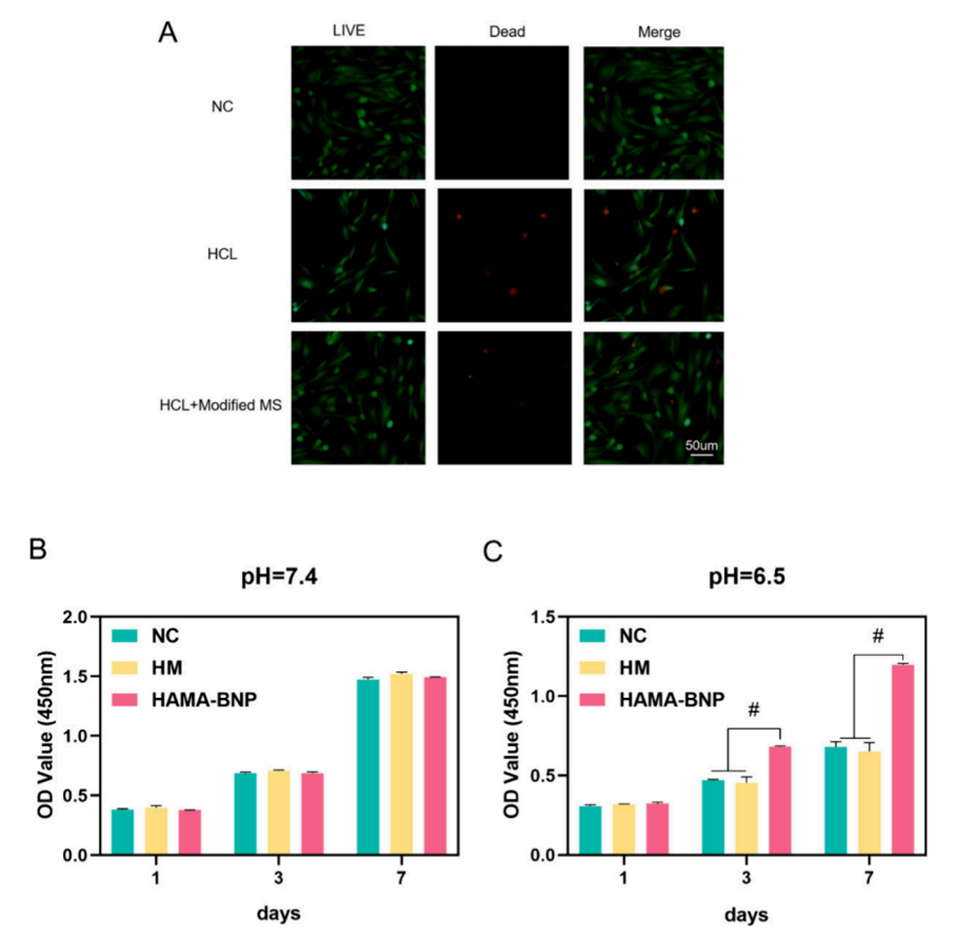
图2.改性MS的生物相容性。
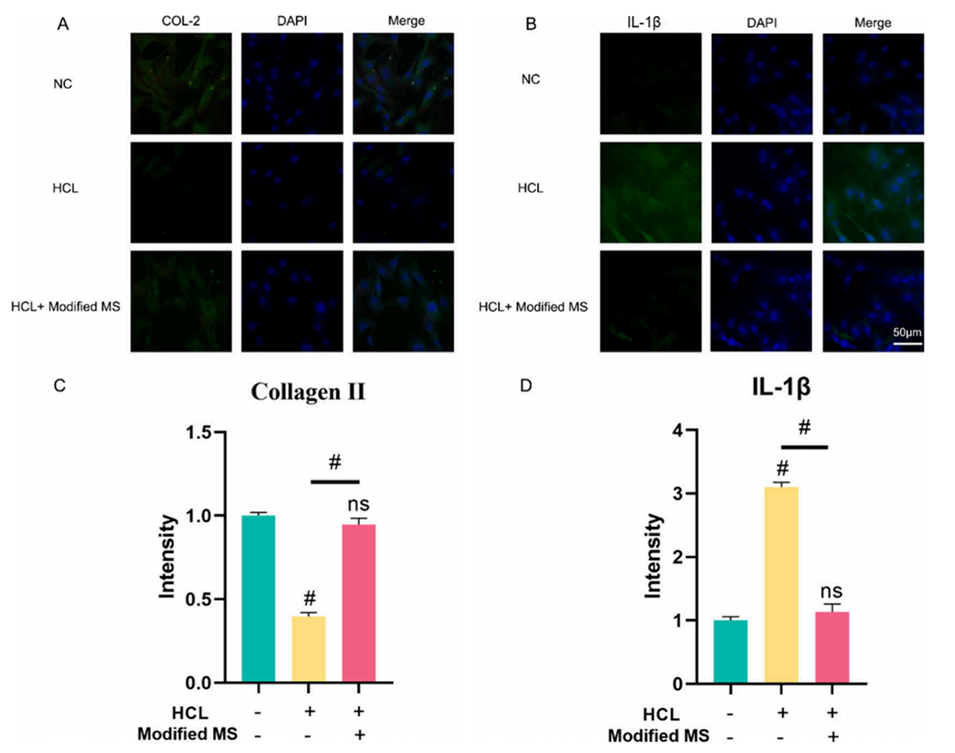
图3.细胞免疫荧光分析。
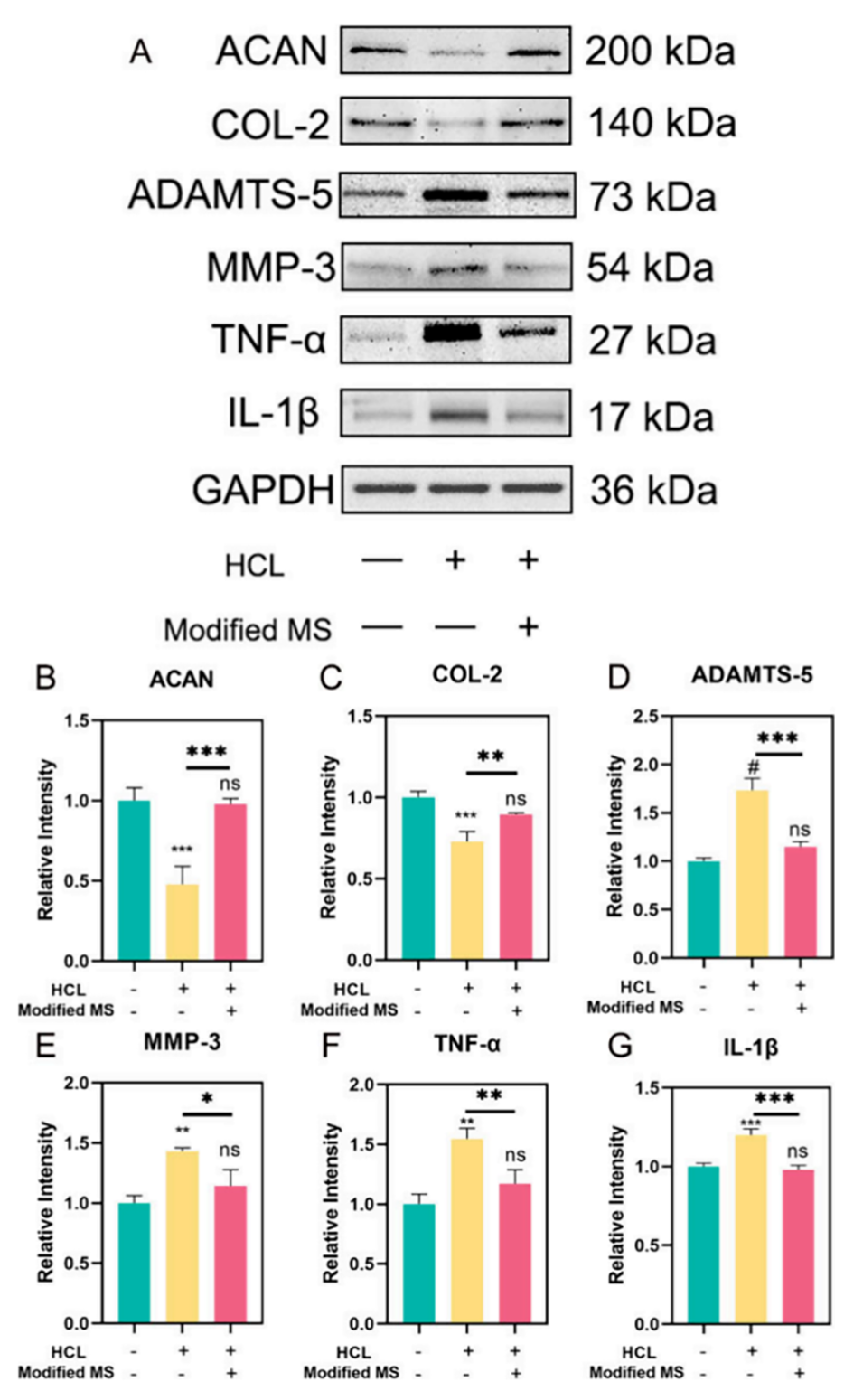
图4.酸性细胞外微环境中的蛋白质表达。
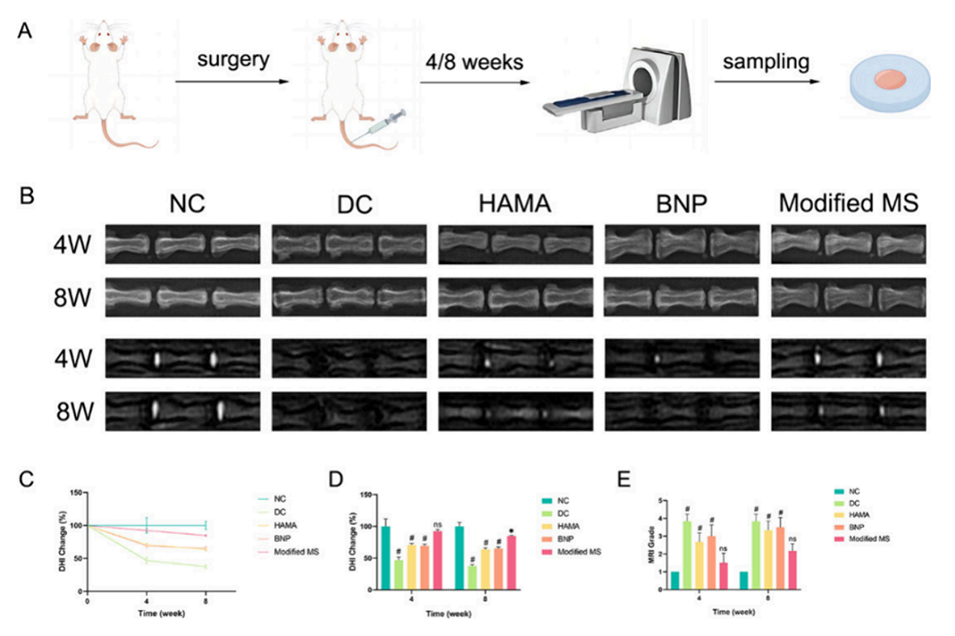
图5.动物实验的放射学数据。
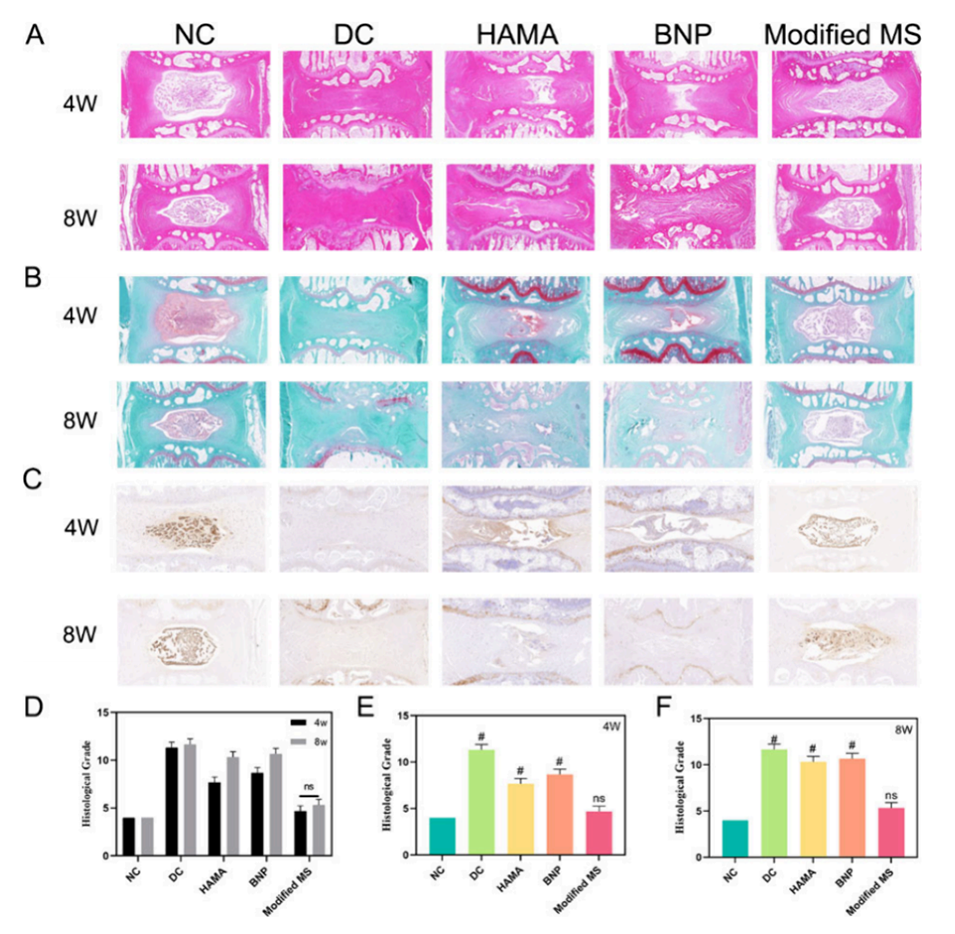
图6.动物实验的组织学评估。
论文链接:https://doi.org/10.1021/acsami.4c14475














