背景:
骨关节炎(OA)是一种常见的慢性退行性关节疾病,全球约7%的人口受到影响,是老年人致残的主要原因之一。随着人口老龄化和肥胖问题的加剧,OA的发病率逐年上升。其主要特征是关节软骨退化,并伴随滑膜炎症,其中由M1型巨噬细胞介导的炎症被认为是推动病情发展的关键因素。
目前,针对OA的非手术治疗主要依赖非甾体抗炎药,但其在减缓疾病进展方面效果有限。近年来,组织工程材料和间充质干细胞(MSC)疗法在调节滑膜炎症和促进细胞治疗方面显示出一定潜力。然而,现有治疗仍面临挑战,包括为募集的细胞提供适宜的附着和生长环境,以及减轻关节炎症对细胞治疗的影响。因此,亟需开发能够同时减轻炎症并在体内募集MSC的新型生物材料。

导读:
近期,苏州市立医院郝跃峰教授等人设计了一种基于微流控技术的可注射多孔微球,通过调节炎症和募集MSCs,有效促进OA关节软骨的修复。相关研究以“Injectable microspheres filled with copper-containing bioactive glass improve articular cartilage healing by regulating inflammation and recruiting stem cells”为题目,发表在期刊《Regenerative Biomaterials》上。
本文要点:
1、本研究设计了一种基于微流控技术的可注射多孔微球(PM),由聚乳酸-乙醇酸共聚物、Kartogenin(KGN,一种小分子化合物,是促进多能间充质干细胞分化为软骨细胞的强效诱导剂)、聚多巴胺、基质细胞衍生因子-1和掺铜生物活性玻璃(CuBG)组成。
2、体外实验表明,PMs@CuBG微球具有良好的生物相容性,可通过释放CuBG将滑膜巨噬细胞从促炎M1型转化为抗炎M2型,减轻关节炎症。
3、同时,微球可招募间充质干细胞(MSCs)至关节腔并促进其分化为软骨细胞,从而修复关节软骨损伤。
4、大鼠体内实验结果表明,PMs@CuBG注射可改善OARSI评分、聚集蛋白聚糖含量及Col-2α阳性细胞比例,表明其对受损软骨具有修复作用。
可注射微球(PMs@CuBG)的关键组成成分包括:
聚乳酸-乙醇酸共聚物(PLGA)——作为微球的基材,具有良好的生物相容性和机械强度。
Kartogenin(KGN)——一种小分子,促进MSCs向软骨细胞的分化。
聚多巴胺(PDA)——用于在微球表面形成薄膜涂层,增强微球的稳定性和药物负载能力。
基质细胞衍生因子-1(SDF-1)——一种趋化因子,帮助招募MSCs至损伤部位。
掺铜生物活性玻璃(CuBG)——通过调节炎症和促进巨噬细胞从促炎性(M1型)向抗炎性(M2型)极化,改善关节的炎症环境,促进软骨愈合。
这些成分协同作用,旨在改善骨关节炎的治疗效果。
PMs@CuBG微球的制备过程主要包括以下几个步骤:
1、制备CuBG(铜掺杂生物活性玻璃):
将CuCl2-2H2O溶解在去离子水中,加热至80°C并搅拌1小时,加入L-抗坏血酸溶液,反应24小时。
使用微乳液辅助的溶胶-凝胶技术制备MBGNs(主要含SiO2和CaO的生物玻璃)。
将Cu/抗坏血酸复合物加入到MBGNs的混合物中,搅拌后离心,用去离子水/乙醇洗涤并干燥。
将粉末在700°C下煅烧4小时,得到CuBG。
2、制备微球:
利用微流体系统,通过水包油包水(W/O/W)乳化技术制备微球。
准备2% wt PLGA-二氯甲烷溶液,并与KGN按9:1的质量比混合,然后与7.5% wt明胶水溶液按3:1的比例混合,经超声乳化处理得到内相。
1% PVA溶液作为外相,内相和外相以1:40的流速比通过毛细管释放,收集微球,经过过夜搅拌、水浴和过滤等步骤,得到PLGA基微球。
3、微球功能化:
将微球浸泡在含有SDF-1(基质细胞衍生因子-1)的PDA(聚多巴胺)溶液中过夜,形成多孔微球(PMs),此处选择2mg/ml的PDA溶液。
将PMs与浓度为5 mg/ml的CuBG混合,通过氢键将CuBG附着在微球表面,形成PMs@CuBG。
4、微球的冻干和表征:
将PMs@CuBG微球进行冻干处理,以便于后续的物理化学表征和实验研究。冻干后的微球可用于分析其形态、粒径、孔径及药物释放特性等。
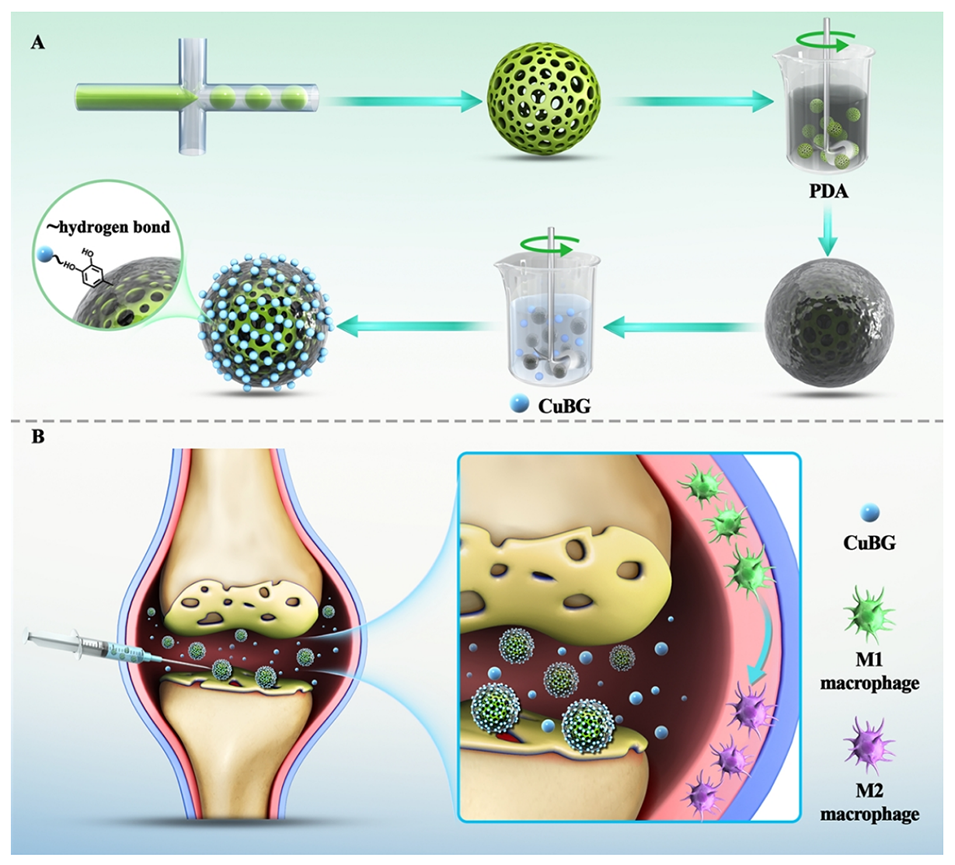
图1.(A)PMs@CuBG的制备,(B)PMs@CuBG治疗骨关节炎的示意图。
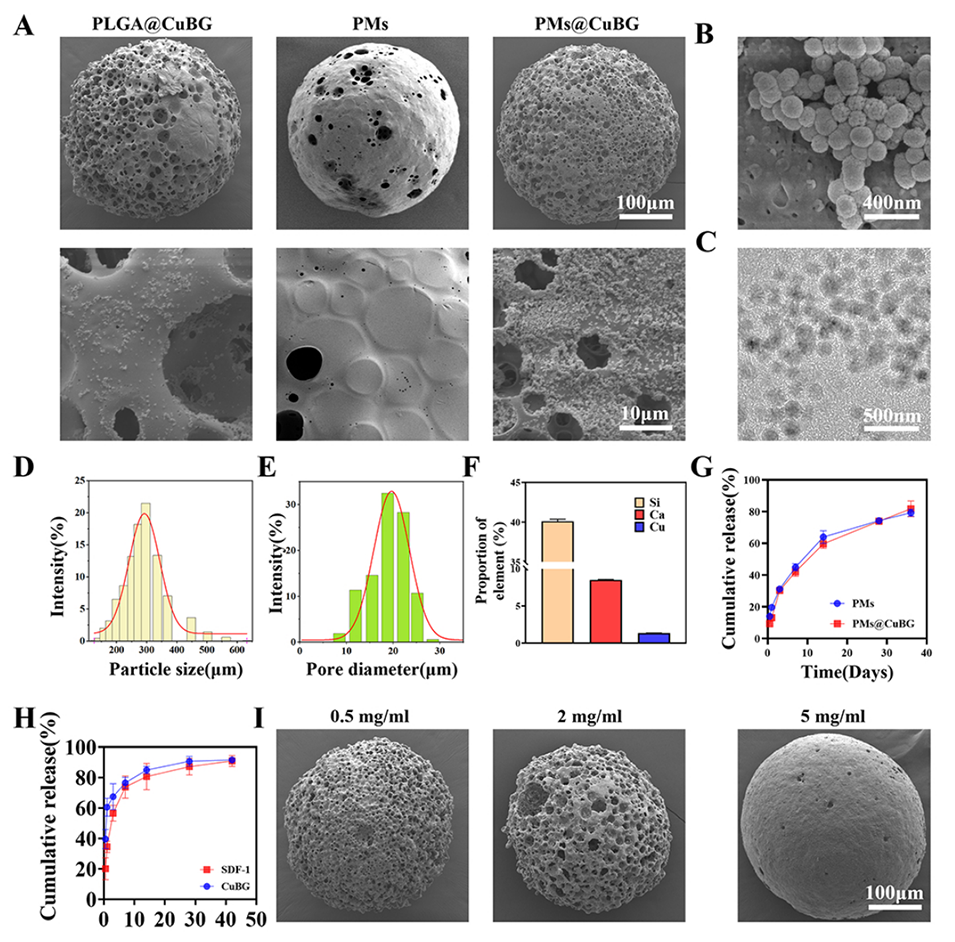
图2.微球的表征。(A)PLGA@CuBG、PMs和PMs@CuBG的SEM图像。(B)PMs@CuBG的表面SEM图像。(C)CuBG的TEM图像。(D)PMs@CuBG的粒径分析。(E)PMs@CuBG的孔径分析。(F)PMs和PMs@CuBG的元素分析。(G)PMs和PMs@CuBG的KGN释放曲线。(H)PMs@CuBG中SDF-1和CuBG的释放曲线。(I)不同PDA浓度下PMs@CuBG涂层的SEM图像。
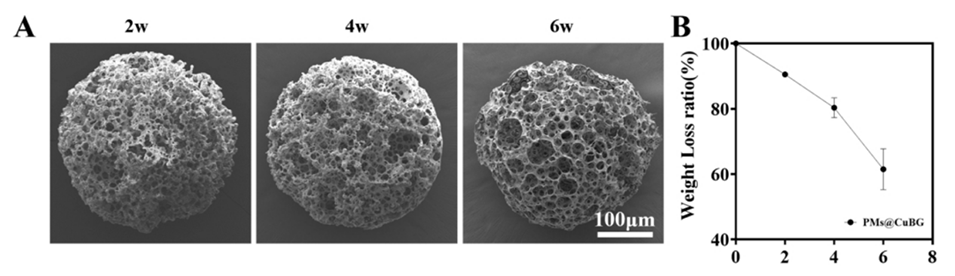
图3.(A)PMs@CuBG微球降解的SEM图像。(B)PMs@CuBG的剩余质量变化(n=3)。
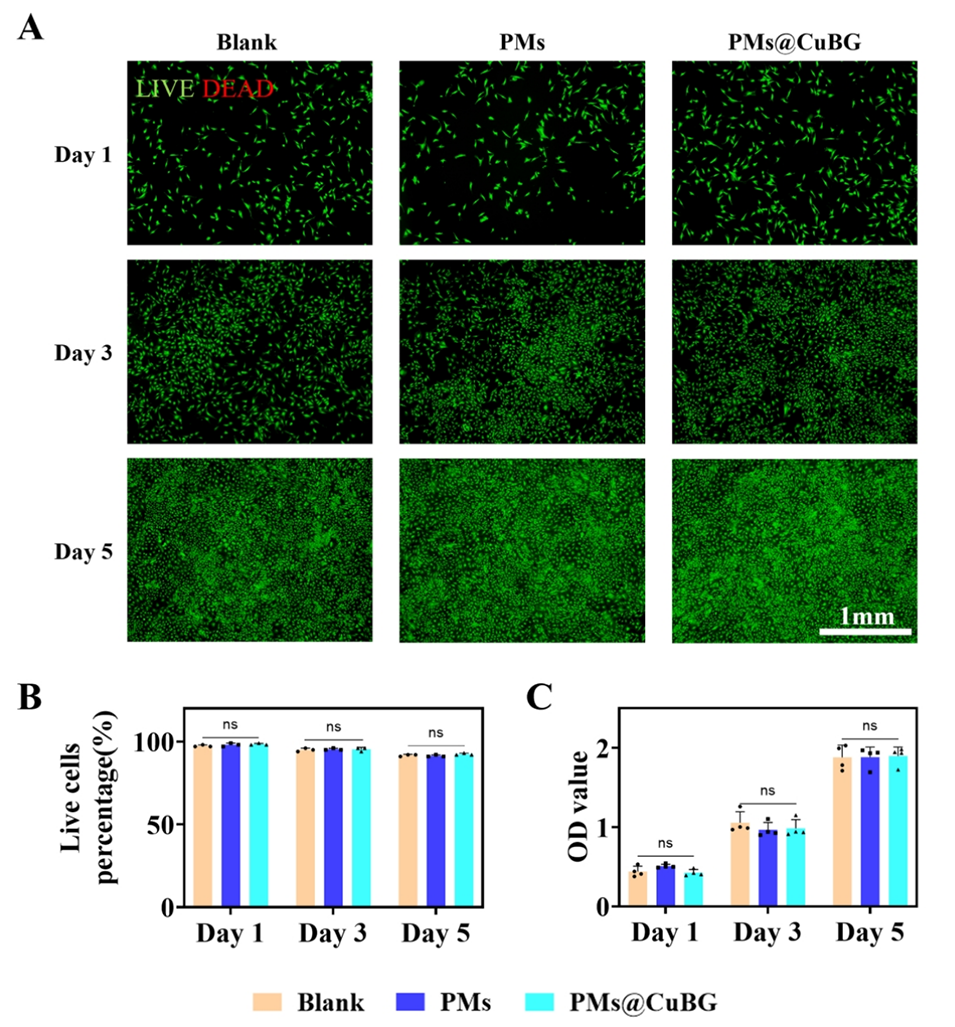
图4.微球的生物相容性。(A)Blank、PMs和PMs@CuBG组在1、3和5天的活(绿)/死(红)细胞荧光结果。(B)SMSCs的CCK-8实验结果(n=3)。(C)从活/死染色实验中获得的活细胞百分比(n=4)。
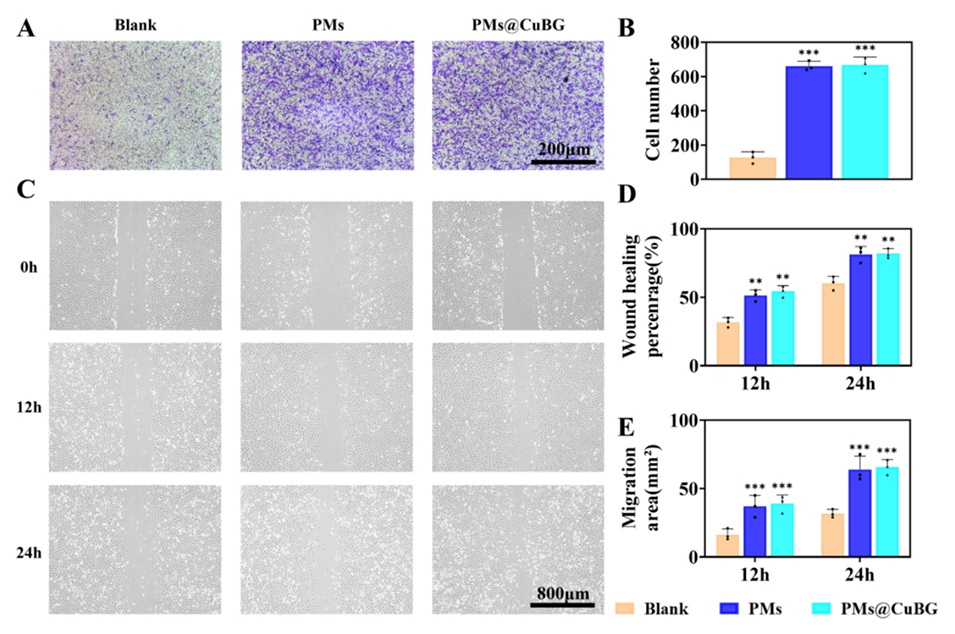
图5.微球对细胞迁移的影响。(A)光学显微镜代表性图像显示细胞从上腔迁移。(B)24小时培养后迁移细胞的数量(n=3)。(C)划痕实验中0、12小时和24小时的代表性光学显微镜图像。(D)不同组的划痕愈合百分比分析和(E)迁移面积分析(n=3)。
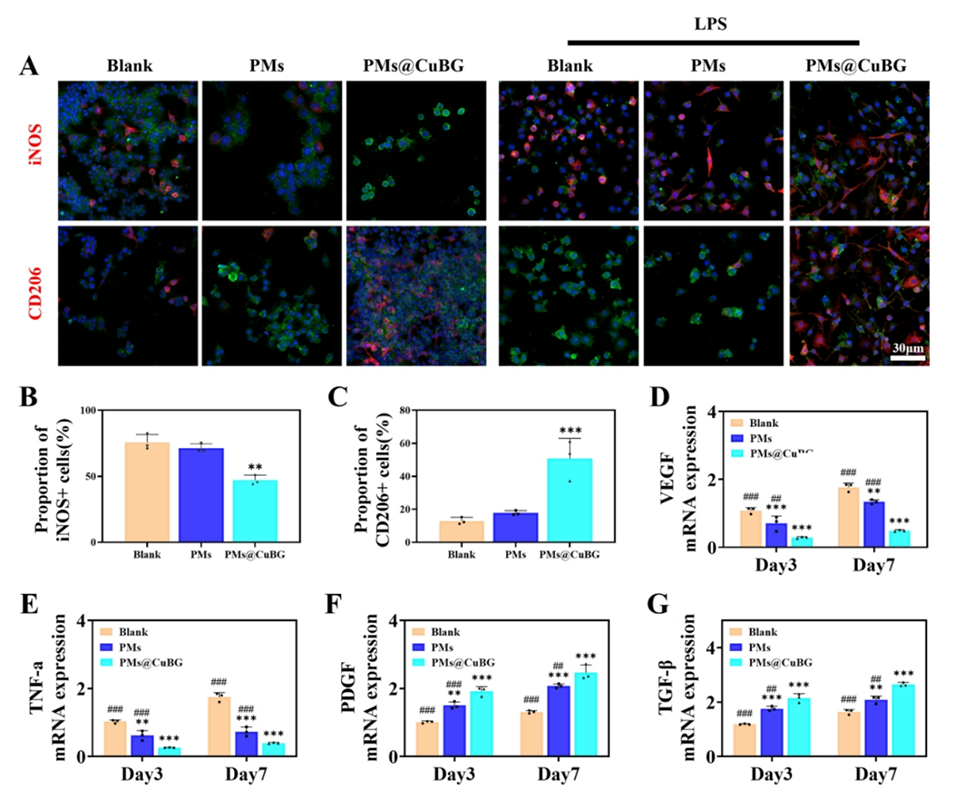
图6.微球对巨噬细胞的影响。(A)iNOS和CD206的免疫荧光染色。(B)iNOS和(C)CD206的阳性率统计(n=3)。(D)VEGF、(E)TNF-α、(F)PDGF和(G)TGF-β的mRNA表达分析(n=3)。
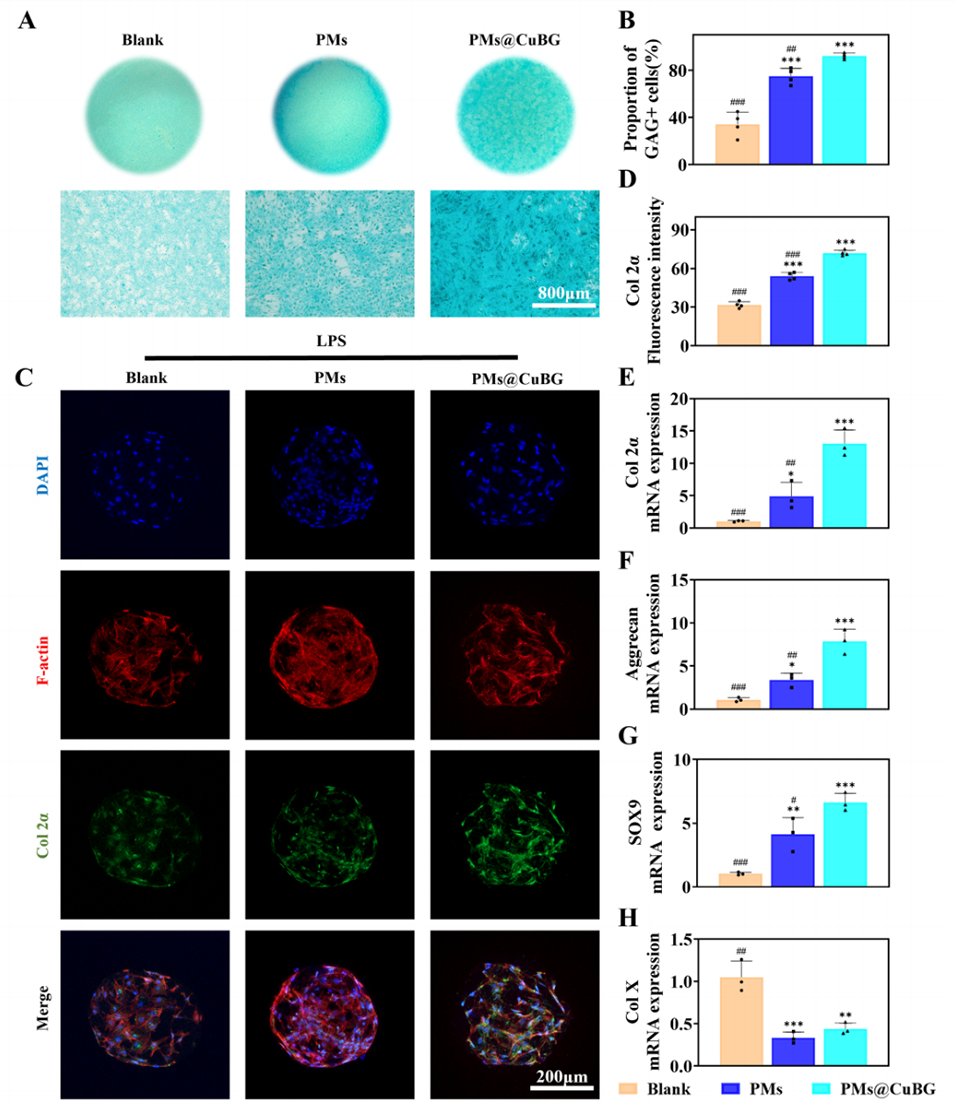
图7.微球促进软骨分化功能。(A)经过2周软骨生成培养的阿利新蓝染色代表性图像。(B)GAG+阳性率统计(n=3)。(C)Col 2α免疫荧光强度的定量分析(n=3)。(D)SMSCs负载微球在第21天的Col 2α染色。(E-H)21天共培养后软骨形成相关基因(Col 2α、Aggrecan、SOX9)和肥大基因胶原X的相对mRNA表达(n=3)。
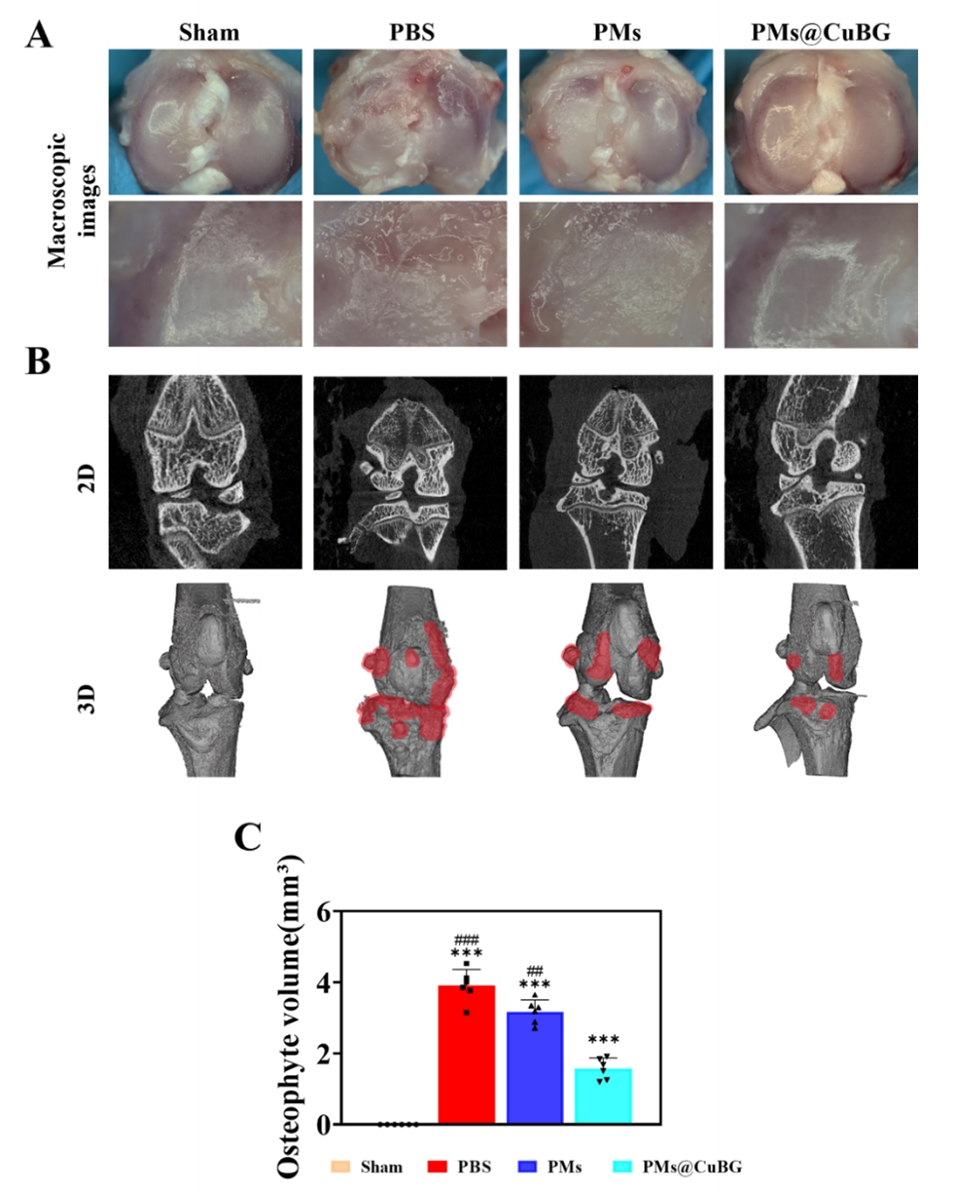
图8.PMs@CuBG治疗体内骨关节炎模型的性能。(A)大鼠膝关节的宏观观察。(B)术后6周大鼠膝关节的2D和3D CT图像。(C)术后6周总骨赘的相对体积(n=6)。
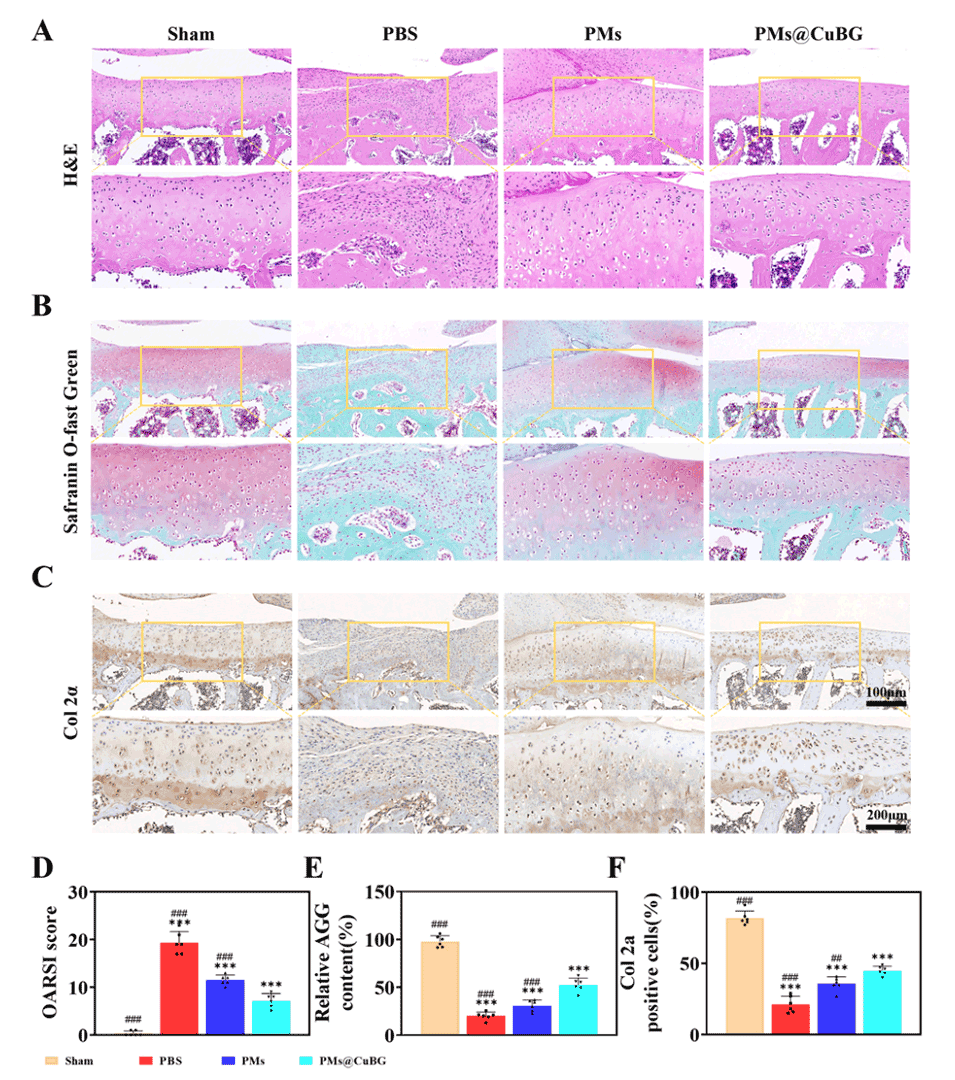
图9.PMs@CuBG治疗体内骨关节炎模型的性能。(A)组织切片的H&E染色图像。(B)组织切片的番红O-固绿染色图像。(C)Col 2α免疫组化染色图像。(D)OARSI评分(n=6)。(E)Aggrecan的相对含量(n=6)。(F)Col 2α阳性细胞的定量(n=6)。
论文链接:
https://doi.org/10.1093/rb/rbae142














