背景:
糖尿病是一种以高血糖为特征的代谢疾病,主要由于胰岛素分泌缺陷或胰岛素作用受损。传统的治疗方法是皮下注射胰岛素,但频繁的注射可能导致局部感染、脂肪沉积和患者不适,从而影响治疗效果。近年来,研究者们探索了包括口服在内的替代给药途径,口服给药因其易用性、低毒副作用和良好的患者依从性而受到关注。然而,口服胰岛素仍面临诸多挑战,包括胰岛素在低pH环境下的不稳定性和在胃肠道中被酶降解的风险。

导读:
近期,山东大学机械工程学院满佳教授团队提出一种基于双乳液液滴制备高球形度海藻酸钙微球的方法,旨在开发一种用于口服胰岛素的药物递送系统。通过调整流速和收集液中钙离子浓度,可以控制微球的尺寸和球形度。研究显示,负载胰岛素的海藻酸钙微球经口服给药后能有效降低小鼠的血糖水平,证明其作为pH敏感药物递送系统的适用性。相关研究以“Fabrication of Ca-alginate microspheres by diffusion-induced gelation in double emulsion droplets for oral insulin”为题目,发表在期刊《International Journal of Biological Macromolecules》上。
本文要点:
1、本文提出了一种以海藻酸钠为最内相,基于双乳液滴液制备高球形度海藻酸钙微球的新方法,用于口服胰岛素的递送。
2、通过调节体系密度使双乳液液滴悬浮在收集液中,实现海藻酸钠液滴与钙离子的均匀反应。
3、通过改变流速可调节滴液尺寸,改变收集液中钙离子浓度可改变微球的球形度。
4、负载胰岛素的海藻酸钙微球在模拟胃液中释放缓慢,在模拟肠液中释放加速,表现出pH响应性。将壳聚糖涂覆在微球表面可进一步延缓药物释放。
5、动物实验结果表明,壳聚糖-海藻酸钙微球能够有效降低糖尿病小鼠的血糖水平,为口服胰岛素的应用提供了新的策略。
海藻酸钙微球作为药物递送载体具有以下优势:
1、良好的生物相容性和生物降解性。海藻酸钠是从褐藻中提取的天然多糖,具有良好的生物相容性,可以安全地用于生物医用领域。海藻酸钙微球在体内可以被逐步分解代谢,避免了长期残留的问题。
2、对药物的保护作用。海藻酸钙微球的内部结构可以有效保护药物免受胃酸和肠道酶的降解,提高药物的稳定性和生物利用度。
3、可控的药物释放特性。通过调节微球的尺寸、形状和内部结构,可以实现对药物释放速率和释放时间的精细调控,实现pH响应性的缓释或快释。
4、良好的流动性。高球形度的海藻酸钙微球具有较好的流动性,有利于药物制剂的加工和给药。
5、提高肠道吸收。在微球表面涂覆壳聚糖可以增强与肠道细胞的粘附性,促进药物在肠道的吸收,从而提高口服生物利用度。
总之,海藻酸钙微球作为药物递送载体具有良好的生物相容性、对药物的保护作用、可控释放特性等诸多优势,为口服胰岛素等生物大分子药物的应用提供了新的策略。
钙离子浓度对微球球形度的影响如下:
低钙离子浓度(5 wt%)时,微球内部结构较为松散,在干燥过程中容易发生变形,表面呈现明显的皱褶。这是由于低钙离子浓度下,微球内部孔隙差异较大,导致干燥过程中内部应力分布不均,从而引起微球变形。
中等钙离子浓度(5 wt%)时,微球内部结构较为均匀致密,在干燥过程中能够较好地保持球形。这是因为中等钙离子浓度下,微球内部孔隙尺寸差异较小,干燥过程中内部应力分布相对均匀,从而使微球能够维持良好的球形。
高钙离子浓度(5 wt%和10 wt%)时,微球表面形成了一层致密的外壳,但内部结构相对较松散。这是由于高钙离子浓度下,钙离子首先与表面反应形成了一层致密的外壳,阻碍了钙离子进一步向内部扩散,导致内部结构相对松散。在干燥过程中,内外结构差异较大,也会引起微球发生变形。
综上所述,中等钙离子浓度(5 wt%)下制备的微球具有最佳的球形度,这是由于在该浓度下微球内部结构相对均匀致密,能够较好地保持球形。而低浓度和高浓度下制备的微球则容易发生变形,球形度较差。
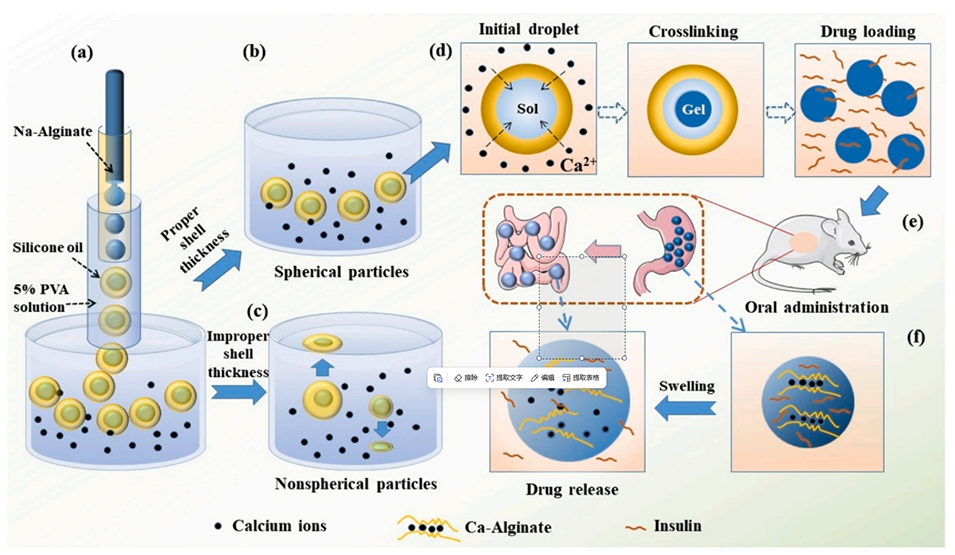
图1.基于双乳液液滴模板制备口服胰岛素用高球形度海藻酸钙微球的示意图。

图2.用于制备双乳液液滴的微流体系统。

图3.(a)通过微流体装置制备双乳液液滴;(b)收集溶液中单分散双乳液的光学显微照片。比例尺为500μm;(c)高球形度海藻酸钙微球。比例尺为200μm。
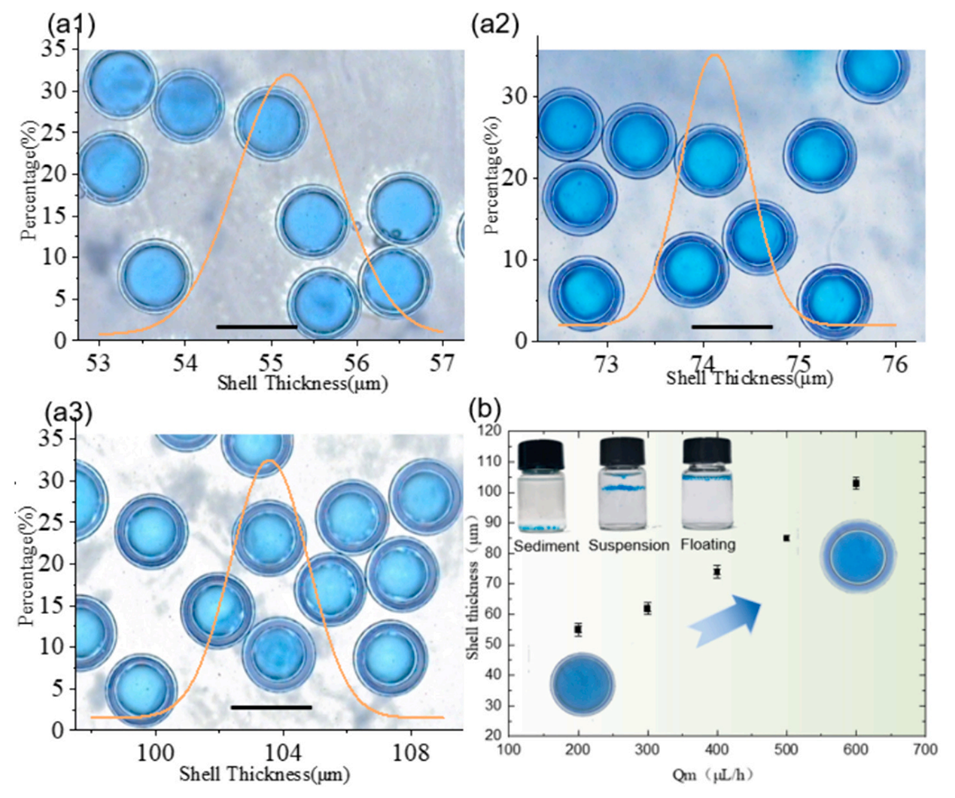
图4.(a)通过固定内外相流速并改变中间相流速(Qm),可以获得不同厚度的液滴壳层。比例尺为500μm。(a1)Qm=0.2 mL/h;(a2)Qm=0.4 mL/h;(a3)Qm=0.6mL/h;(b)油膜厚度与中间相流速之间的关系。
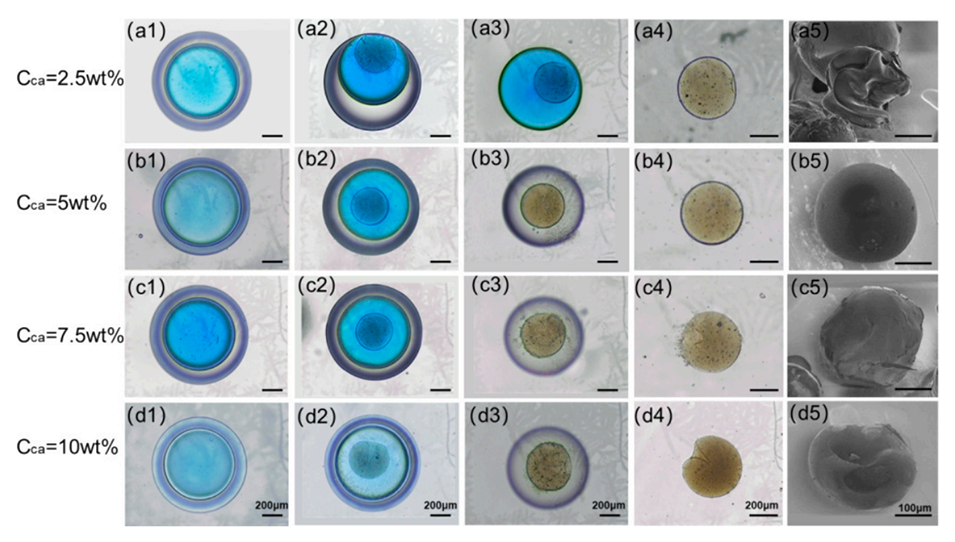
图5.不同钙离子浓度下海藻酸钙微球的凝胶变形过程。

图6.SEM图像显示了不同Cca(氯化钙溶液浓度)交联微球的外部和内部结构。
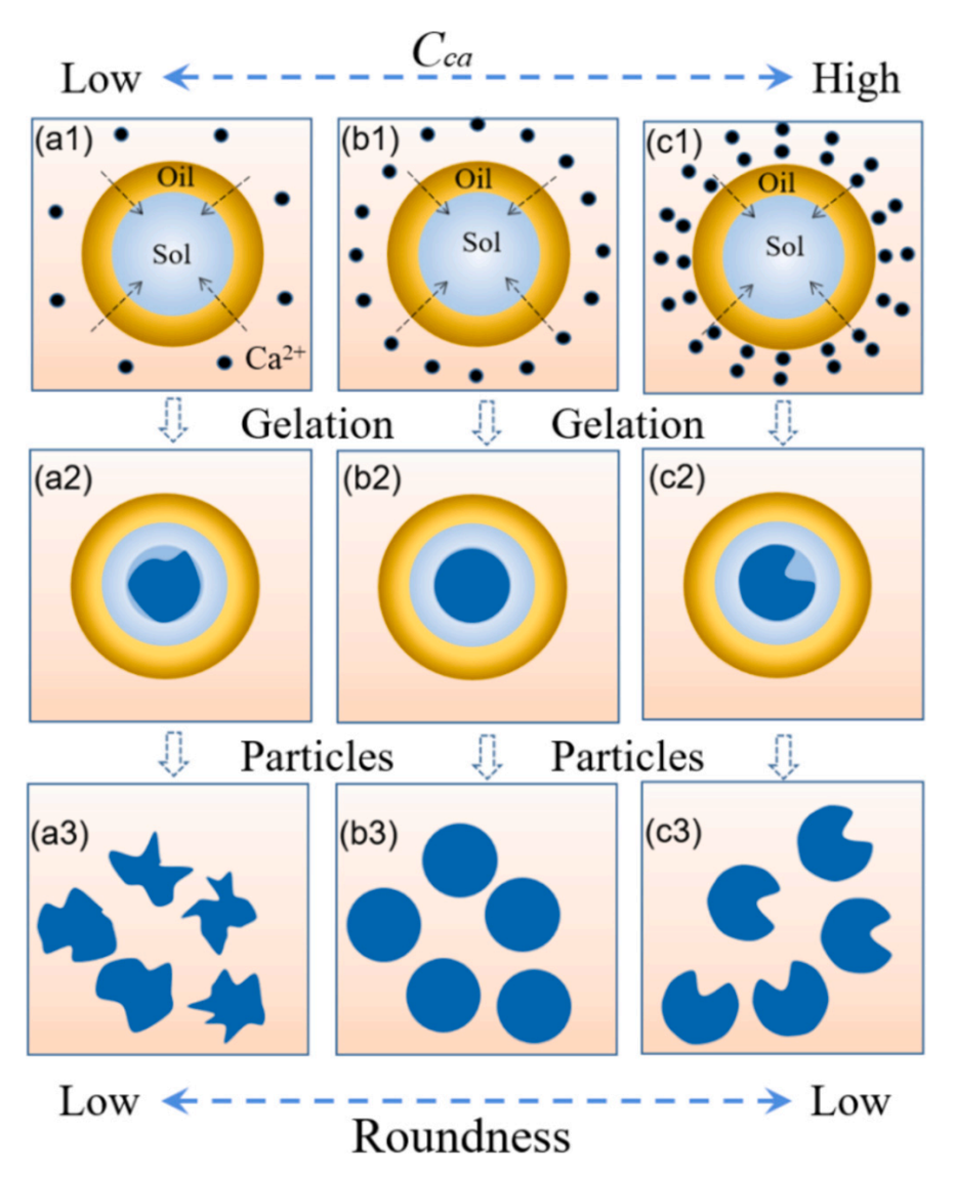
图7.Cca对水凝胶形状的可能影响。
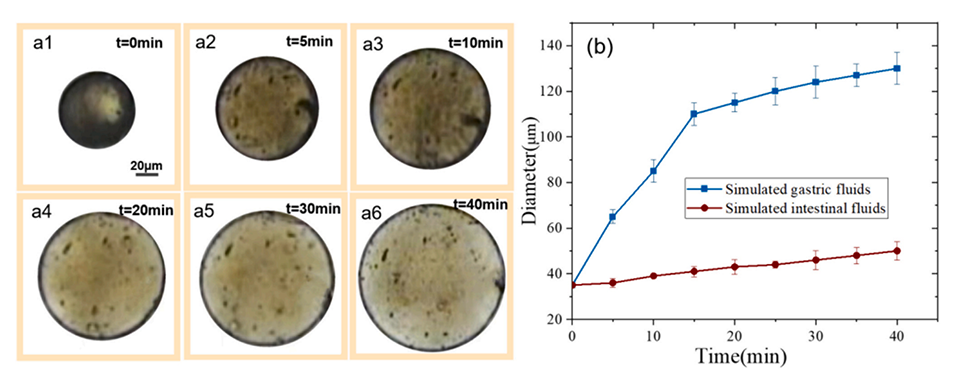
图8.(a)SIF(人工肠液)中微球随时间变化的光学图。比例尺为20μm;(b)SGF(人工胃液)和SIF中微球直径变化图。
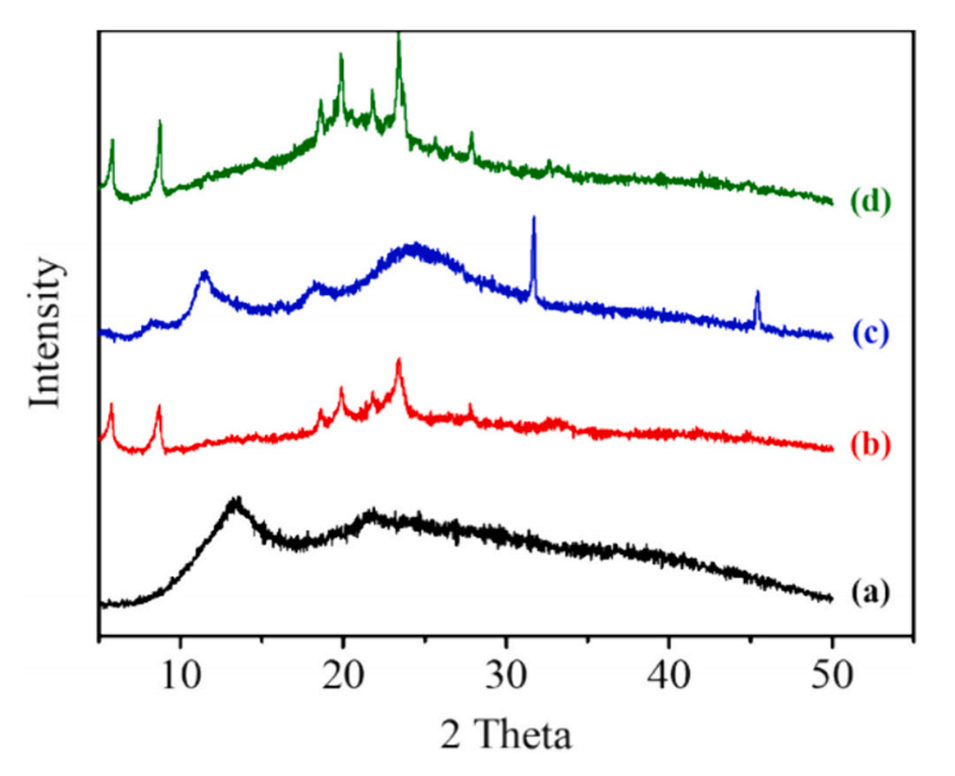
图9.(a)海藻酸钠,(b)海藻酸钙(5%),(c)壳聚糖和(d)壳聚糖包覆海藻酸钙(5%)的XRD图谱。
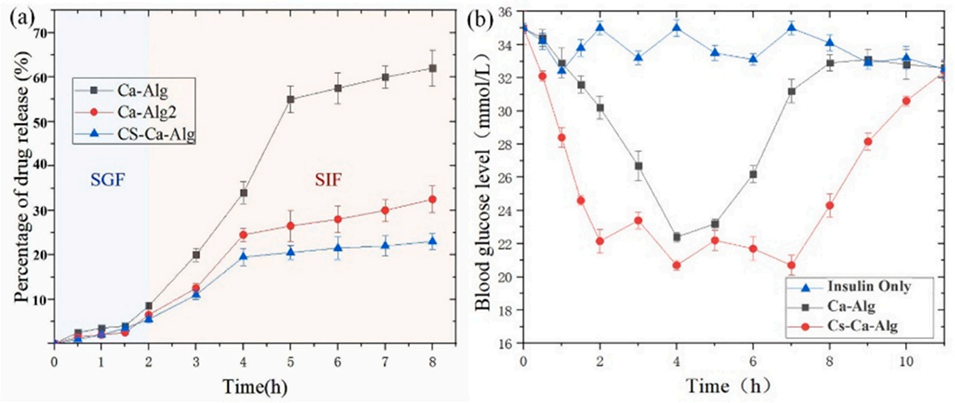
图10.(a)SGF和SIF中三组微球的药物释放曲线;(b)胰岛素、海藻酸钙微球和壳聚糖-海藻酸钙微球灌胃后小鼠血糖的变化。
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.134141














