骨关节炎(OA)是一种以软骨退化和滑膜炎症为特征的关节退行性疾病。由于其复杂的发病机制,单一的治疗方法难以有效控制OA的进展。因此,开发能够同时调节炎症免疫微环境并促进软骨再生的多方位治疗方法是控制OA进展的关键。

近期,嘉兴市第二医院院长陈刚、中心实验室助理研究员罗欢欢等人利用微流控技术设计了一种多功能聚多巴胺纳米颗粒交联的可注射水凝胶微球,用于骨关节炎软骨修复和免疫炎症微环境调节。相关研究以“Metal ion-crosslinking multifunctional hydrogel microspheres with inflammatory immune regulation for cartilage regeneration”为题目,发表在期刊《Frontiers in Bioengineering and Biotechnology》上。
本文要点:
1、针对骨关节炎(OA)的软骨退变和炎症特征,本研究开发了一种兼具免疫调节与软骨修复功能的多功能水凝胶微球(DIC/Mg-PDA@HM),旨在通过协同作用实现OA综合治疗。
2、多巴胺首先与Mg2+螯合形成复合物,在Tris-HCl提供的碱性条件下自聚合,生成Mg2+螯合聚多巴胺纳米颗粒(Mg-PDA NPs),随后通过酰胺化反应将非甾体抗炎药双氯芬酸(DIC)偶联到纳米颗粒表面,制备出复合纳米颗粒(DIC/Mg-PDA NPs)。
3、通过微流控技术将上述纳米颗粒掺杂到透明质酸水凝胶基质中,并在紫外光(UV)照射下交联形成可注射的水凝胶微球(DIC/Mg-PDA@HM)。
4、复合水凝胶微球持续释放Mg2+通过将巨噬细胞从促炎的M1型转变为抗炎的M2型,实现炎症免疫调节,并通过BMSCs的分化促进软骨再生。此外,DIC和聚多巴胺(PDA)的协同释放有效下调了炎症因子,最终实现对OA的治疗。
5、在OA大鼠模型中,通过关节腔内注射,DIC/Mg-PDA@HM显著减轻了关节软骨的退化,改善了关节间隙狭窄。MRI和组织学评估结果表明,该水凝胶微球具有良好的软骨修复效果。
6、这种多功能水凝胶微球为骨关节炎的治疗提供了一种新的策略,具有良好的生物相容性和治疗效果,有望成为一种有效的临床治疗手段。
制备这种可注射水凝胶微球(DIC/Mg-PDA@HM)所需的材料主要包括以下几种:
甲基丙烯酰化透明质酸(HAMA):作为水凝胶的基础材料,提供良好的生物相容性和注射性。
多巴胺(Dopamine):用于合成多功能聚多巴胺(PDA)纳米颗粒,并通过金属离子螯合作用与镁离子交联。
无水氯化镁(MgCl2):提供镁离子(Mg2+),用于与多巴胺的邻苯二酚基团螯合,以形成聚多巴胺纳米颗粒,并在释放过程中促进软骨再生和免疫调节。
双氯芬酸(Diclofenac, DIC):一种非甾体抗炎药,通过酰胺化反应结合到纳米颗粒表面,为水凝胶微球提供抗炎效果。
光引发剂(Lithium Phenyl-2,4,6-trimethylbenzoylphosphinate, LAP):用于在紫外光照射下引发水凝胶的交联反应,形成稳定的水凝胶微球。
这些材料的组合使得微球能够在治疗骨关节炎中有效发挥作用,调节免疫环境并促进软骨再生。
水凝胶微球及混合微球的制备过程如下:
1、材料准备:
首先,将200毫克的甲基丙烯酰化透明质酸(HAMA)和10毫克的光引发剂(如LAP)溶解于10毫升的PBS中,并进行超声处理30分钟,以形成均匀的水相。
其次,将0.5毫升的Span 80与9.5毫升的矿物油混合,作为油相。
2、微流控生成:
利用微流控设备将水相与油相按1:3的流量比进行共流,以在微流控滴液芯片中形成均匀大小的液滴。
3、紫外光交联:
将形成的水凝胶液滴在紫外光下交联,使其固化成稳定的固体颗粒。
4、冷冻干燥和后处理:
交联后的水凝胶微球用75%的乙醇清洗,然后在-80°C下进行冷冻干燥以得到最终产品。
5、混合微球的制备:
为了制备混合微球(如DIC/Mg-PDA@HM),将功能化的纳米颗粒(如DIC/Mg-PDA)与HAMA和光引发剂的溶液混合,其他步骤与HM的合成过程相同。
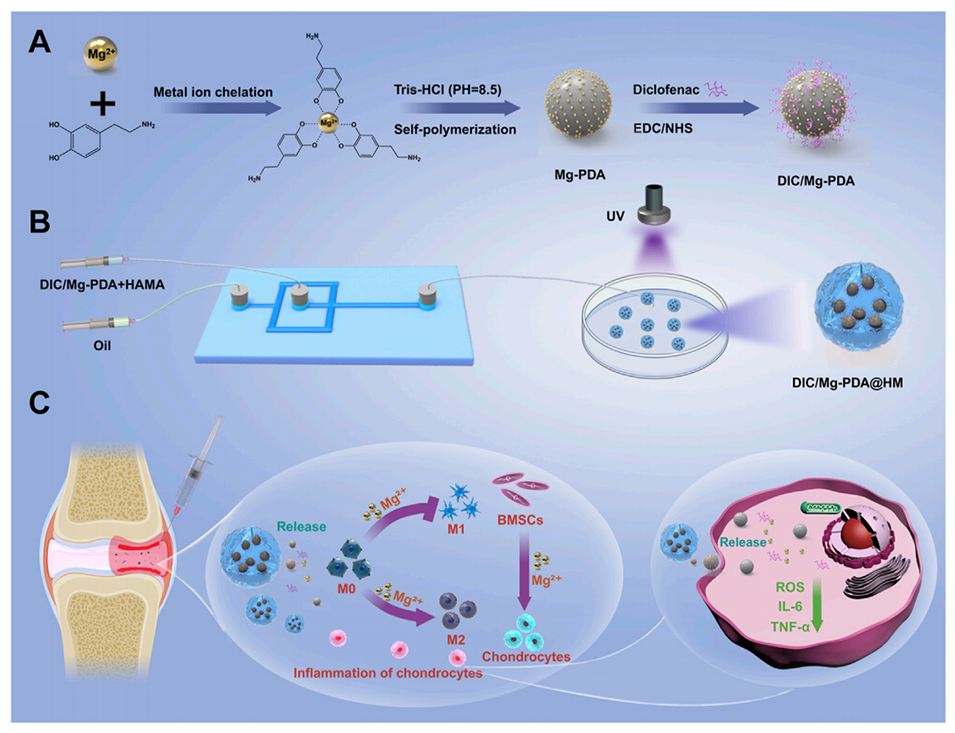
Scheme 1:水凝胶微球的制备及其在骨关节炎治疗中的应用示意图。(A)DIC/Mg-PDA纳米颗粒的制备。(B)DIC/Mg-PDA@HM水凝胶微球的制备。(C)DIC/Mg-PDA@HM的骨关节炎治疗机制。
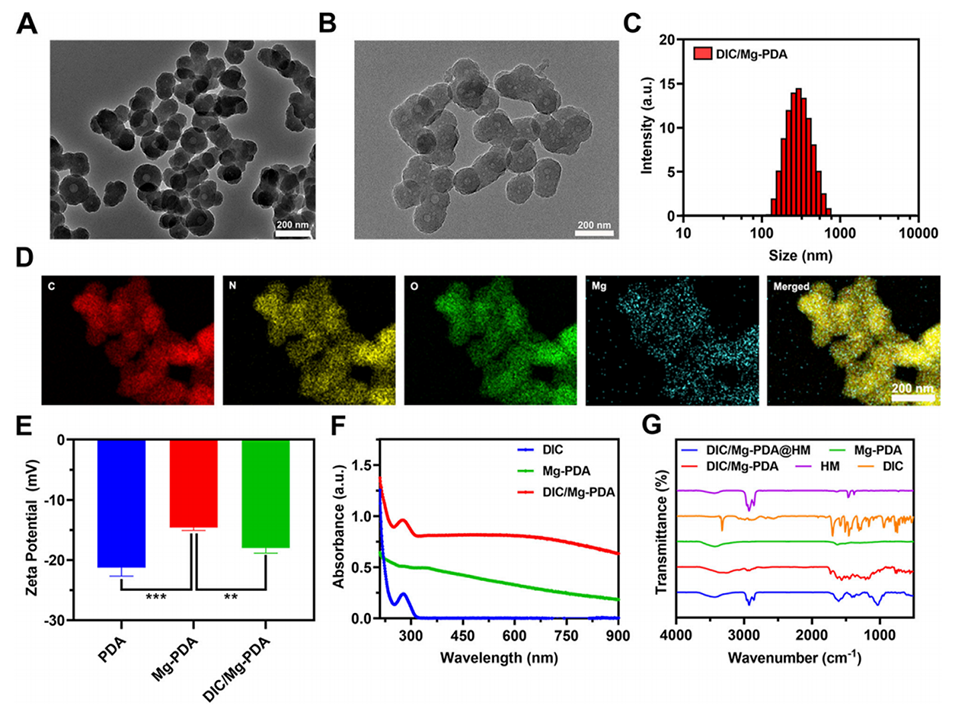
图1.DIC/Mg-PDA的表征。(A)Mg-PDA的TEM图像。(B)DIC/Mg-PDA的TEM图像。(C)DIC/Mg-PDA的粒度分布。(D)DIC/Mg-PDA的EDS图。(E)PDA、Mg-PDA和DIC/Mg-PDA的Zeta电位分析(n=3)。(F)DIC、Mg-PDA、DIC/Mg-PDA的吸光度。(G)HM、DIC、Mg-PDA、DIC/Mg-PDA、DIC/Mg-PDA@HM的FTIR光谱。所有数据均以平均值±标准差表示,采用单因素方差分析和Tukey多重比较检验,ns表示无显著性,*p<0.05,**p<0.01,***p<0.001。
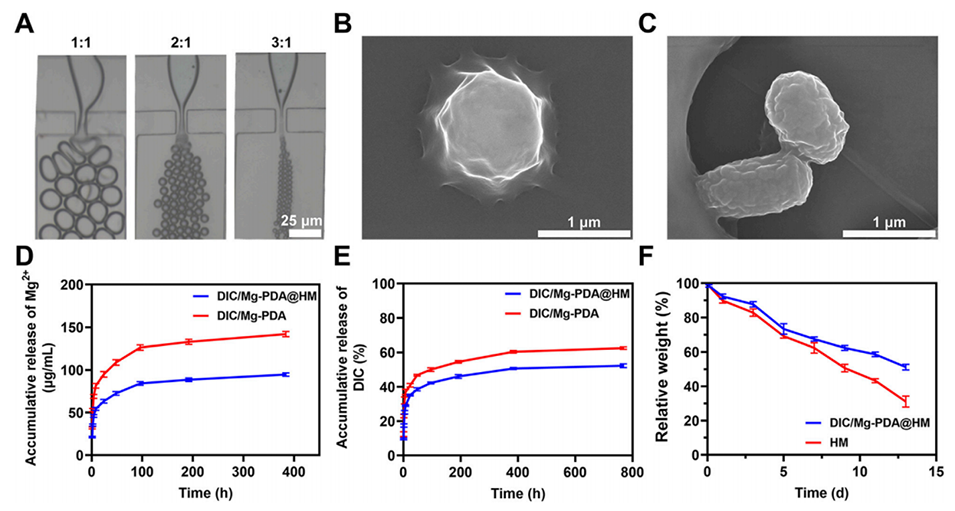
图2.水凝胶微球的表征。(A)在不同水油流速比(1:1、1:2和1:3)下微流控芯片中微凝胶的显微图像。(B)HM的SEM图像。(C)DIC/Mg-PDA@HM的SEM图像。(D)DIC/Mg-PDA和DIC/Mg-PDA@HM在1X PBS溶液中的Mg2+释放行为。(E)DIC/Mg-PDA和DIC/Mg-PDA@HM在1X PBS溶液中的DIC释放行为。(F)HM和DIC/Mg-PDA@HM的降解行为。
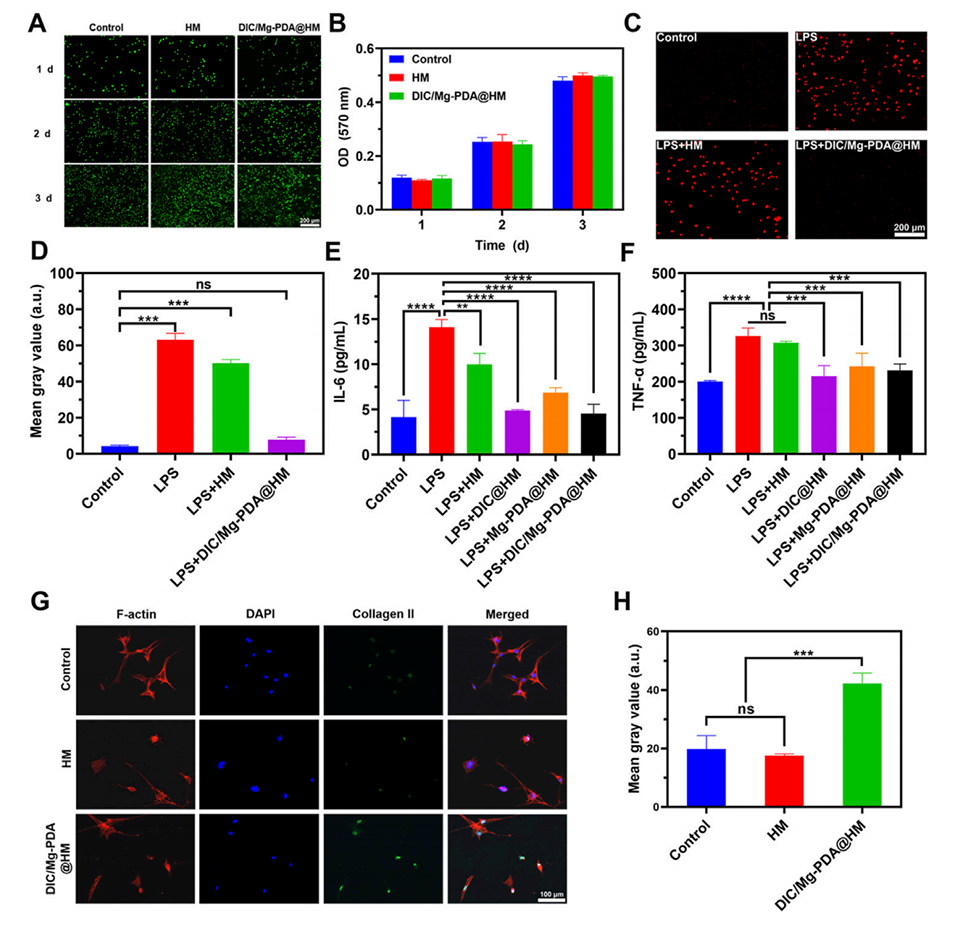
图3.体外细胞实验结果。(A)ATDC5细胞在Control、HM和DIC/Mg-PDA@HM组中的活/死染色结果,显示细胞活性和密度。(B)ATDC5细胞的MTT实验结果,显示细胞增殖情况。(C)DHE染色结果,显示LPS诱导的ATDC5细胞中ROS水平的变化。(D)DHE染色的ImageJ分析结果,显示DIC/Mg-PDA@HM显著降低ROS水平。(E)ELISA检测结果,显示ATDC5细胞分泌的IL-6水平。(F)ELISA检测结果,显示ATDC5细胞分泌的TNF-α水平。(G)BMSCs细胞的免疫荧光染色结果,显示Col-II的表达情况。(H)Col-II表达的荧光强度分析,显示DIC/Mg-PDA@HM显著促进软骨分化。
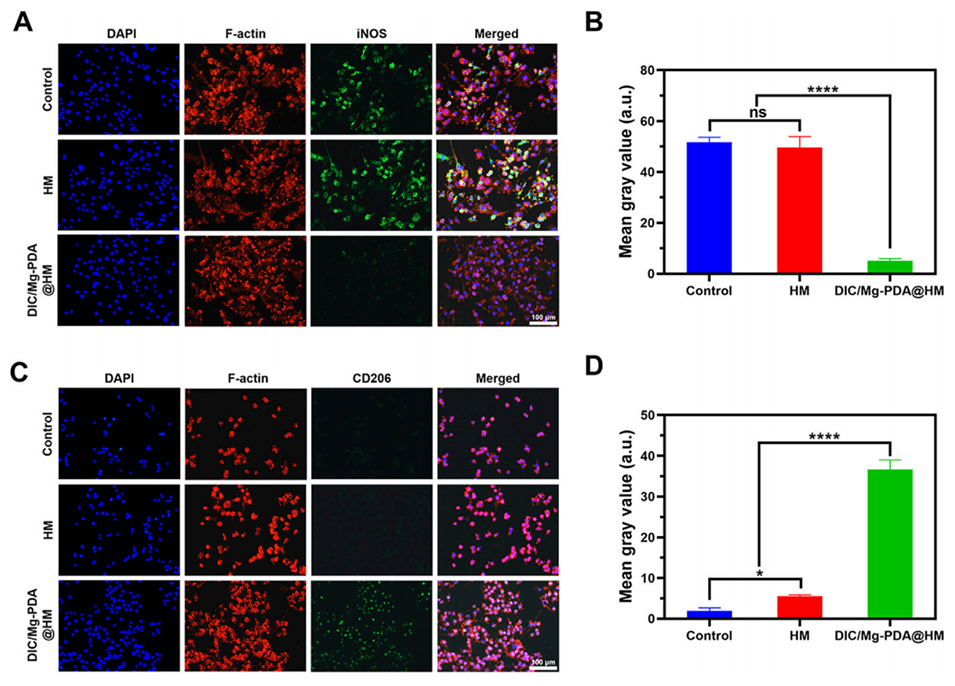
图4.RAW264.7巨噬细胞的表型转化。(A,C)RAW264.7细胞的免疫荧光染色结果,显示M1标志物(iNOS)和M2标志物(CD206)的表达。(B)iNOS荧光强度的ImageJ分析结果,显示DIC/Mg-PDA@HM抑制M1表型。(D)CD206荧光强度的ImageJ分析结果,显示DIC/Mg-PDA@HM促进M2表型。
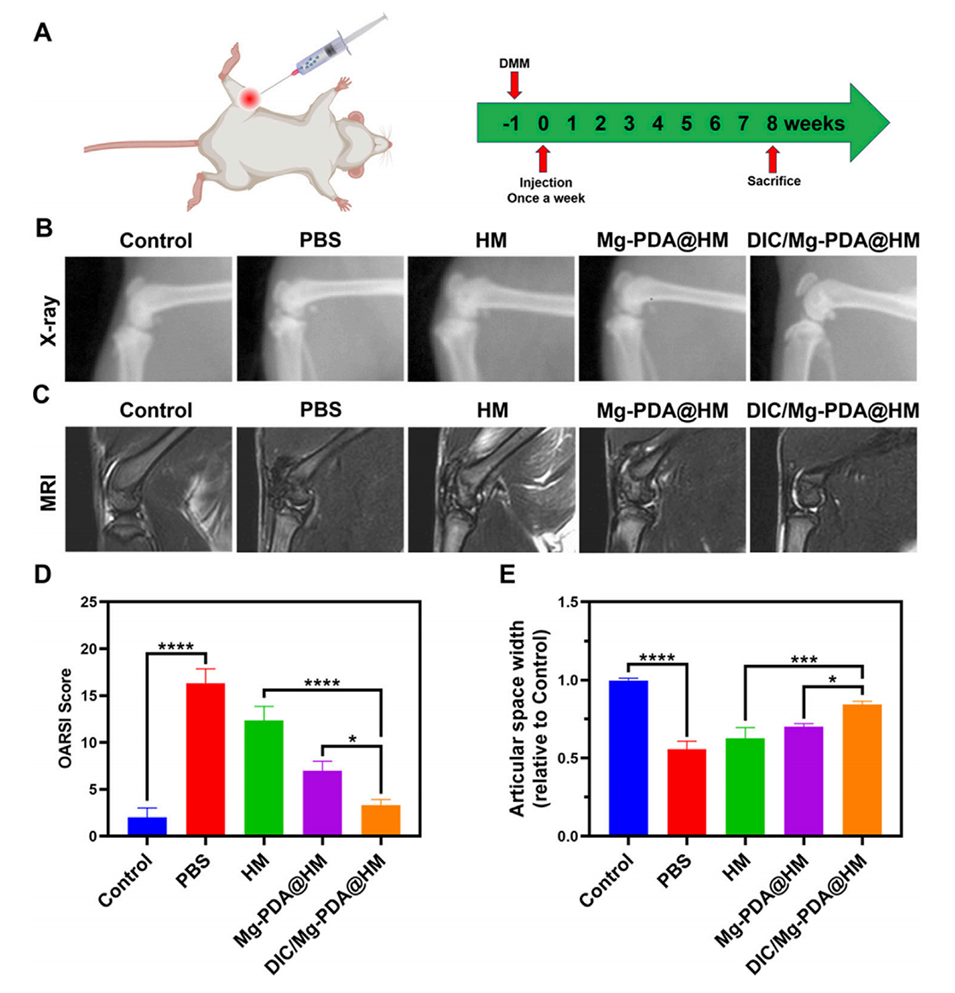
图5.体内治疗效果。(A)OA大鼠模型的治疗方案,显示每周一次的关节腔注射。(B)X射线图像,显示不同组大鼠关节的形态变化。(C)MRI扫描结果,显示不同组大鼠膝关节软骨的信号变化。(D)OARSI评分,用于评估关节软骨病变的程度。(E)关节间隙宽度的相对值,显示DIC/Mg-PDA@HM组的关节间隙狭窄显著减轻。
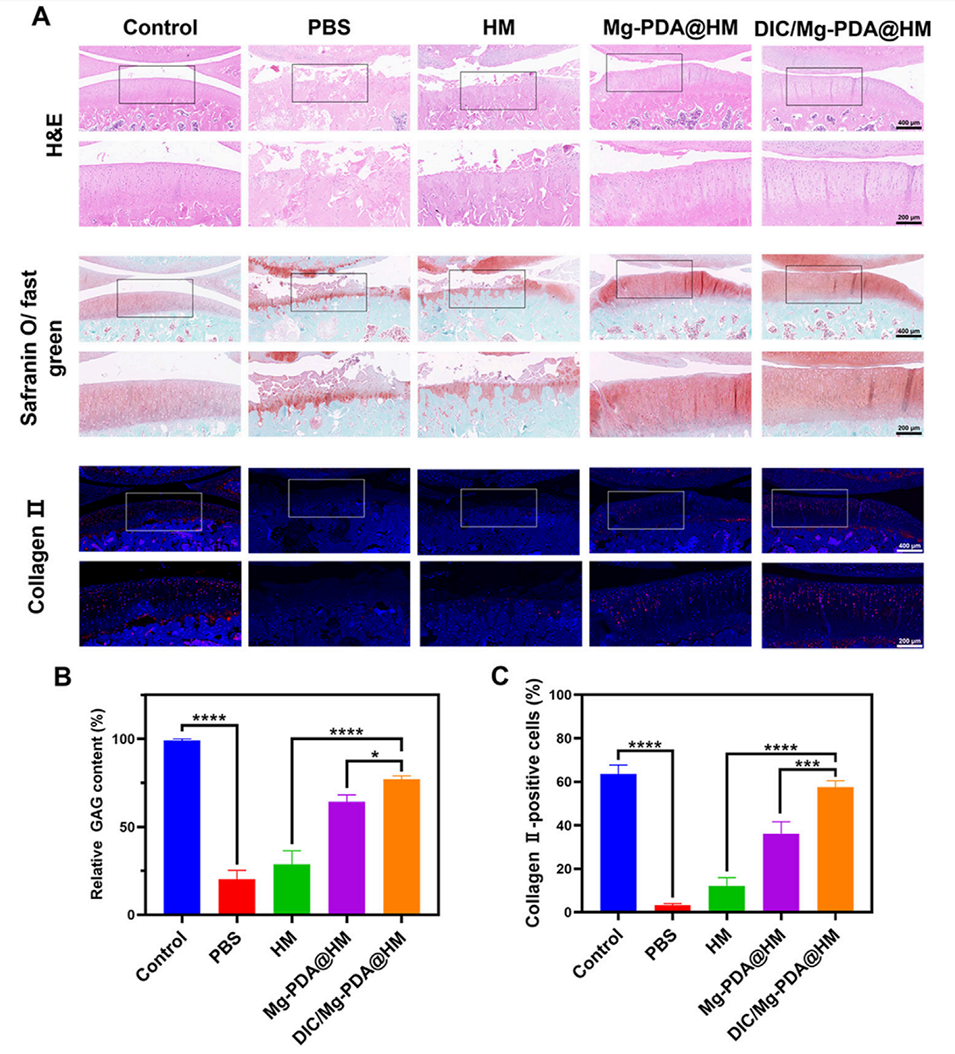
图6.组织学和免疫组化评估。(A)不同组的H&E染色和番红O/固绿染色结果,显示软骨层的完整性。(B)通过ImageJ软件测量的糖胺聚糖(GAG)含量,显示DIC/Mg-PDA@HM组的GAG含量显著增加。(C)通过免疫荧光检测的Col-II表达水平,显示DIC/Mg-PDA@HM组的Col-II表达最高。
论文链接:https://doi.org/10.3389/fbioe.2025.1540592














