
牙周骨缺损再生对于正畸或种植牙治疗至关重要。炎症刺激诱导的牙周膜干细胞(PDLSCs)成骨能力减弱,导致牙周骨再生能力下降,这给治疗牙周炎带来了巨大的挑战。受贻贝粘附特性启发,北京大学口腔医院邓旭亮教授团队开发了一种负载虫草素的可粘附矿化水凝胶微球(MMS-CY),该微球具有粘附性、可注射性和生物矿化特性,能够粘附于牙槽骨表面并实现药物的局部缓释。相关研究以“Adhesive and injectable hydrogel microspheres for NRF2-mediated periodontal bone regeneration”为题目发表于期刊《International Journal of Oral Science》。
相关名词释义:
NRF2,即核因子红系2相关因子2,是一种在细胞防御、抗氧化应激和细胞生存等方面发挥关键作用的转录因子。NRF2信号通路主要参与细胞内氧化应激反应的调节,对维护细胞正常功能及细胞生存至关重要。
虫草素(Cordycepin),又称冬虫夏草素、虫草菌素、蛹虫草菌素,别名3'-脱氧腺苷,化学式为C10H13N5O3,是第一个从真菌中分离出来的核苷类抗生素,具有抗菌、抗炎、抗病毒、抗肿瘤和免疫调节等多种药理活性。
本文要点:
1、本研究开发了一种载虫草素的可粘附矿化水凝胶微球(MMS-CY),用于NRF2介导的牙周骨再生。
2、研究表明,慢性炎症会削弱牙周膜干细胞(PDLSCs)的成骨能力,增加骨再生的难度。而MMS-CY能够粘附于牙槽骨表面,增强PDLSCs的迁移、成骨和韧带形成能力,同时抑制破骨细胞活性。
3、其作用机制是通过激活NRF2通路,减轻炎症诱导的PDLSCs早衰,并减少DNA损伤。
4、在大鼠牙周炎模型中,MMS-CY通过改善成骨和抑制破骨细胞活性,显著改善了牙周骨再生效果。
4、总之,这种多管齐下的方法有望通过减少炎症诱导的干细胞衰老和维持骨稳态来促进牙周骨再生,为临床治疗牙周炎提供了新的思路和方法。
载虫草素的可粘合矿化水凝胶微球(MMS-CY)的具体制备步骤如下:
药载纳米颗粒的制备:使用生物可降解聚合物PLGA(聚乳酸-乙醇酸)作为载体,通过油/水(O/W)乳液-溶剂蒸发法加载虫草素(Cordycepin, CY)。将PLGA溶液与虫草素混合后,注入水相中形成乳液,搅拌使溶剂蒸发,获得载虫草素的PLGA纳米颗粒(PLGA-CY)。通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察纳米颗粒的形貌,测定粒径和表面电位(Zeta电位)。
微球的制备:使用甲基丙烯酰化明胶(GelMA)作为基质材料,通过批量乳液法制备单分散GelMA微球。将GelMA溶液注入油相中形成乳液,分离并洗涤后冻干处理以形成多孔结构。随后,将微球浸泡于多巴胺(Dopamine, PDA)溶液中,通过物理吸附使微球表面形成聚多巴胺(Polydopamine, PDA)层,以增强粘合性。
矿化处理:将PDA修饰的微球浸泡在5倍浓度的模拟体液(5SBF, Simulated Body Fluid)和钙离子溶液中,于37°C条件下孵育12小时。矿化过程中,微球表面形成生物矿化层(如羟基磷酸钙层)。通过扫描电子显微镜(SEM)和能量色散光谱(EDS)分析矿化层的成分和结构。
药物负载:将PLGA-CY纳米颗粒均匀分布在矿化微球表面。通过浸渍法将纳米颗粒吸附到微球表面,并使用荧光标记的Dil染料对纳米颗粒进行标记,通过荧光显微镜观察负载效果。通过UV-Vis分光光度计测定药物负载量,并通过振荡释放实验评估药物的释放特性。
微球表征:评估微球的粘合性、水润湿度、生物相容性等性能。通过Live/Dead细胞活性染色和CCK-8实验评估微球对牙周膜干细胞(PDLSCs)的相容性。
通过以上步骤制得的MMS-CY具有粘附性、矿化层、可控药物释放特性和多孔结构,能够在牙周炎治疗中实现局部药物递送。
在大鼠牙周炎模型中,使用MMS-CY表现出显著的治疗效果。具体结果如下:
1、显微CT分析:MMS-CY显著提高了骨体积比(BV/TV),降低了CEJ-ABC(牙槽骨与釉质交界的距离),表明其有效促进了牙周骨的再生。
2、组织病理学分析:MMS-CY处理组显示出更为紧密和有序的胶原纤维,以及更高的骨体积。相比空白组和仅使用MMS的组,MMS-CY显著减少了破骨细胞的数量,抑制了骨吸收。
3、成骨相关蛋白表达:MMS-CY显著增加了骨形成相关蛋白如BMP2和OCN的表达,这些蛋白对骨再生至关重要。
这些结果表明,MMS-CY在体内有效地促进了牙周骨的再生,减少了骨吸收,具有良好的治疗潜力。
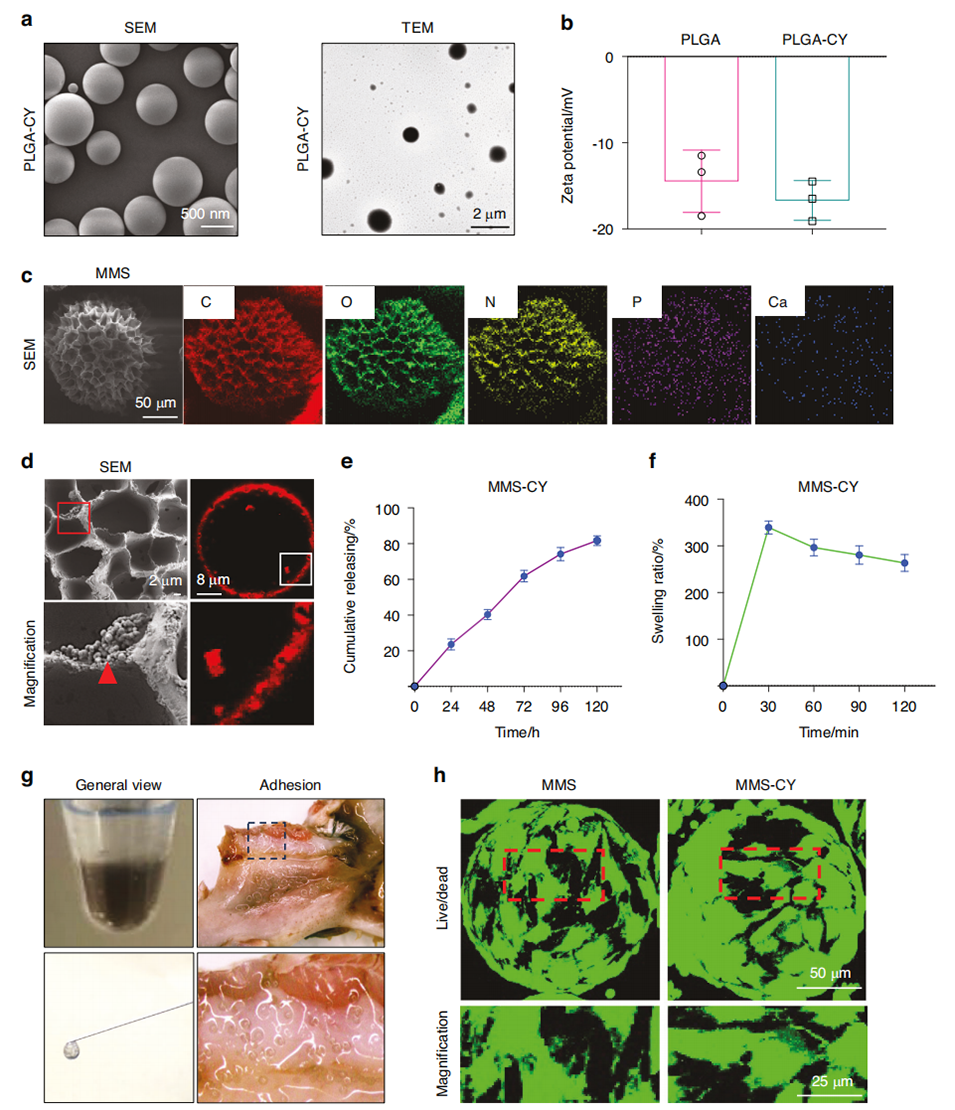
图1 MMS-CY的表征。a PLGA-CY的扫描电镜(SEM)和透射电镜(TEM)图像。b PLGA和PLGA-CY的表面电位。c MMS-CY的元素映射图像。d MMS-CY的扫描电镜图像和免疫荧光图像。e MMS-CY中虫草素的释放曲线。f MMS-CY的膨胀比率。g 可注射MMS-CY的总体视图。h 不同类型微球培养的PDLSCs的活死细胞染色实验。
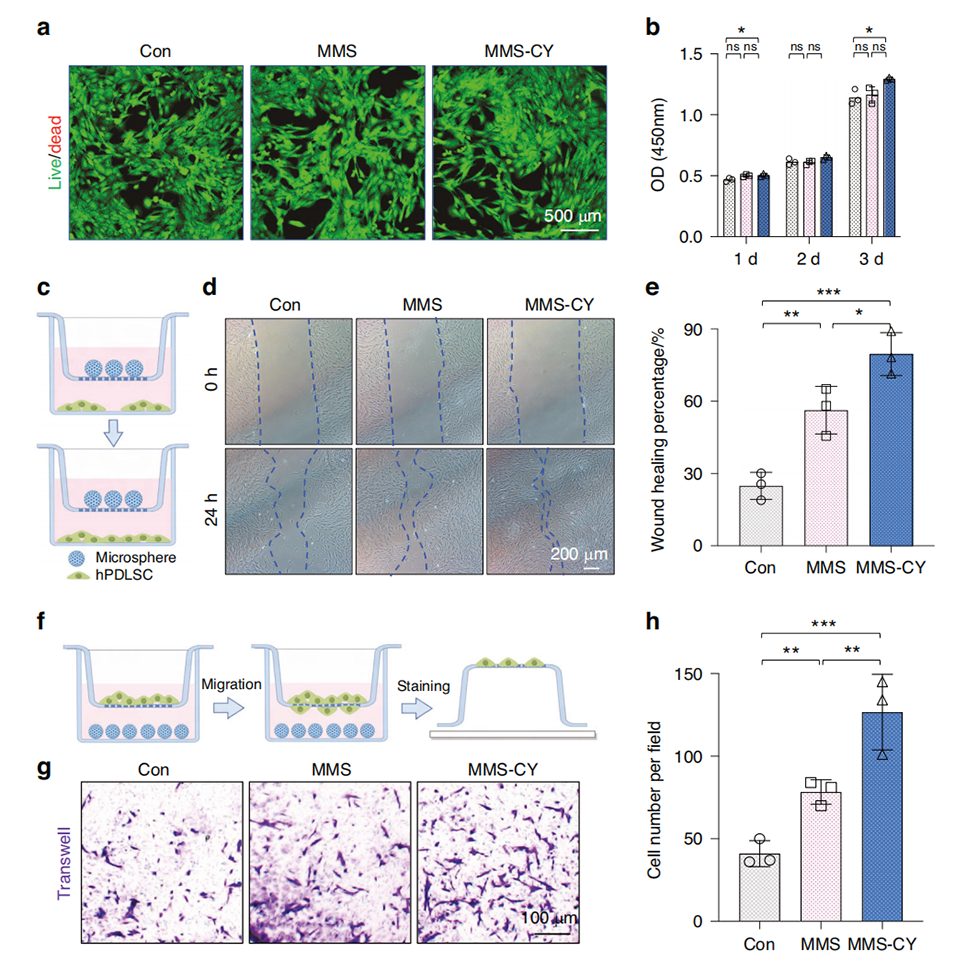
图2 MMS-CY生物相容性和诱导能力的评估。
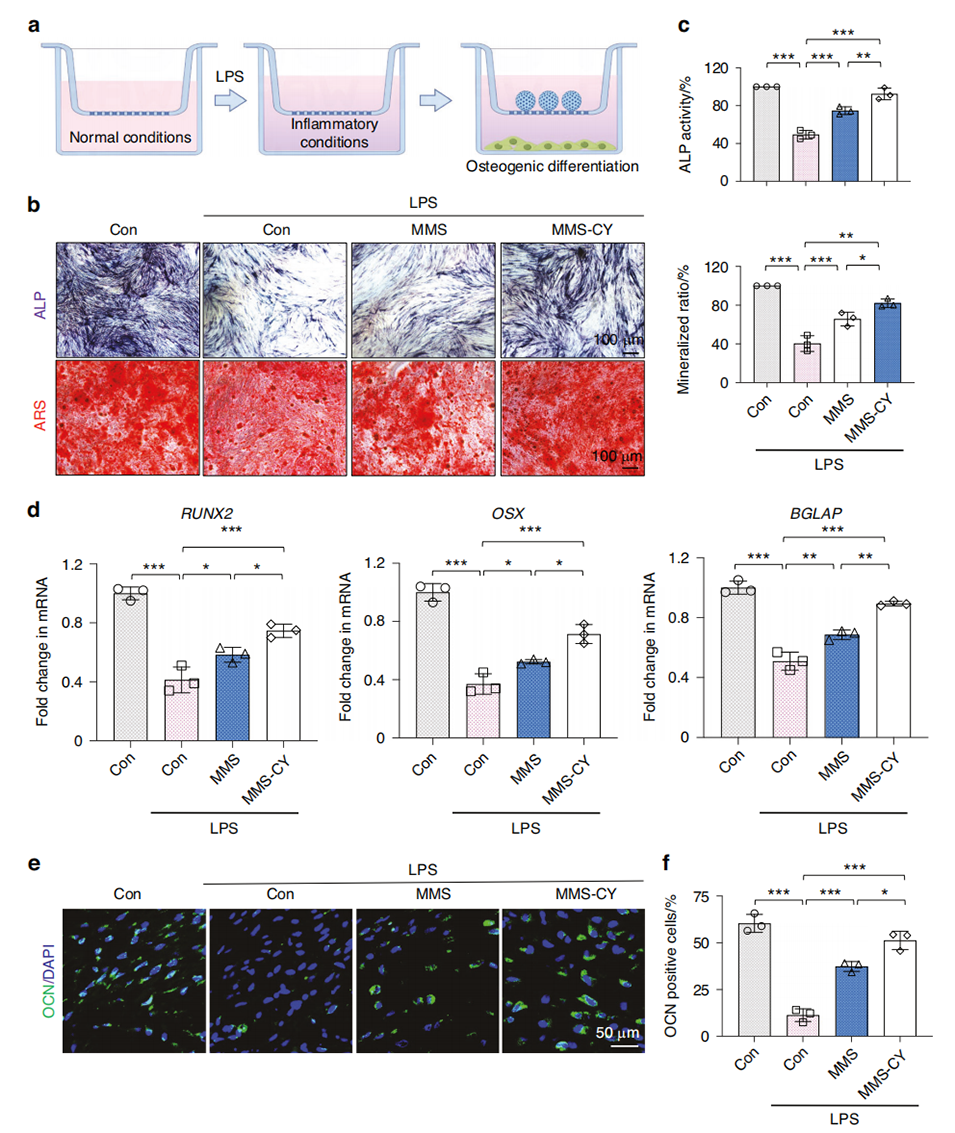
图3 MMS-CY在炎症刺激下改善PDLSCs的成骨能力。
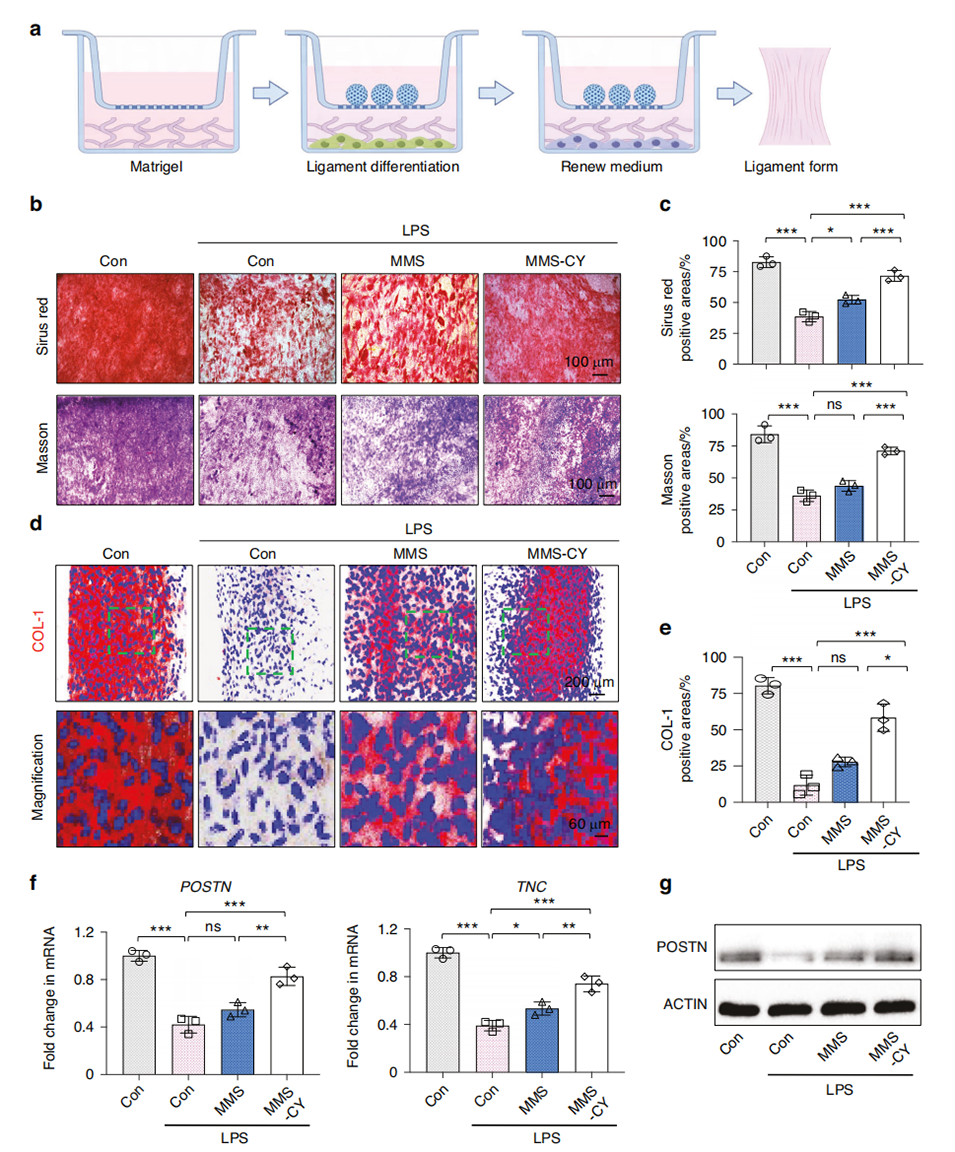
图4 MMS-CY恢复PDLSCs在炎症刺激下受损的韧带形成能力。
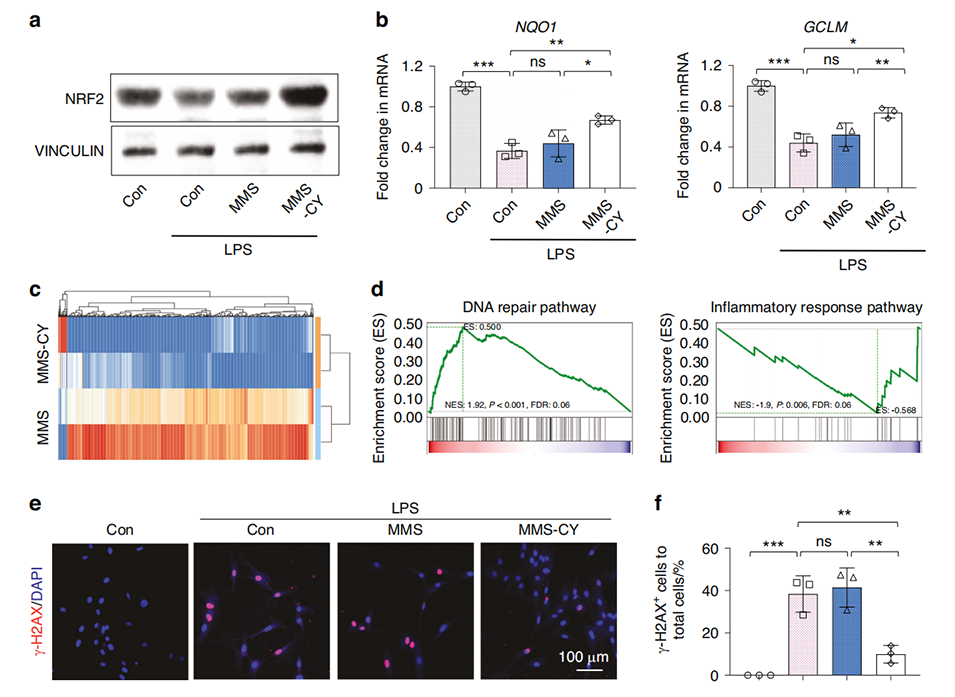
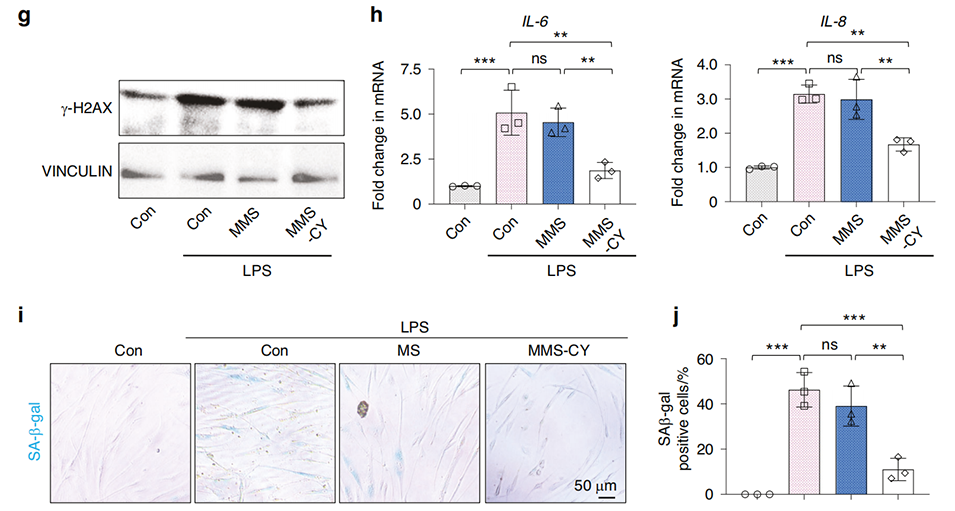
图5 MMS-CY通过减少DNA损伤恢复PDLSCs的功能。
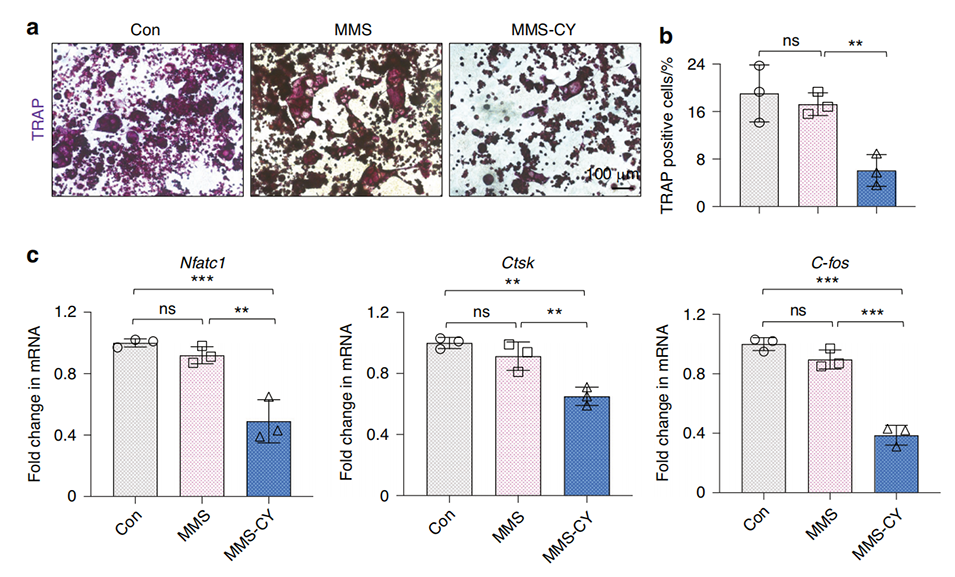
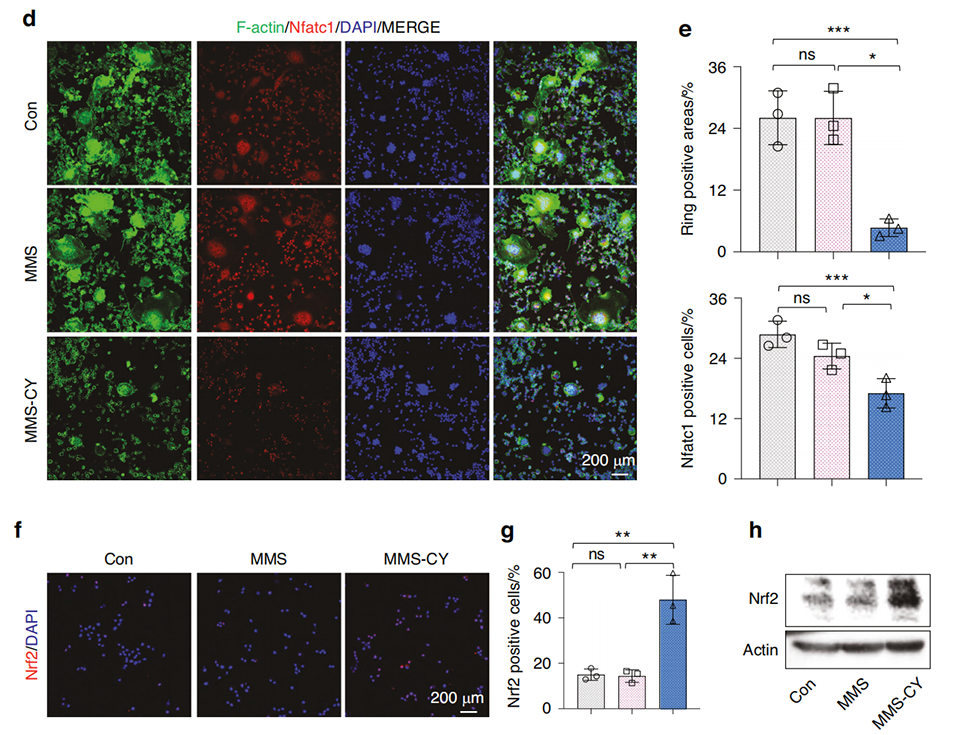
图6 MMS-CY抑制破骨细胞分化。
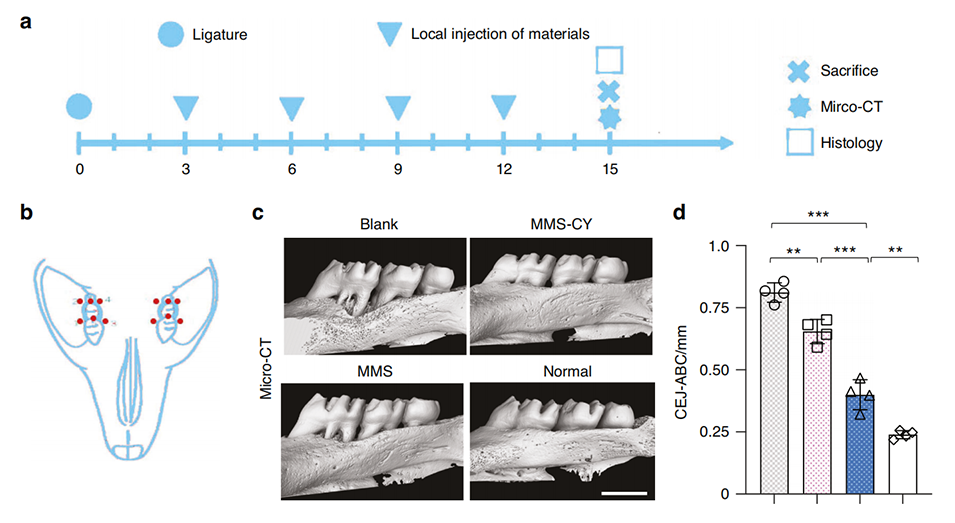
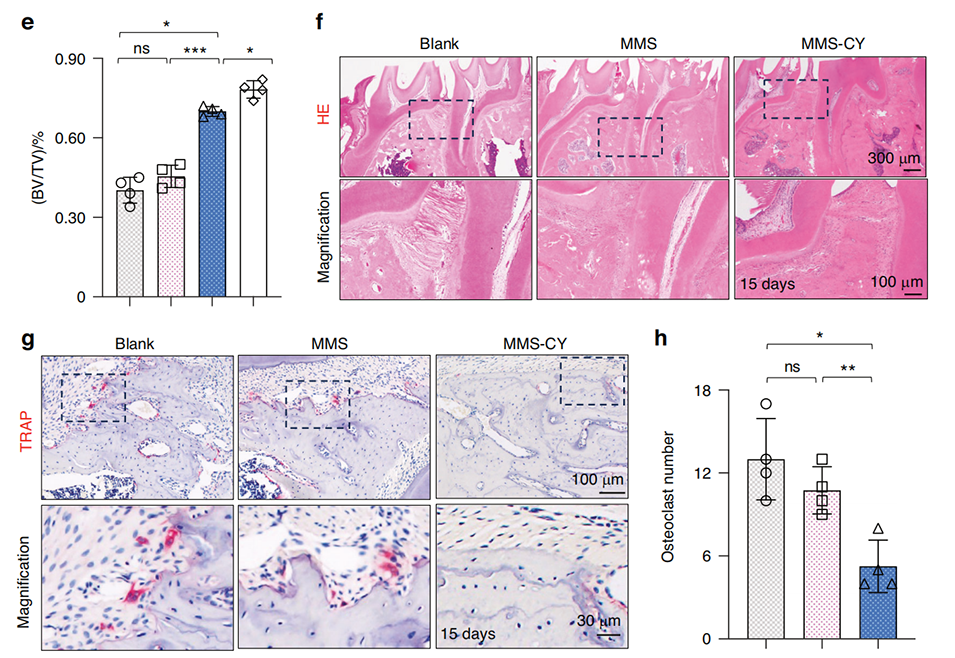
图7 MMS-CY抑制大鼠结扎诱导牙周炎中的骨丧失。
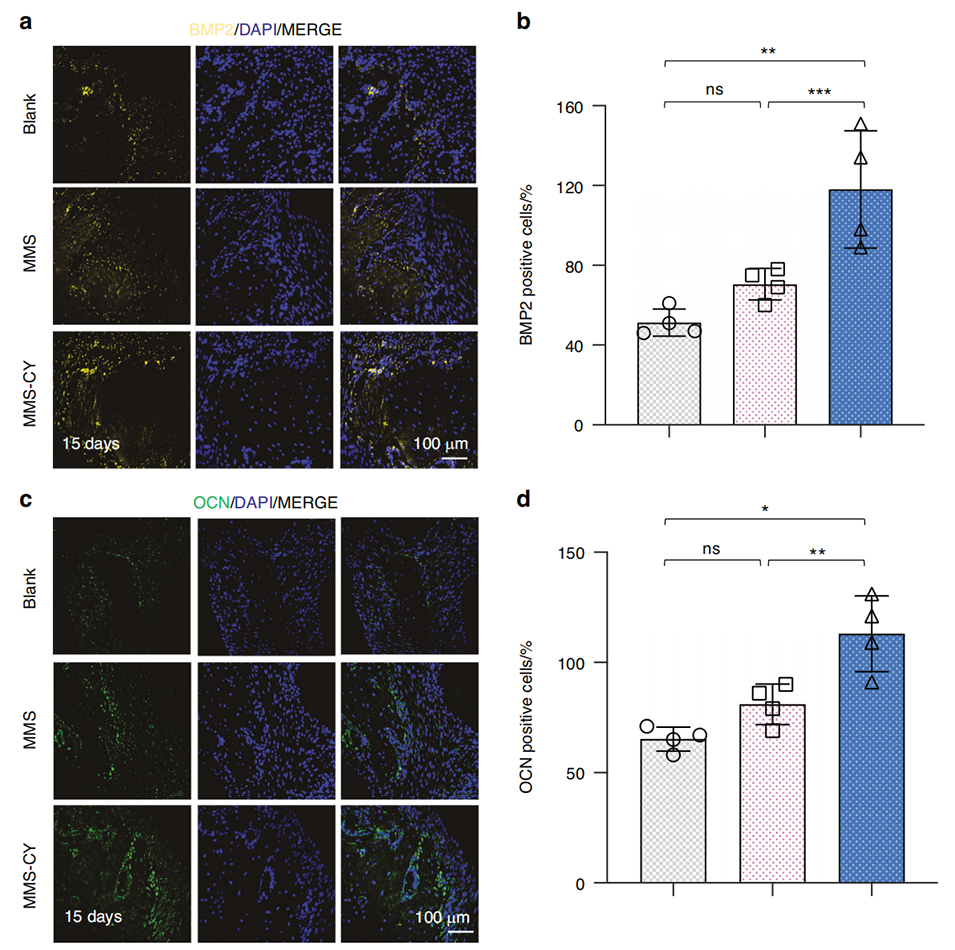
图8 MMS-CY促进大鼠结扎诱导牙周炎中的骨形成。
论文链接:https://doi.org/10.1038/s41368-024-00340-w














