晚期肝细胞癌(HCC)是最常见的恶性肿瘤之一,但临床治疗效果并不理想。由于HCC的复杂性、异质性和免疫抑制微环境的影响,单一药物疗法效果有限。联合治疗可以通过重塑肿瘤免疫微环境来有效增强抗肿瘤治疗。

近期,上海市肿瘤研究所孙颖研究员、段友容研究员与上海交通大学医学院附属新华医院超声科主任董怡等人合作,开发了一种可注射的温敏微球-水凝胶复合系统,用于局部共递送靶向药物索拉非尼(SOR)和免疫调节细胞因子IL-12,通过重塑肿瘤免疫微环境实现了肝细胞癌(HCC)的联合治疗,显著增强了抗肿瘤效果。相关研究以“Injectable thermosensitive microsphere-hydrogel composite system: combined therapy of hepatocellular carcinoma by remodeling tumor immune microenvironment”为题目,发表在期刊《Science China Materials》上。
本文要点:
1、本研究开发了一种可注射的温敏微球-水凝胶复合系统,用于局部共递送靶向药物索拉非尼(SOR)和免疫调节细胞因子IL-12,实现肝细胞癌(HCC)的联合治疗。
2、该递送系统具有双药物递送、持续缓释、局部可注射性、温敏性和低副作用等优点。
3、通过增加CD8+ T细胞和自然杀伤(NK)细胞的浸润,同时减少免疫抑制Treg细胞的浸润,该递送系统成功地重塑了HCC的免疫微环境,与SOR协同发挥强大的抗肿瘤作用。
SOR MPs@IL-12 Gel的制备过程分为两个主要部分:微球(MPs)的制备和水凝胶的制备及复合系统的形成。以下是详细的制备过程:
一、微球(MPs)的制备
微球是用于负载索拉非尼(SOR)的载体,其制备过程如下:
材料选择:使用三嵌段聚合物(polyethylene glycol)-poly(D,L-lactide-co-glycolide)-poly(L-lysine)(mPEG-PLGA-PLL, PEAL)作为基材,因其具有良好的生物相容性、生物可降解性和药物负载能力。
微流控技术:利用微流控装置制备微球。首先将PEAL粉末溶解在二氯甲烷中作为初始溶液,然后将该溶液引入微流控装置中作为分散相,在连续PVA溶液的剪切作用下形成均匀的液滴。
微球收集与处理:将形成的PEAL微球收集在PVA水溶液中,轻轻旋转过夜以去除溶剂。随后,用蒸馏水多次洗涤微球,然后在-20°C下冷冻8小时,最后通过冷冻干燥24小时得到干燥的微球。
药物负载:为了制备负载SOR的微球,将SOR溶液添加到上述初始溶液中,其余步骤与制备空白微球相同。此外,还可以通过添加荧光染料(如罗丹明B,RhoB)或近红外染料(如Dir)来制备用于标记的微球,便于后续的细胞摄取实验或体内成像研究。
二、水凝胶的制备及复合系统的形成
水凝胶用于负载免疫调节细胞因子IL-12,并与微球结合形成复合系统:
空白水凝胶的制备:将Pluronic F127(F127)粉末溶解在冷的磷酸盐缓冲液(PBS)中,该溶液在37°C时会转变为凝胶状态。
IL-12水凝胶的制备:将IL-12冻干粉溶解在上述PBS溶液中,按照类似步骤制备IL-12负载的水凝胶。
复合系统的形成:将制备好的SOR负载的微球(SOR MPs)轻轻混合到IL-12水凝胶中,在4°C下进行操作,随后进行适度搅拌并去除气泡,最终形成SOR MPs@IL-12 Gel复合系统。
三、复合系统的特性
温敏性:该复合系统具有温敏性,能够在4°C时保持液态,便于注射;在37°C时转变为凝胶状态,从而在肿瘤局部形成稳定的药物释放平台。
药物释放:IL-12由于负载在水凝胶的外层,会相对较快地释放;而SOR由于包裹在微球内部,会实现持续、缓慢的释放。这种序贯释放特性有助于最大化药物的协同作用,同时减少因同时释放药物所带来的严重副作用。
这种复合系统实现温敏性的关键在于其成分的物理化学特性,特别是Pluronic F127(F127)水凝胶的特性。Pluronic F127是一种具有温度响应性的聚合物,其在不同温度下表现出不同的物理状态:
低温下的流动性:在4°C时,F127水凝胶处于液态,具有良好的流动性。这种液态特性使得复合系统可以通过注射的方式轻松地引入体内,尤其是在肿瘤局部区域。
体温下的凝胶化:当温度升高到37°C(接近人体体温)时,F127水凝胶会发生溶胶-凝胶转变,即从液态转变为固态凝胶。这种转变使得复合系统在注射后能够在肿瘤局部形成稳定的凝胶结构,从而实现药物的局部缓释。
这种温敏性设计的优势在于:
局部药物释放:药物可以在肿瘤局部持续释放,避免了全身性给药带来的副作用。
提高药物浓度:在肿瘤局部形成高浓度的药物环境,增强了治疗效果。
减少药物扩散:凝胶状态限制了药物的快速扩散,延长了药物的作用时间。
通过这种温敏特性,复合系统经注射后在肿瘤周围形成稳定的药物释放平台,从而实现持续缓释和局部治疗的效果。
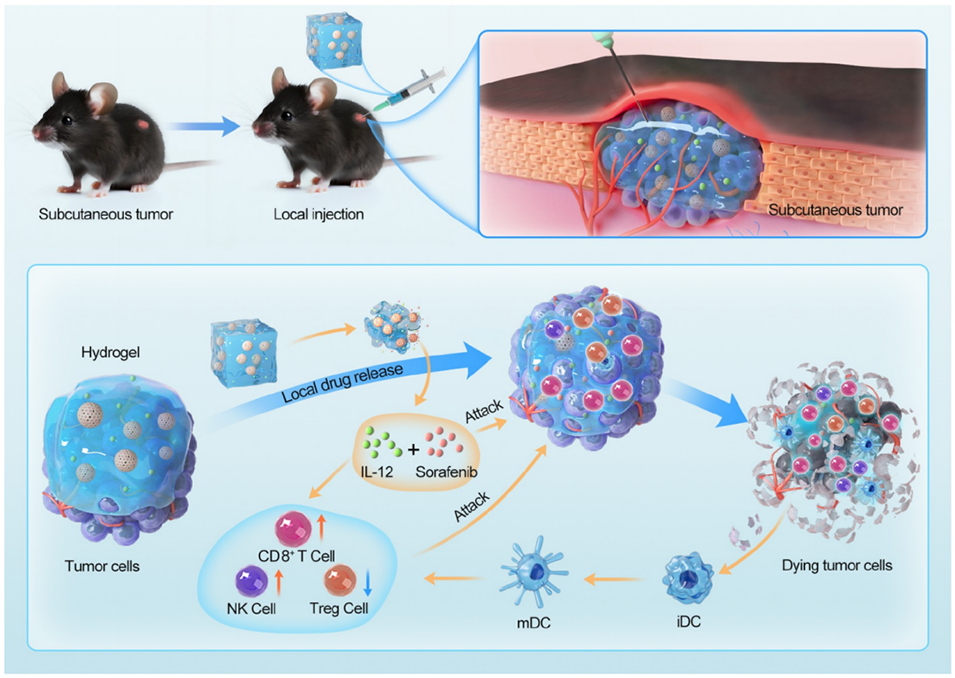
图1:SOR MPs@IL-12 Gel复合系统的示意图。该系统通过局部注射到肿瘤周围,持续释放免疫刺激细胞因子IL-12和靶向药物索拉非尼(SOR)。IL-12促进CD8+ T细胞和NK细胞的浸润,减少Treg细胞的数量,从而增强免疫系统对肿瘤的细胞毒性作用。SOR则通过抑制HCC细胞的增殖和诱导凋亡来发挥作用。死亡的肿
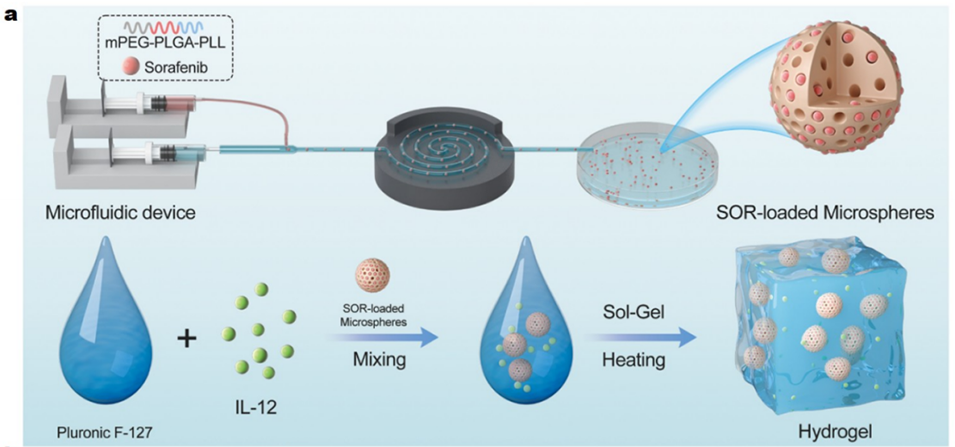
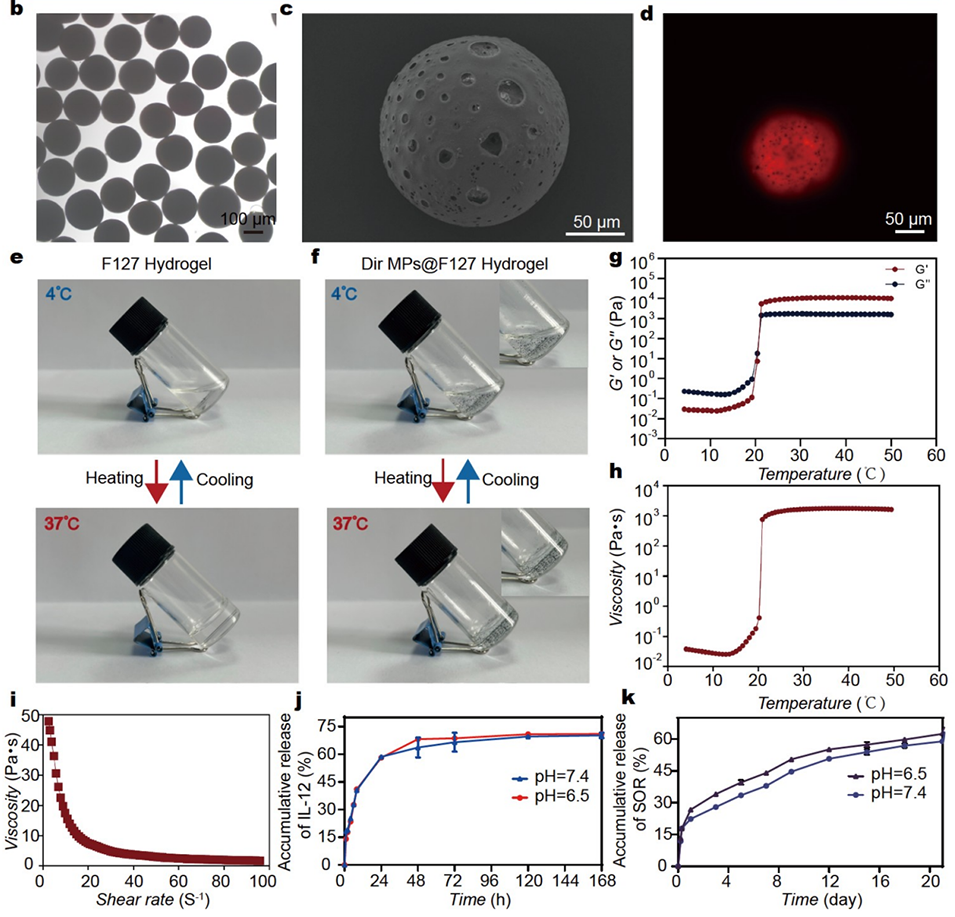
图2:展示了SOR MPs@IL-12 Gel的物理化学特性。(a)SOR MPs@IL-12 Gel的示意图。(b)光学显微镜(OM)下微球(MPs)的图像,显示了均匀分散、大小一致且呈完美球形的微球。(c)扫描电子显微镜(SEM)下冻干后微球的多孔结构,有助于药物释放。(d)荧光图像显示药物在微球中的均匀分布。(e)数码照片显示4°C时空白F127溶液和37°C时F127水凝胶的状态。(f)数码照片显示4°C时包裹Dir MPs的F127溶液和37°C时F127水凝胶的状态。(g,h)水凝胶的储能模量(G′)、损耗模量(G′′)和黏度随温度变化的流变分析结果,表明其具有温度诱导的溶胶-凝胶转变特性。(i)水凝胶的黏度随剪切率变化的曲线,显示其剪切变稀行为。(j)在不同条件下IL-12的累积释放曲线。(k)在不同条件下SOR的累积释放曲线,表明IL-12先快速释放,随后SOR缓慢持续释放。
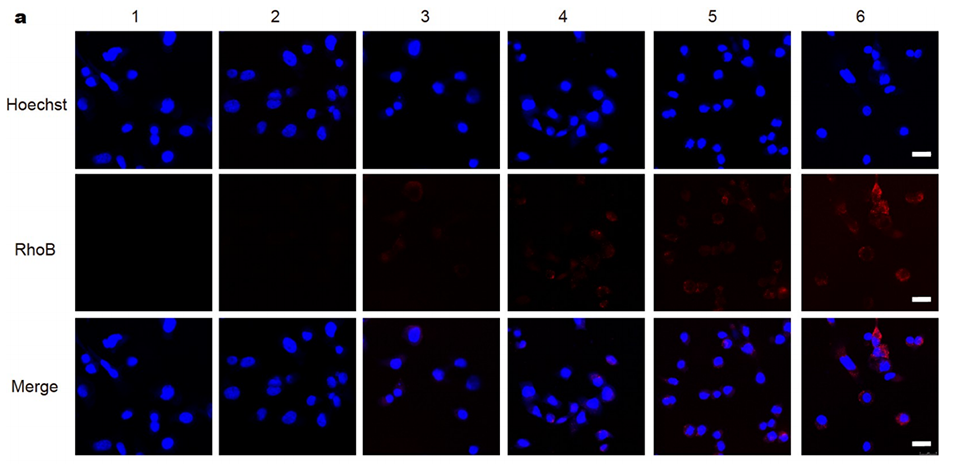
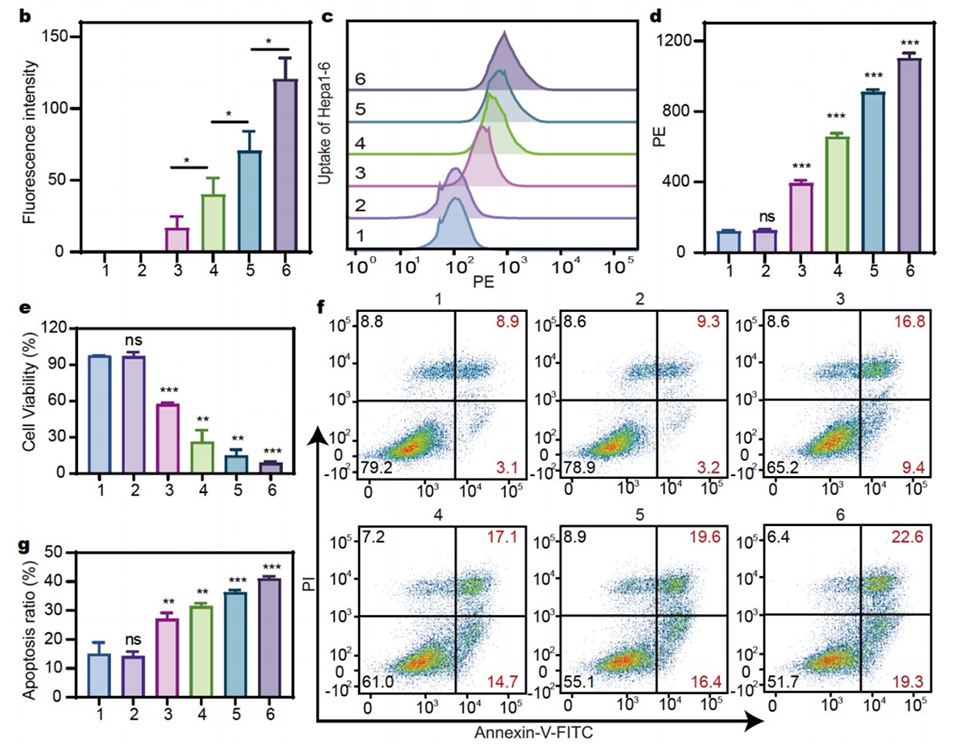
图3:细胞摄取、细胞毒性及细胞凋亡的体外实验结果。(a)CLSM图像显示Hepa1-6细胞摄取不同浓度的罗丹明B(RhoB)微球释放液(模拟不同时间点的释放液),显示细胞对药物的摄取能力。(b)对(a)中图像的定量分析。(c)流式细胞仪分析Hepa1-6细胞摄取不同浓度的RhoB微球释放液的结果。(d)对(c)中结果的定量分析。(e)CCK8实验结果显示SOR微球释放液对Hepa1-6细胞的细胞毒性,随着释放液浓度的增加,细胞毒性增强。(f)流式细胞仪分析Hepa1-6细胞在不同浓度SOR微球释放液作用下的细胞凋亡情况。(g)对(f)中结果的定量分析,表明高浓度释放液诱导的细胞凋亡率更高。
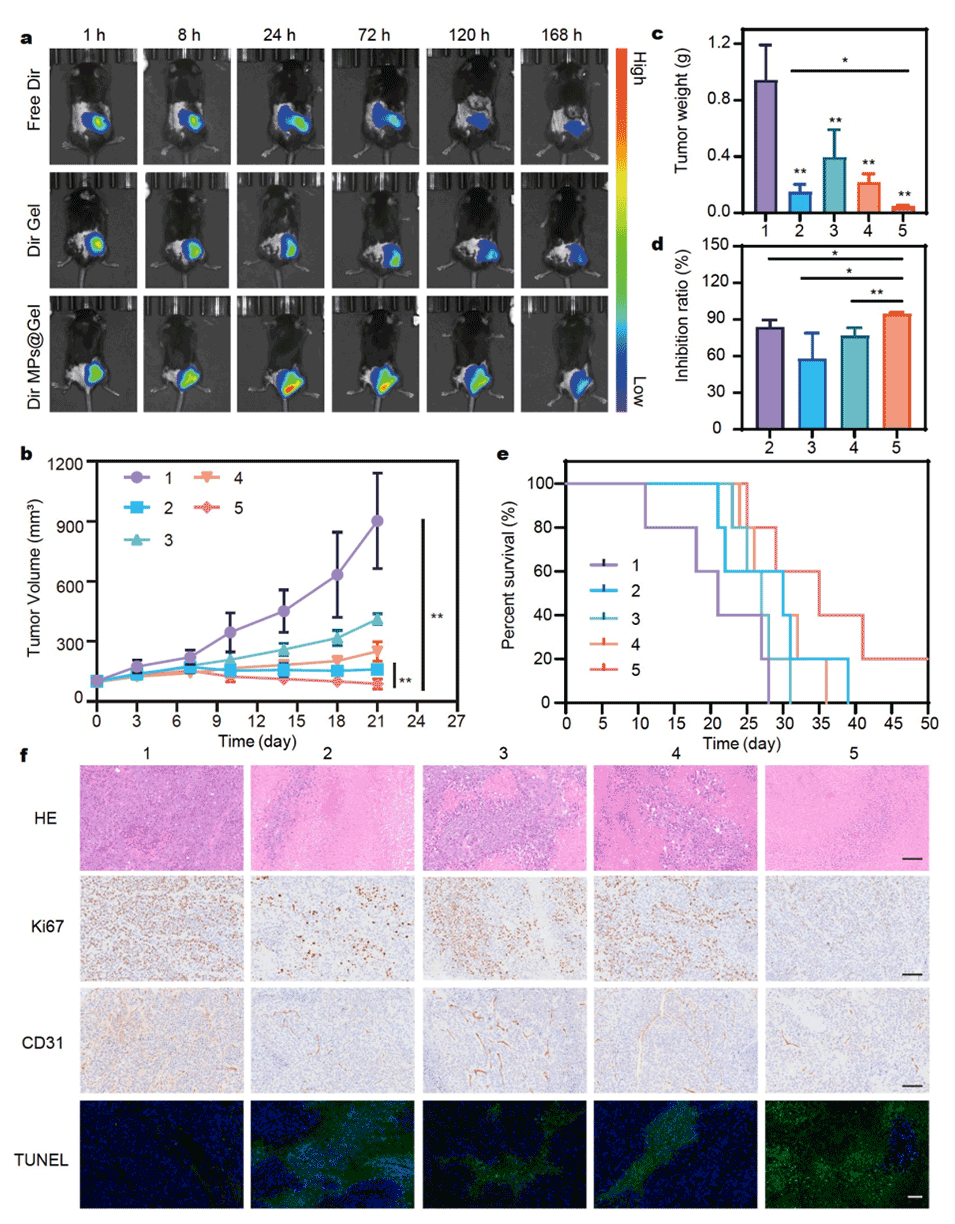
图4:展示了复合系统在体内的持续药物释放和抗肿瘤活性。(a)Free Dir、Dir Gel和Dir MPs@Gel在皮下注射后不同时间点的体内荧光图像,显示Dir MPs@Gel具有更优越的持续缓释性能。(b)不同处理下肿瘤随时间的生长曲线,SOR MPs@IL-12 Gel组的肿瘤生长最慢。(c)不同处理后切除的肿瘤重量,SOR MPs@IL-12 Gel组的肿瘤重量最轻,抑制率超过90%。(d)不同处理的肿瘤抑制率。(e)不同治疗组的生存曲线,SOR MPs@IL-12 Gel组的生存时间最长。(f)治疗结束后切除肿瘤的H&E、Ki67、CD31和TUNEL免疫组化染色结果,显示SOR MPs@IL-12 Gel组具有更强的促进肿瘤细胞凋亡和抑制肿瘤细胞增殖的效果。
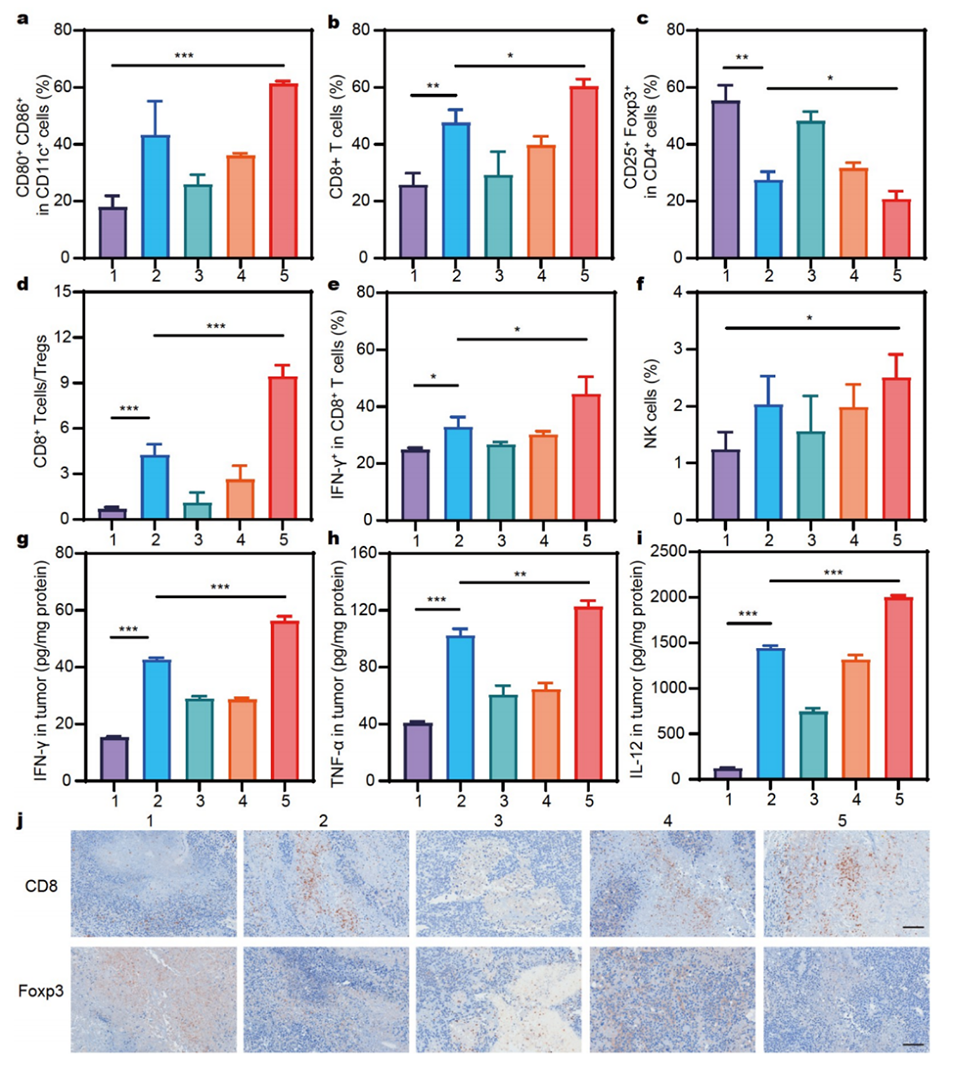
图5:展示了SOR MPs@IL-12 Gel在体内激活免疫反应的效果。(a)流式细胞仪分析成熟树突状细胞(mDCs)的比例,SOR MPs@IL-12 Gel组显著增加。(b)流式细胞仪分析CD8+ T细胞浸润的比例,SOR MPs@IL-12 Gel组显著增加。(c)流式细胞仪分析Treg细胞的比例,SOR MPs@IL-12 Gel组显著减少。(d)CD8+ T细胞与Treg细胞的比例,SOR MPs@IL-12 Gel组显著增加。(e)流式细胞仪分析CD8+ T细胞中IFN-γ+细胞的比例,SOR MPs@IL-12 Gel组最高。(f)流式细胞仪分析NK细胞的比例,SOR MPs@IL-12 Gel组显著增加。(g-i)ELISA分析肿瘤中IFN-γ、TNF-α和IL-12的分泌水平,SOR MPs@IL-12 Gel组显著上调。(j)治疗结束后切除肿瘤的CD8和Foxp3免疫组化染色结果,与流式细胞仪分析结果一致。
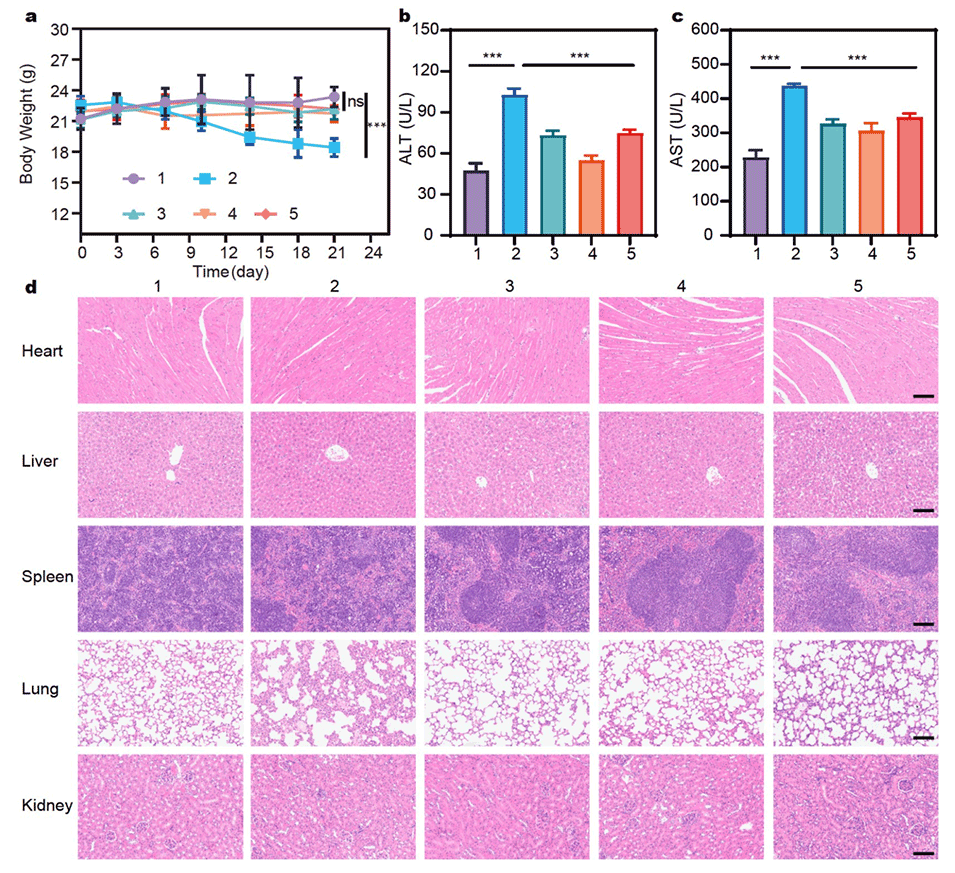
图6:展示了SOR MPs@IL-12 Gel在体内的生物相容性。(a)不同处理下小鼠体重随时间的变化曲线,Free SOR+IL-12组体重下降,而SOR MPs@IL-12 Gel组无显著变化。(b,c)不同处理后小鼠血清中ALT和AST的ELISA检测结果,SOR MPs@IL-12 Gel组显著降低ALT和AST水平。(d)不同处理后小鼠主要器官(心、肝、脾、肺、肾)的H&E染色结果,SOR MPs@IL-12 Gel组未对主要器官造成影响,显示出良好的生物相容性。
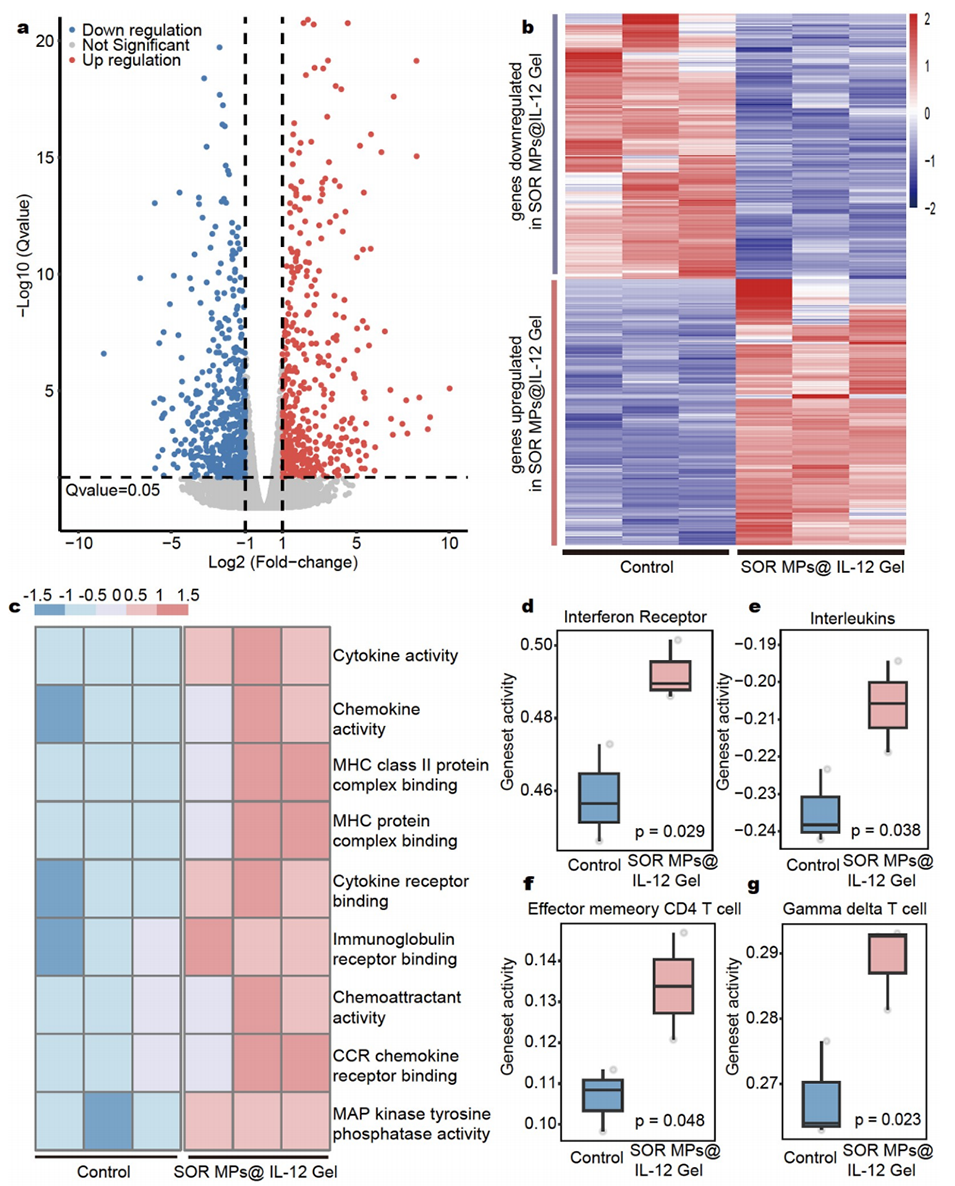
图7:展示了RNA测序分析肿瘤微环境(TME)的结果。(a,b)SOR MPs@IL-12 Gel处理与否的小鼠HCC的转录组谱。(c)SOR MPs@IL-12 Gel处理后免疫学通路的ssGSEA评分显著改变,表明免疫反应和炎症反应增强。(d-g)不同因素的柱状图分析,显示治疗后干扰素受体和白细胞介素增加,效应记忆CD4 T细胞和γδT细胞在肿瘤组织中的丰度增加。
论文链接:https://doi.org/10.1007/s40843-024-3001-3














