
导读:
海藻酸钠(SA)水凝胶微球因其易于降解和无毒特性而在生物医学应用中备注关注。然而,其高溶胀能力和对疏水性药物的有限负载效率阻碍了它们在药物控释中的应用。近期,有研究人员通过离子交联法成功制备了一种基于黄蓍胶(TG)、β-环糊精(β-CD)和海藻酸钠(SA)的新型水凝胶微球,用于提高疏水性药物阿司匹林的负载效率和实现pH敏感的药物控释,显著改善了传统SA水凝胶微球在药物递送中的局限性。相关研究以“Degradable pH-Sensitive Calcium-Crosslinked Tragacanth Gum/β-Cyclodextrin/Sodium Alginate Hydrogel Microspheres Prepared via Ionotropic Gelation Technique for Hydrophobic Drug Delivery”为题目,发表在期刊《Journal of Polymers and the Environment》上。
本文要点:
1、本研究采用离子凝胶法制备了一系列黄蓍胶/β-环糊精/海藻酸钠(TG/β-CD/SA)水凝胶微球,旨在有效递送疏水性药物阿司匹林。
2、衰减全反射-傅里叶变换红外光谱(ATR-FTIR)证实了交联TG/β-CD/SA水凝胶微球的成功合成,粉末X射线衍射(PXRD)显示微球为非晶态,药物均匀分散在水凝胶内,扫描电子显微镜(SEM)显示聚合物网络具有多孔和球形表面形态。
3、研究发现微球的凝胶分数和溶胀行为取决于β-CD、SA和TG的浓度。
4、与TG/SA微球相比,将β-CD引入TG/β-CD/SA微球显示出高载药量(19%)和药物包封率(63.33%)。这归因于阿司匹林被包埋在β-CD的疏水腔内,提高了其在微球内的负载量。
5、此外,它还延缓了微球中阿司匹林的释放,导致TG/β-CD/SA微球在pH 1.2和7.4时出现受控释放模式(零级动力学)。
6、与pH 1.2(17.1%)相比,TG/β-CD/SA微球在pH 7.4时表现出更高的药物释放率(59.9%),非常适合在胃肠道结肠区域内进行靶向药物输送。
7、开发的水凝胶微球在PBS中完全降解,对HCT-116人结肠细胞系没有细胞毒性,展现出作为疏水性药物递送系统的巨大潜力。
选择黄蓍胶(TG)、β-环糊精(β-CD)和海藻酸钠(SA)作为水凝胶微球的主要成分,主要基于以下几个原因:
1、生物相容性与生物降解性:这三种材料均为天然高分子,具有良好的生物相容性和生物降解性,使其在药物传递系统中更安全,降低了对身体的潜在毒性。
2、良好的交联特性:海藻酸钠(SA)作为一种生物聚合物,能够通过离子交联技术形成稳定的水凝胶结构。黄蓍胶在这一过程中能够增强胶体的机械强度,提高水凝胶的稳定性。
3、药物载入能力:β-环糊精的环状结构具有疏水腔,可以有效包裹疏水性药物(如阿司匹林),从而提高药物的载入量和药物包封率。这一点在研究中已经证实,TG/β-CD/SA微球展现了比TG/SA微球更高的药物负载效率。
4、pH响应性与调控释放特性:TG、SA和β-CD的组合在不同pH条件下展示出不同的膨胀和药物释放特性,使得水凝胶微球能够在胃肠道的特定环境中实现靶向药物递送,并能够控制药物的释放速率,减少药物的副作用,提高治疗效果。
综上所述,TG、β-CD和SA的联合使用为水凝胶微球的开发提供了多项优势,使其在药物递送领域具有广阔的应用前景。
如何进一步优化水凝胶微球的性能以提高其在实际应用中的效果?
1、成分优化:可以尝试调整TG、β-CD和SA的比例,或者引入其他功能性聚合物,以进一步提高水凝胶微球的膨胀率、药物负载量和释放效率。
2、表面修饰:通过表面修饰技术,如引入靶向配体或生物活性分子,增强水凝胶微球的靶向性和生物活性,提高药物递送的精准性。
3、交联技术改进:探索新的交联方法或交联剂,以提高水凝胶微球的机械强度和稳定性,减少药物在非靶向部位的释放。
4、药物释放机制研究:深入研究药物在水凝胶微球中的释放机制,通过调整微球的孔隙结构和药物包载方式,进一步优化药物释放速率和持续时间。
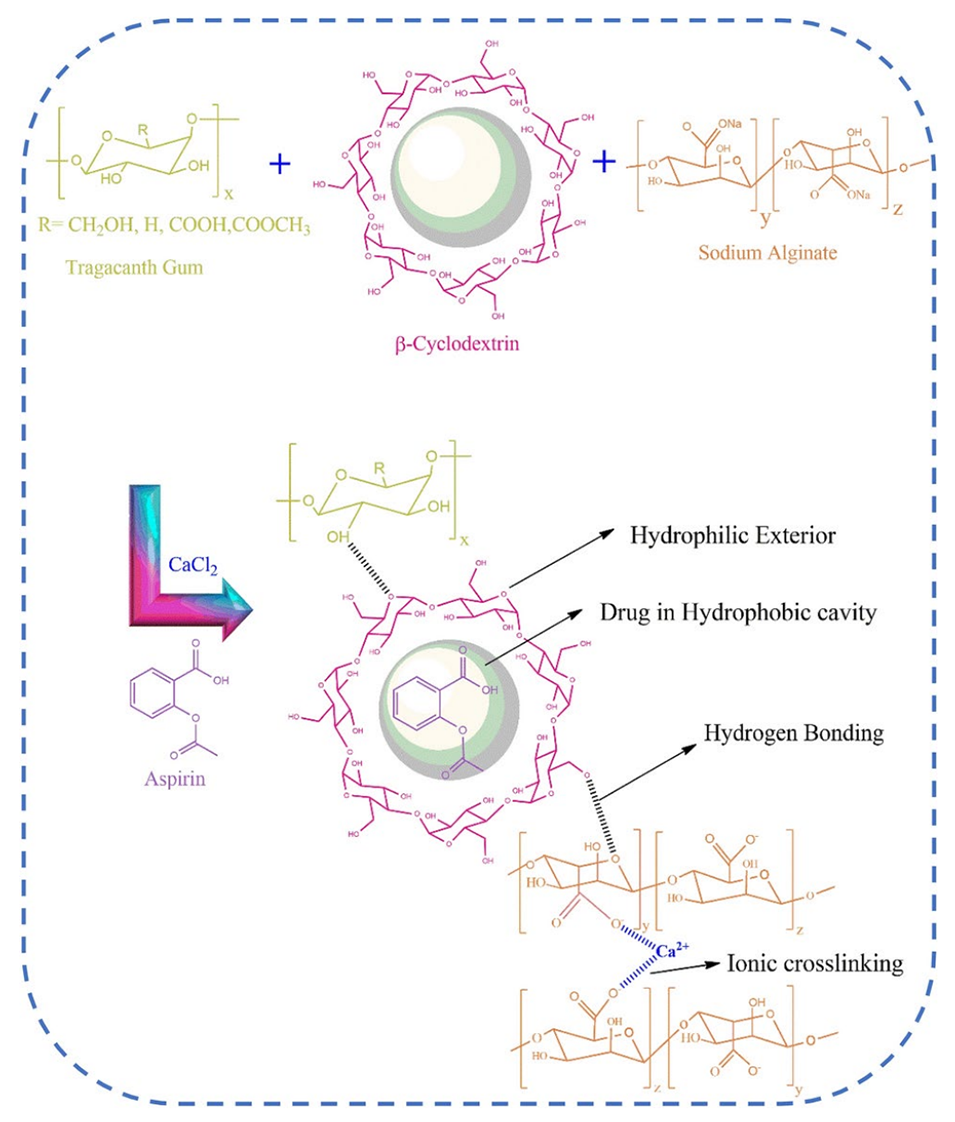
Scheme 1阿司匹林负载TG/β-CD/SA水凝胶微球的机制
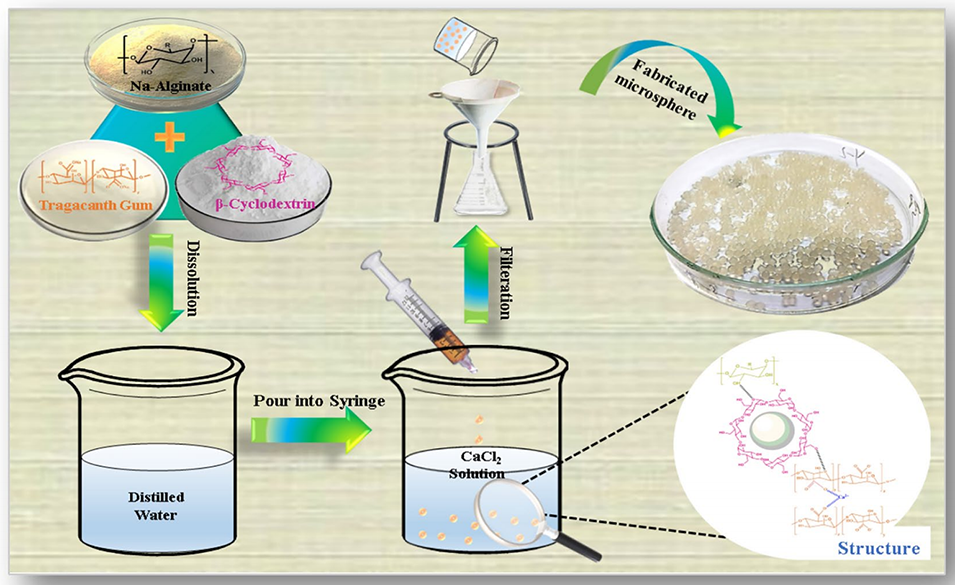
图1 TG/β-CD/SA水凝胶微球合成示意图
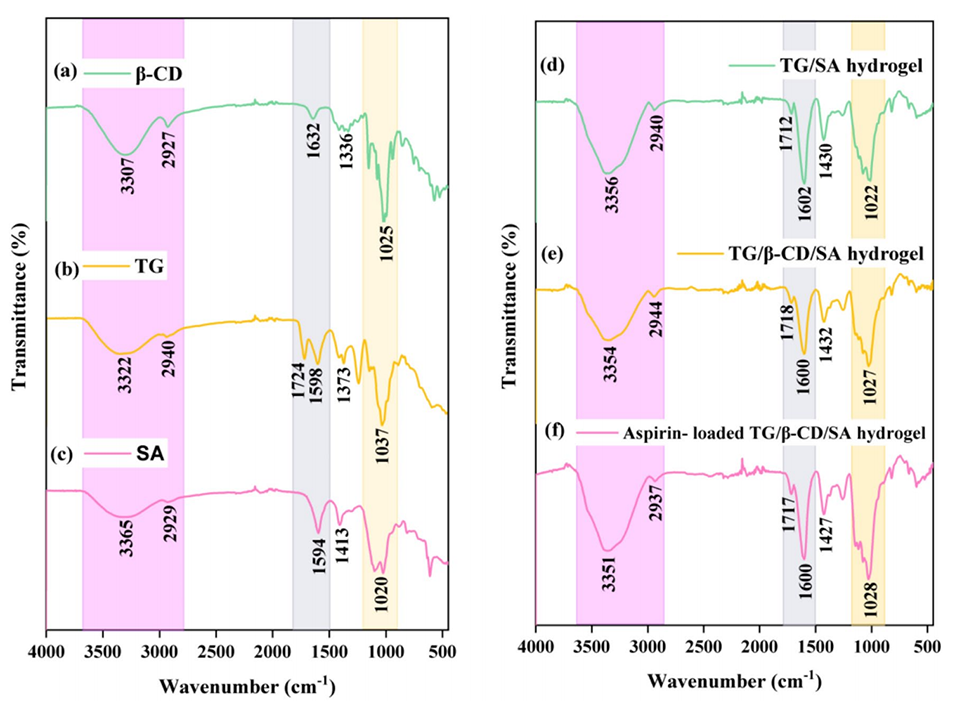
图2 β-CD、TG、SA、TG/SA水凝胶微球、TG/β-CD/SA水凝胶微球和阿司匹林负载TG/β-CD/SA水凝胶微球的ATR-FTIR光谱
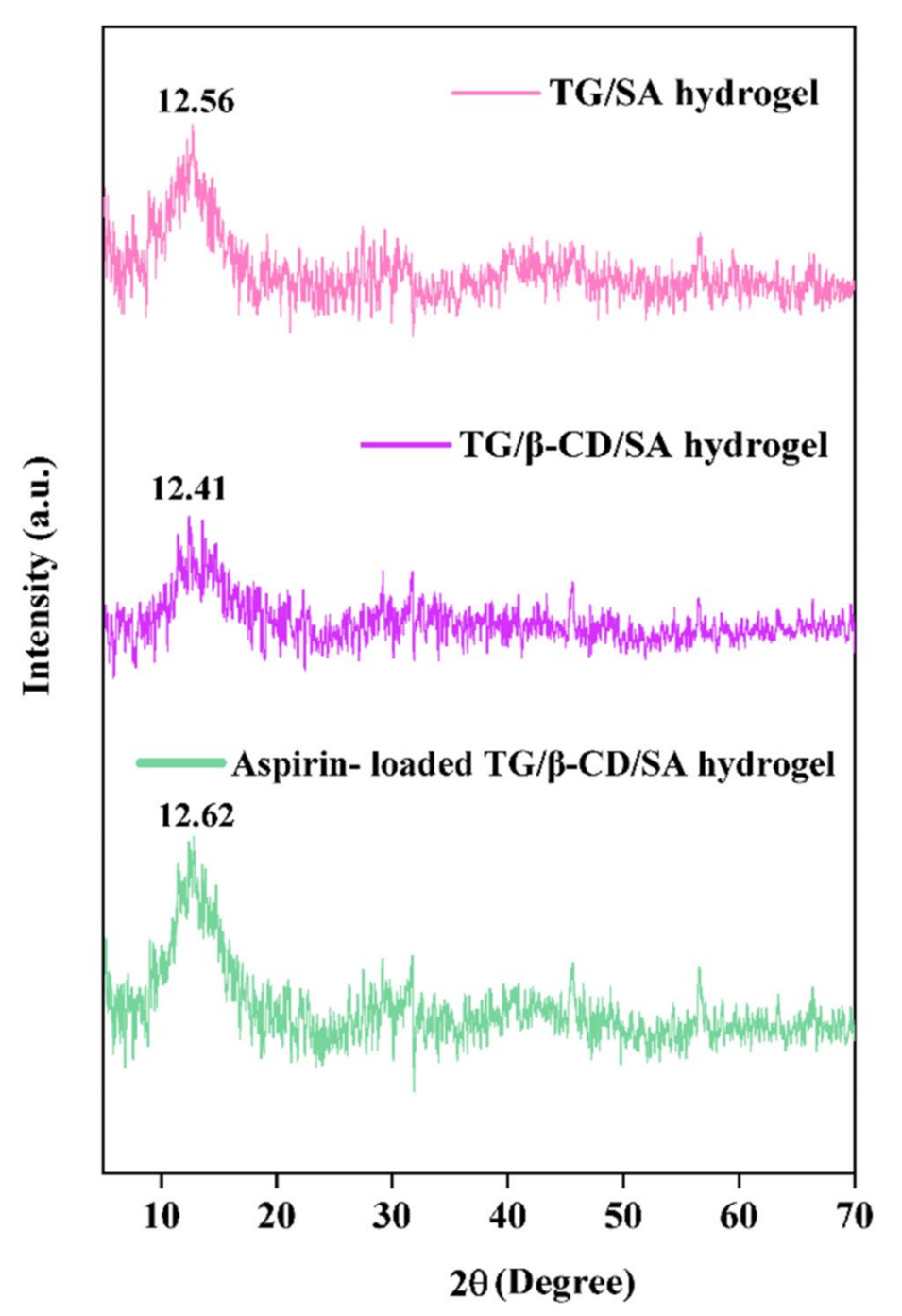
图3 TG/SA水凝胶、TG/β-CD/SA水凝胶微球和阿司匹林负载TG/β-CD/SA水凝胶微球的PXRD

图4(a,b)TG/β-CD/SA和(c,d)阿司匹林负载TG/β-CD/SA水凝胶微球的SEM图像
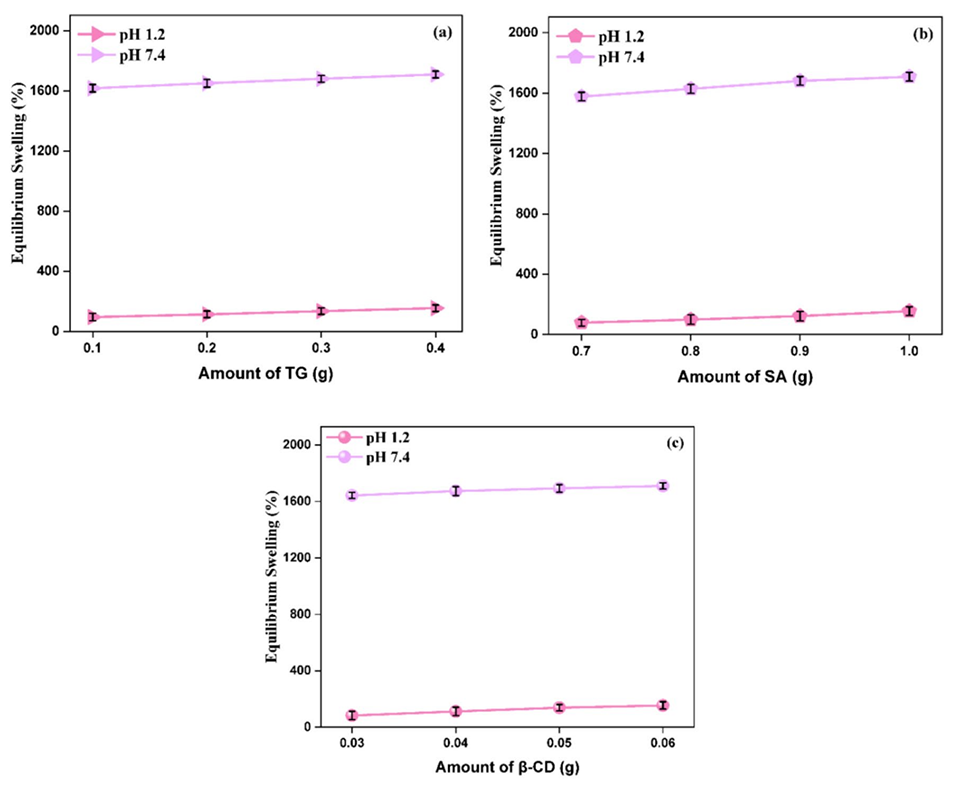
图5(a)TG、(b)SA和(c)β-CD对水凝胶微球平衡溶胀的影响
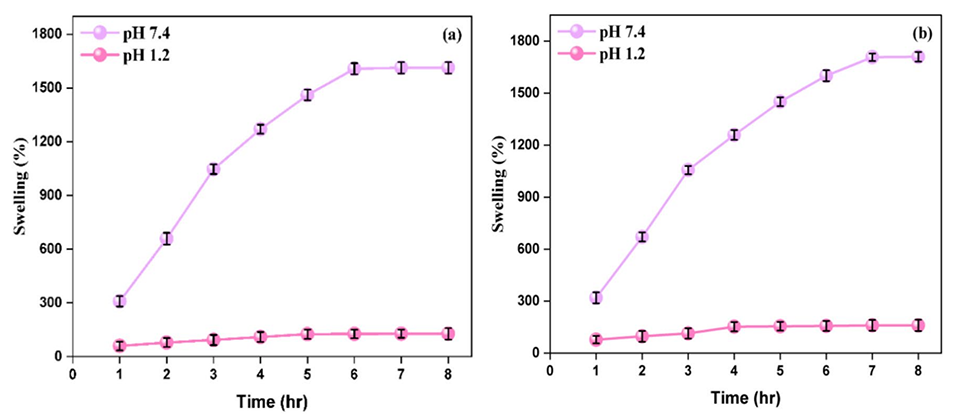
图6(a)TG/SA和(b)TG/β-CD/SA水凝胶微球的溶胀分析
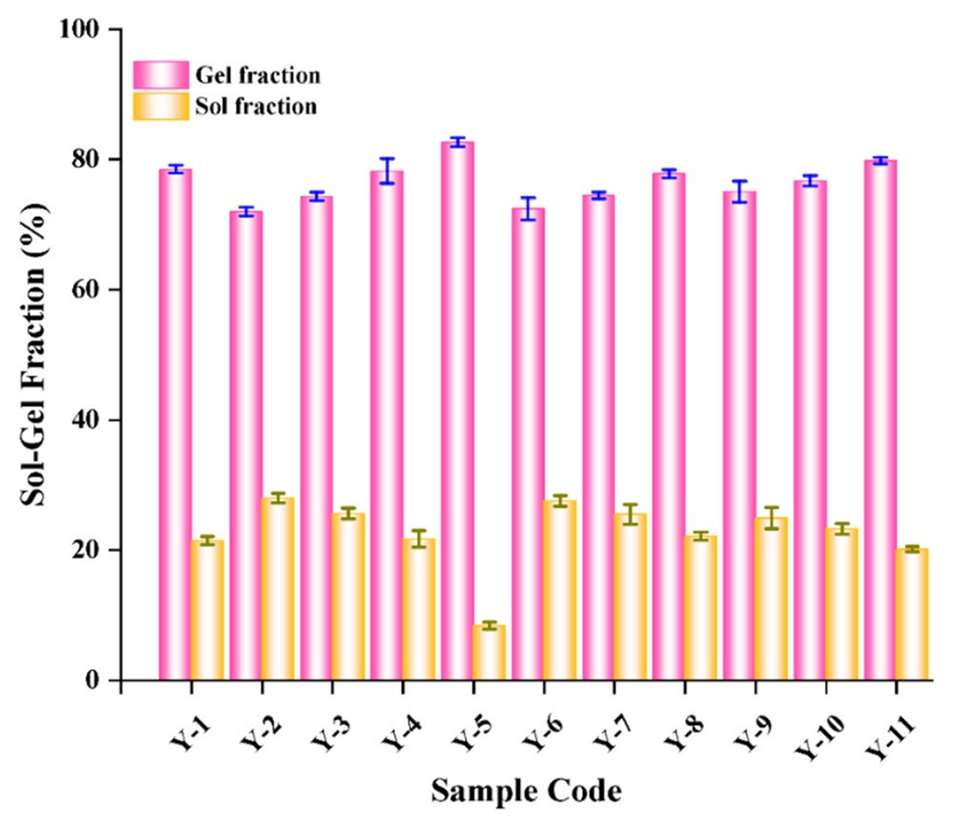
图7所有TG/β-CD/SA水凝胶微球和TG/SA水凝胶微球的溶胶-凝胶分析
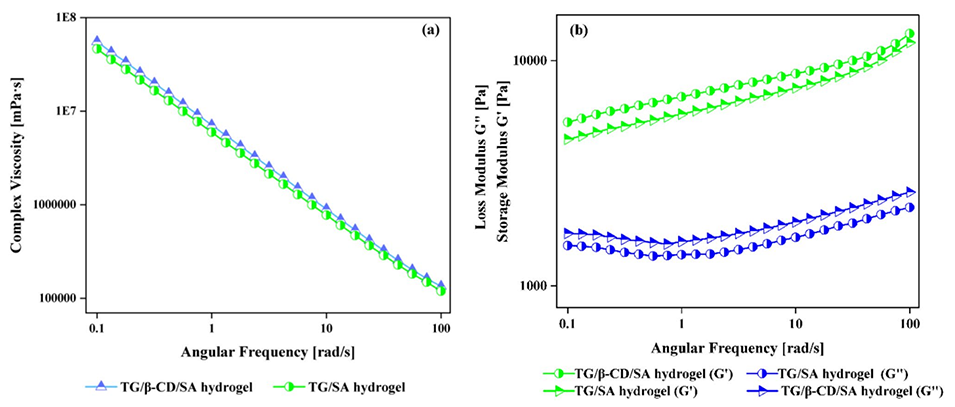
图8 TG/SA和TG/β-CD/SA水凝胶微球的(a)复数粘度与角频率的关系图,以及(b)G'和G”与角频率的关系图
图9(a)新鲜和(b)8小时后的乙醇&pH 7.4混合物,以及(c)新鲜和(d)8小时后的乙醇&pH 1.2混合物的紫外可见光谱
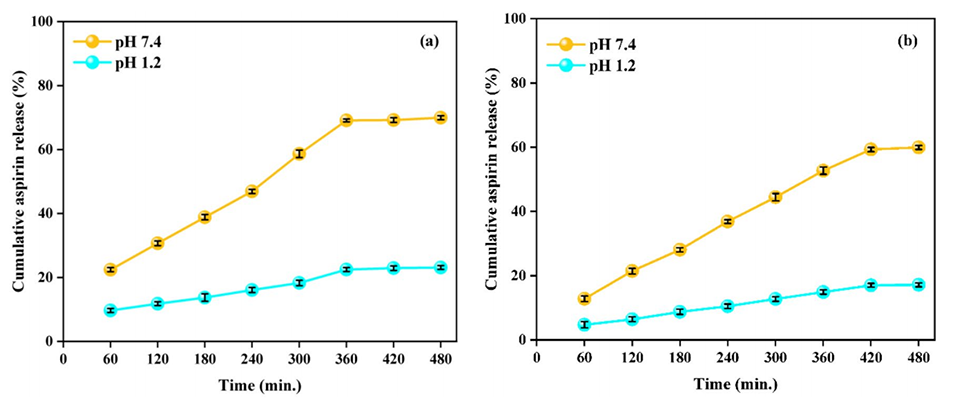
图10阿司匹林负载(a)TG/SA水凝胶微球和(b)TG/β-CD/SA水凝胶微球在pH 1.2和7.4下的释放曲线
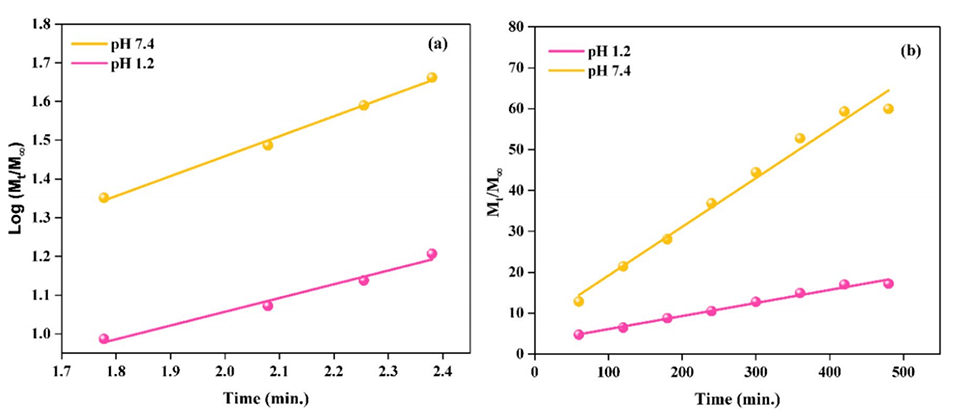
图11(a)阿司匹林负载TG/SA水凝胶微球的Korsmeyer-Peppas模型和(b)阿司匹林负载TG/β-CD/SA水凝胶微球的零级动力学模型图
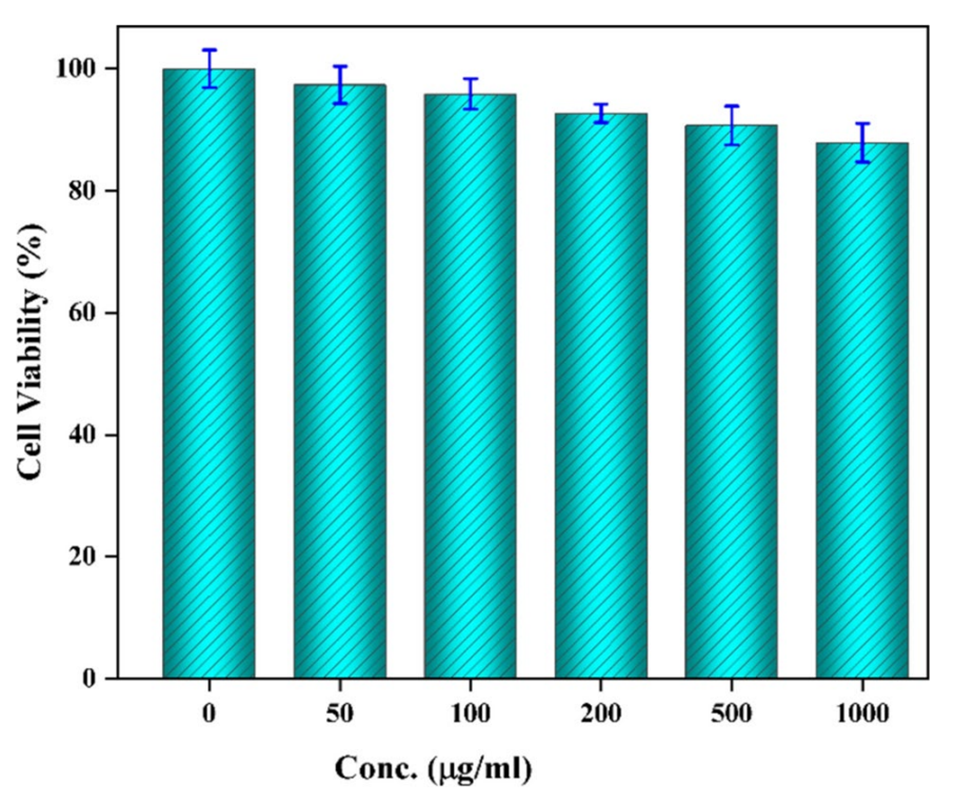
图12阿司匹林负载TG/β-CD/SA水凝胶微球的细胞毒性曲线
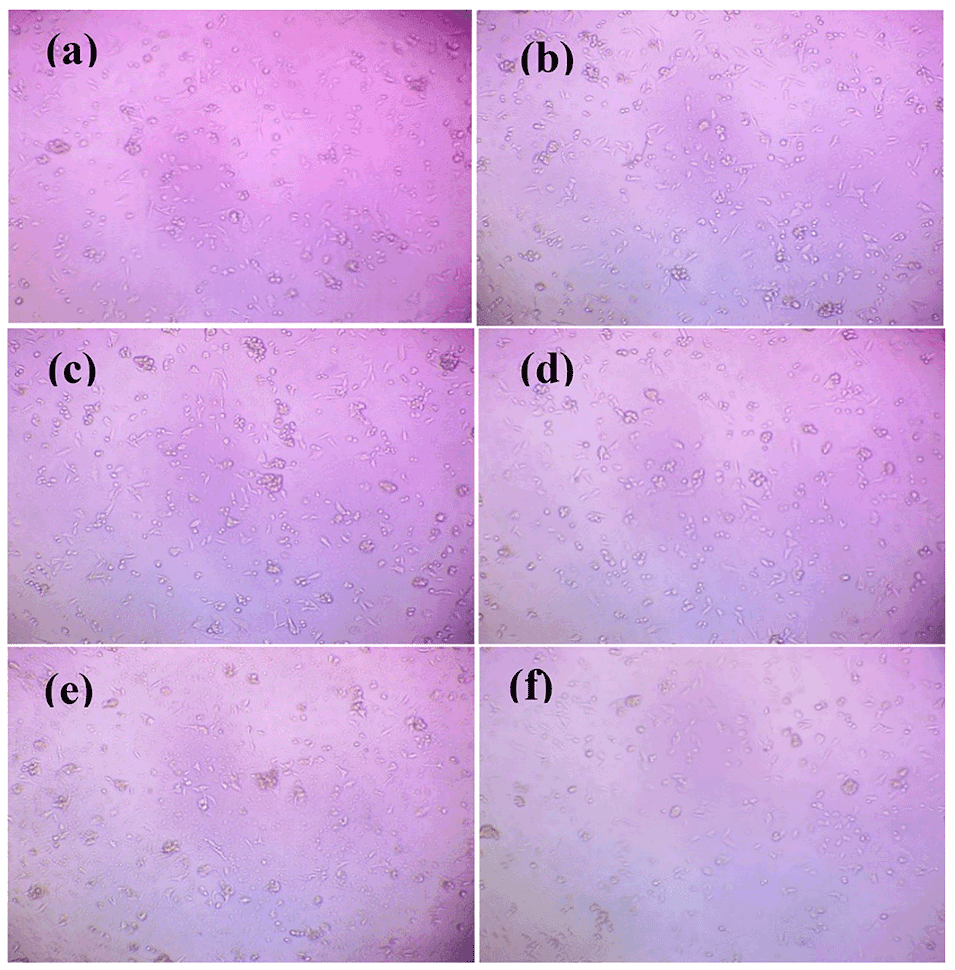
图13用(a)对照组、(b)50 µg/ml、(c)100 µg/ml、(d)200 µg/ml、(e)500 µg/ml和(f)1000 µg/ml阿司匹林负载TG/β-CD/SA水凝胶微球处理的HCT-116细胞的倒置相差显微镜图像
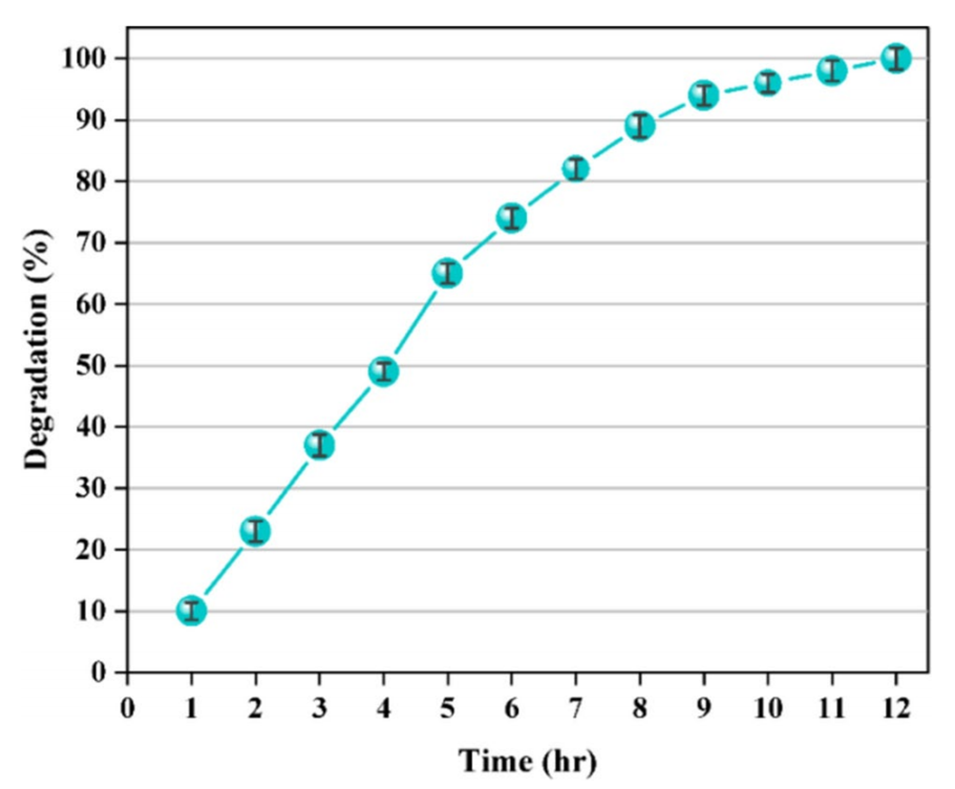
图14阿司匹林负载TG/β-CD/SA水凝胶微球的降解曲线
论文链接:https://doi.org/10.1007/s10924-024-03449-5














