
导读:
近期,上海医药工业研究院张福利教授、药物制剂国家工程研究中心王浩研究员等人在长效缓释药物制剂领域取得重要进展,成功开发了一种用于慢性疼痛管理的长效羟吗啡酮(HM)载药聚乳酸-羟基乙酸共聚物(PLGA)微球,并采用自动化、可扩展的微流体工艺系统实现了其连续化制备。该研究通过优化微流体工艺参数,制备出粒径可控、载药量高、包封率高的HM-PLGA微球,并在动物实验中验证了其长效缓释特性,为长效注射剂的连续化生产提供了新的技术平台。相关研究以“Continuous preparation of long-acting hydromorphone PLGA microspheres using an automatic and scalable microfluidic process system”为题目,发表于期刊《International Journal of Pharmaceutics》。
本文要点:
1、本研究使用自动化和可扩展的微流体工艺系统开发并制备了用于慢性疼痛管理的长效氢吗啡酮负载聚乳酸-羟基乙酸共聚物(HM-PLGA)微球。
2、该系统由一个用于颗粒生成的新型微混合器、用于连续加药的注射器和HPLC泵、一个作为过程分析技术(PAT)工具的过程拉曼光谱仪和一个用于可编程自动控制的自动化系统组成。
3、借助系统的自动化和数字化优势,研究了各种配方参数对微球性能的影响。HM-PLGA微球的粒径可以通过自动微流控处理系统进行调节。
4、本研究成功制备了长效注射用均质HM-PLGA微球,最大载药量为7.71%,药物包封率为69.40%。使用各种分析技术对其物理和化学性质进行了表征。
5、雌性ICR小鼠的药代动力学实验证实,与盐酸HM注射液相比,其在血浆中的暴露时间延长。比格犬体内研究表明,HM-PLGA微球可提供超过11天的持续药物释放。
6、总体而言,该微流控系统兼具高通量(6000 mL/h)与精准控制能力,为长效缓释制剂的连续化生产提供了可靠技术平台。
微流控系统如何克服传统PLGA微球制备工艺的可扩展性瓶颈?
1、传统工艺的局限性
批次差异大:传统乳化法依赖机械搅拌,混合效率受设备尺寸和剪切力分布不均影响(如Span值可达2.0以上)。
低通量限制:常规微流控芯片流速上限为150 mL/h,无法满足工业化需求。
2、本研究的创新方案
结构化微混合器设计:采用IL-Triangle混合单元(含收缩-扩张结构与三角形障碍物),通过强化剪切力与湍流混合,将通量提升至6000 mL/h。
模块化放大策略:基于流体力学相似性(雷诺数、毛细数一致性),通过“编号放大”(并联多通道)或“尺寸放大”(等比例增大通道)维持混合性能。
PAT集成质控:拉曼光谱实时监测DCM浓度(PLS模型R2=0.9898),结合压力/温度传感器预警堵塞风险,确保工艺稳定性。
3、工业适配性验证
参数可控性:总流速(TFR)和流速比(FRR)精准调控粒径,载药量最高达7.71%,满足不同临床需求。
成本效益:单批次连续生产时间缩短至7小时(传统方法需24–48小时),溶剂消耗降低30%。
HM-PLGA微球的药物释放动力学如何通过微流控技术实现精准调控?
1、释放机制的核心影响因素
粒径-表面积效应:小粒径微球(如7.6 μm)因高比表面积导致突释显著(62.2%首日释放),而大粒径微球(53.5 μm)扩散路径延长,释放平缓(10.45%突释,11天累计95.6%)。
PLGA降解与药物分布:XRD与拉曼成像证实HM以无定形状态均匀分散,避免结晶区药物滞留,结合低分子量PLGA(M.W. 14,000)加速降解,实现完全释放。
2、微流控技术的调控手段
工艺参数联动设计:
TFR与FRR协同:高TFR(90 mL/min)增强剪切力生成小粒径,低FRR(1:29)减少有机相占比抑制突释。
PLGA浓度优化:18% PLGA提升溶液粘度,延缓溶剂扩散速率,形成致密微球结构。
处方策略:HM碱基与PLGA的疏水相互作用增强包封效率(EE 69.40%),减少水相泄露。
3、体内外相关性(IVIVC)挑战
差异来源:小鼠皮下微环境pH值波动加速PLGA水解,而比格犬肌肉注射局部血流量差异导致释放速率波动。
解决方案:通过调整PLGA乳酸/羟基乙酸比例(50:50→75:25)或引入pH缓冲剂(如磷酸盐),可平衡降解速率与临床需求。
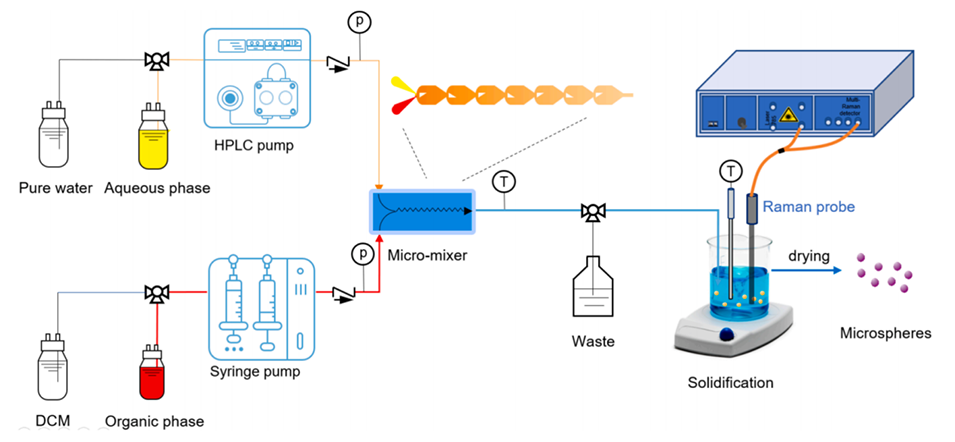
图1.用于HM-PLGA微球制备的微流体工艺系统装置。
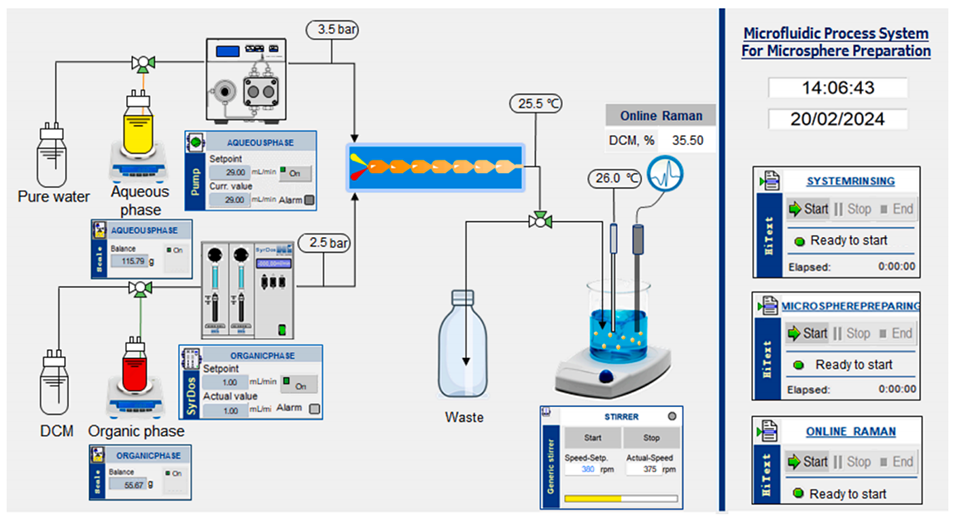
图2.LabVision软件中微流体工艺系统制备微球的过程可视化和自动化。
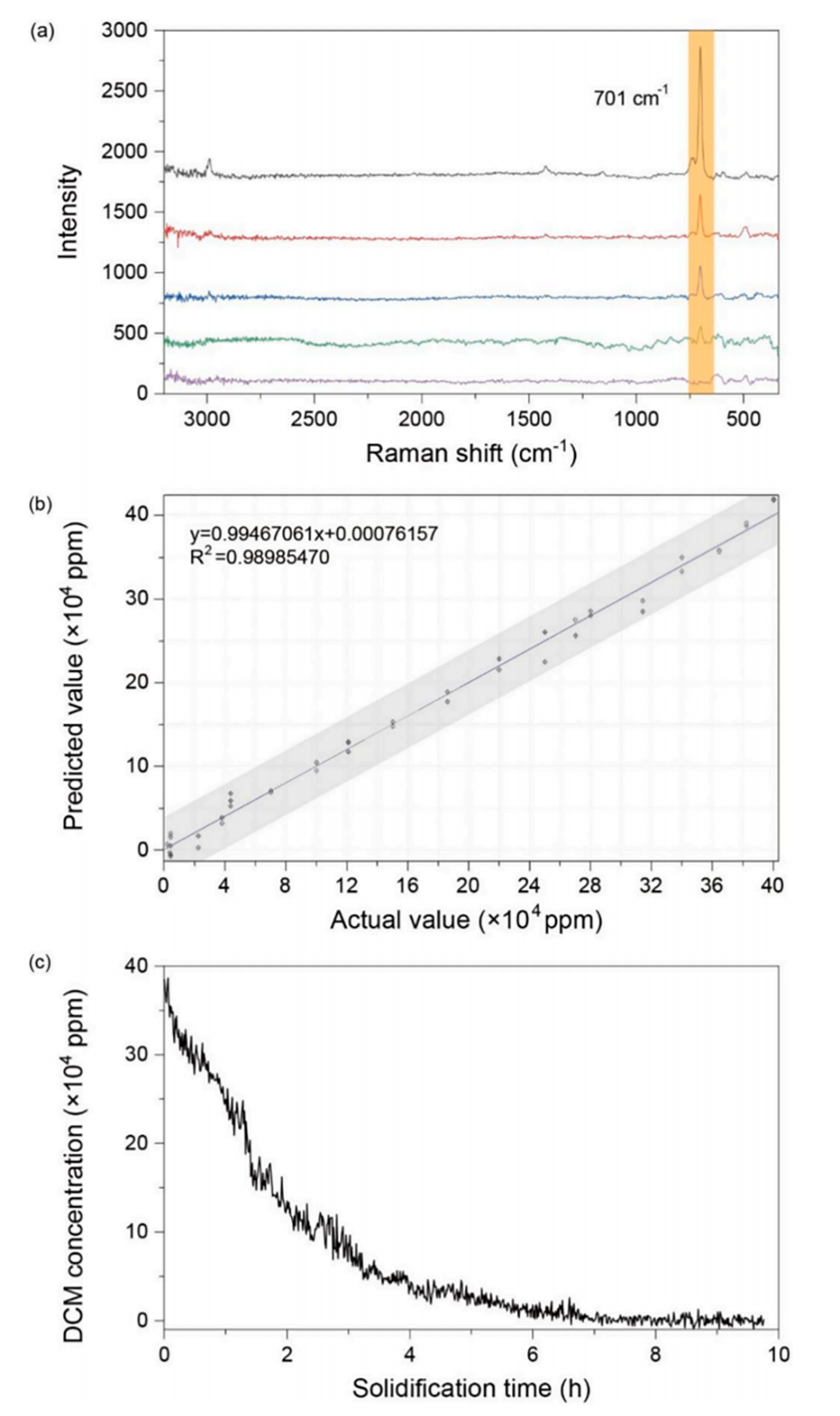
图3.(a)固化过程中采集的在线拉曼光谱;(b)使用PLS算法对DCM进行拉曼分析时,实际浓度与模型预测浓度的定量关系;(c)在整个固化过程中基于拉曼分析监测DCM浓度。
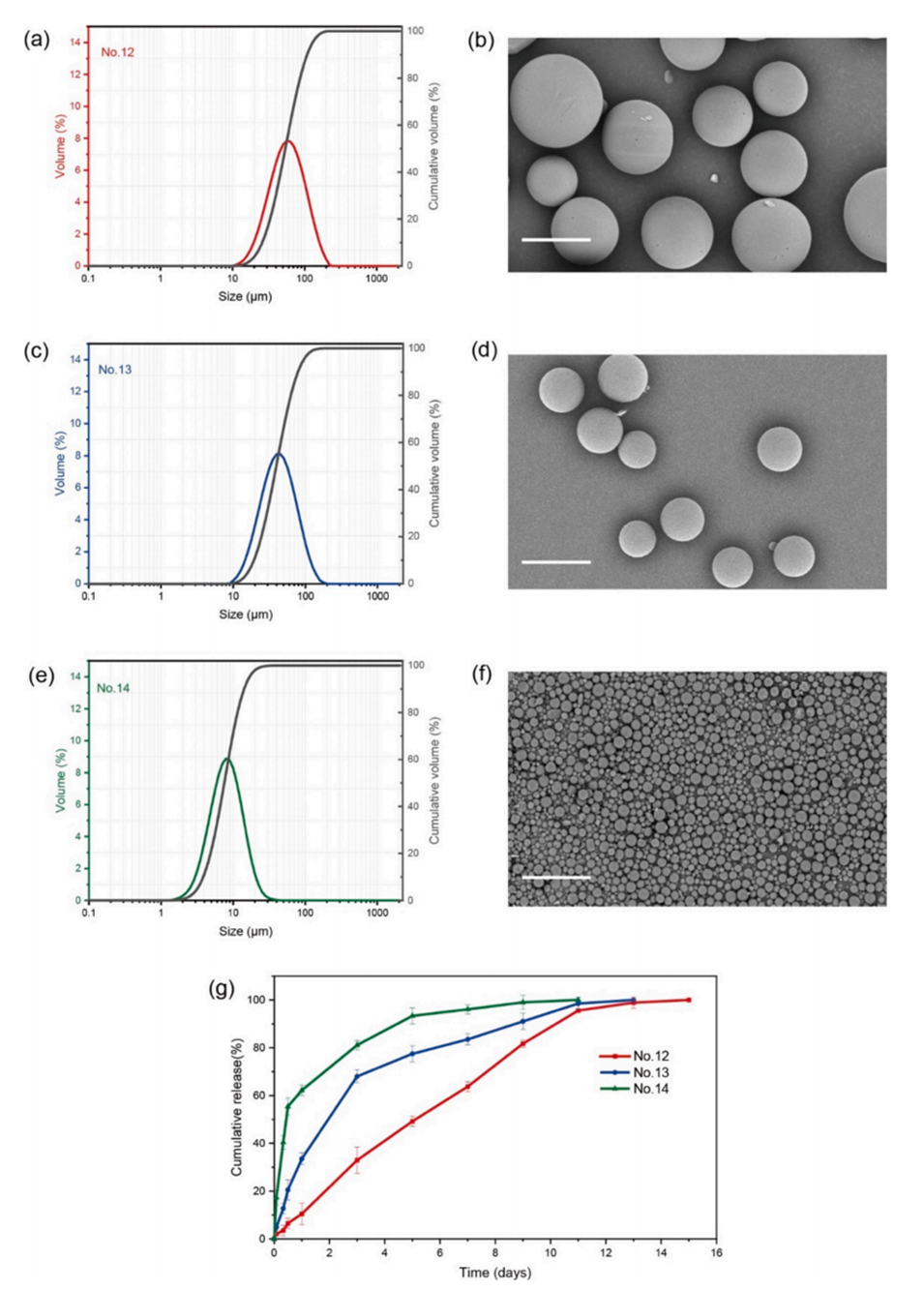
图4.使用微流体工艺系统获得的HM载药微球的粒径分布和形貌:粒径分布:(a)No.12,(c)No.13,(e)No.14;扫描电子显微镜(SEM)图像:(b)No.12,(d)No.13,(f)No.14,比例尺为50μm;(g)No.12、No.13和No.14 HM-PLGA微球的体外药物释放。
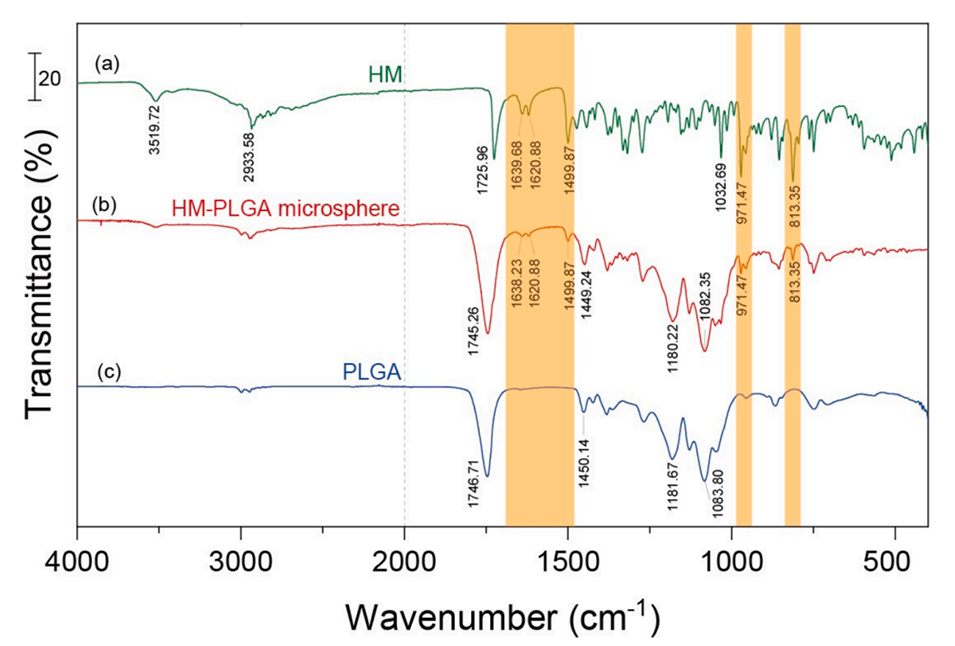
图5.HM(a)、PLGA(b)和HM-PLGA微球(c)的傅里叶变换红外光谱(FT-IR)。
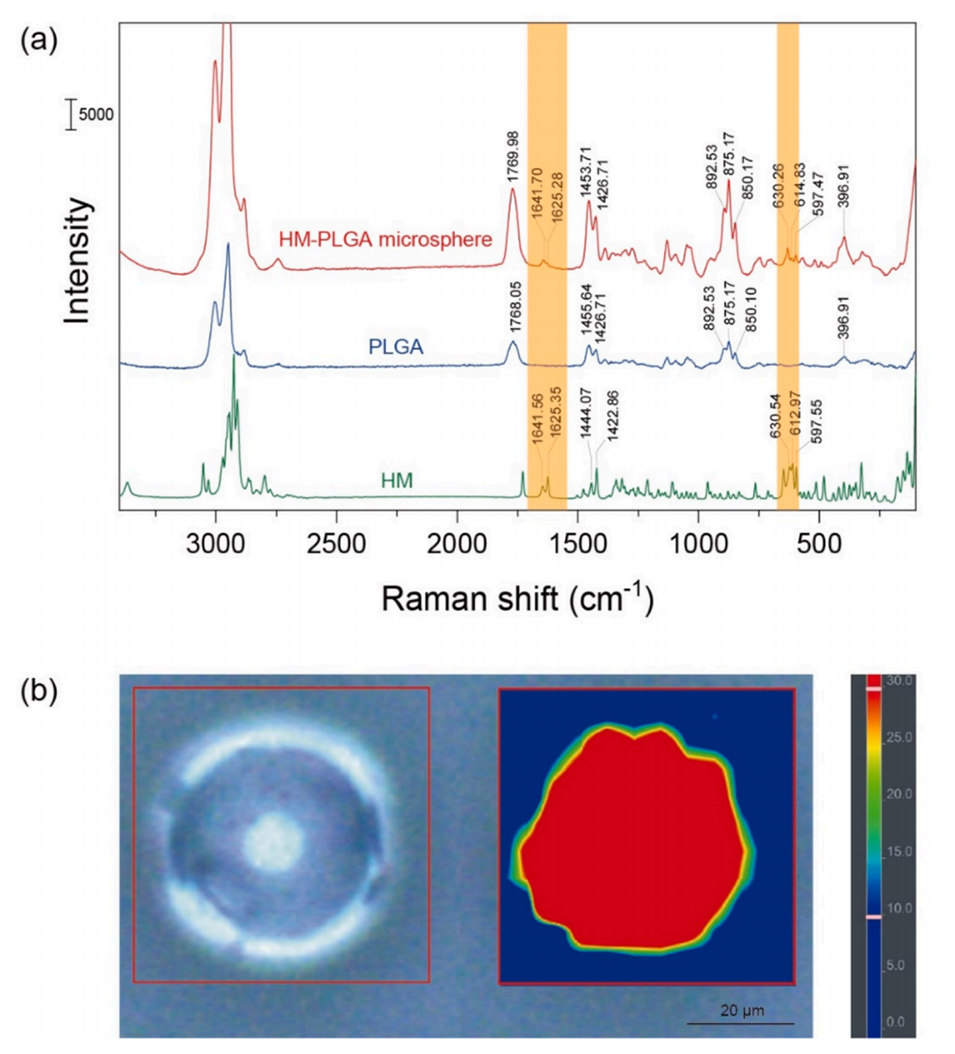
图6.(a)HM-PLGA微球、PLGA和HM的拉曼位移。(b)HM-PLGA微球的拉曼显微镜药物分布图像。
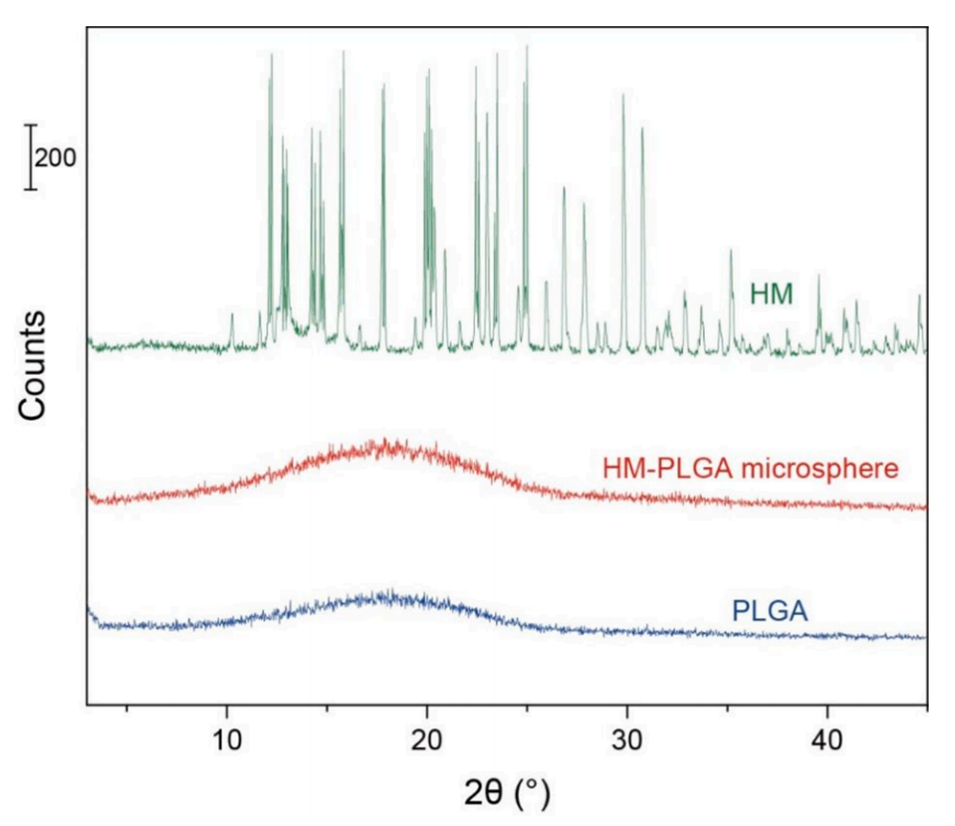
图7.HM-PLGA微球(红色)、PLGA(蓝色)和HM(绿色)的X射线衍射(XRD)图谱。
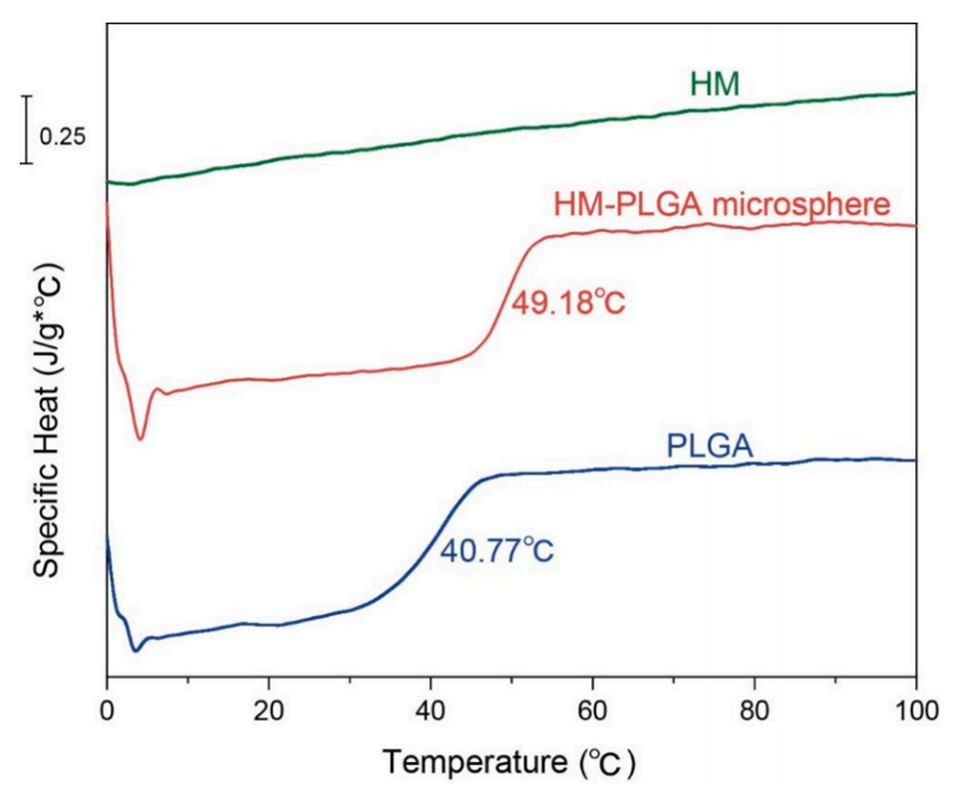
图8.HM-PLGA微球(红色)、PLGA(蓝色)和HM(绿色)的差示扫描量热法(DSC)曲线。
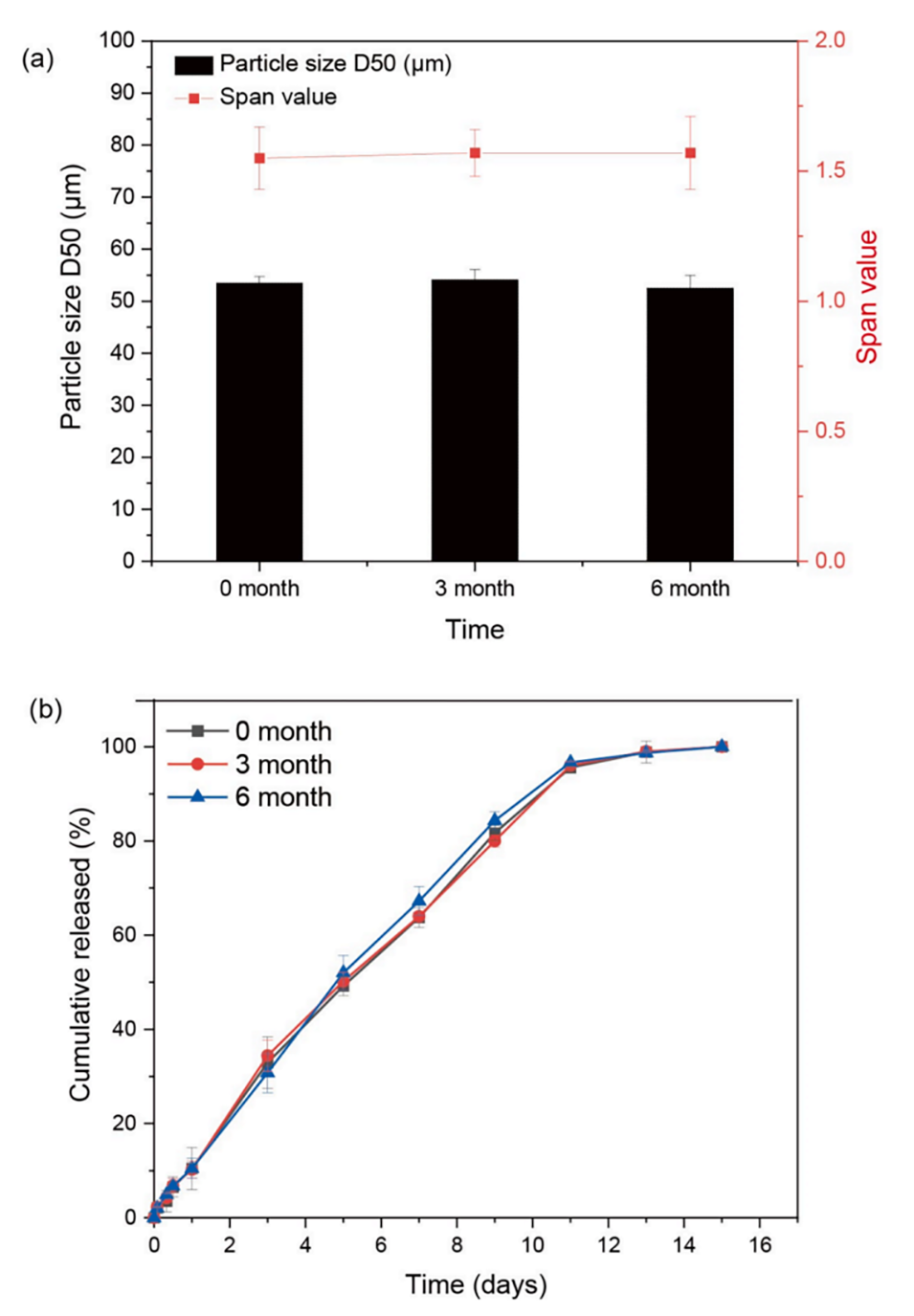
图9.新鲜制备的HM-PLGA微球以及在2–8℃下避光保存3个月和6个月的微球的粒径(a)和体外药物释放曲线(b)。
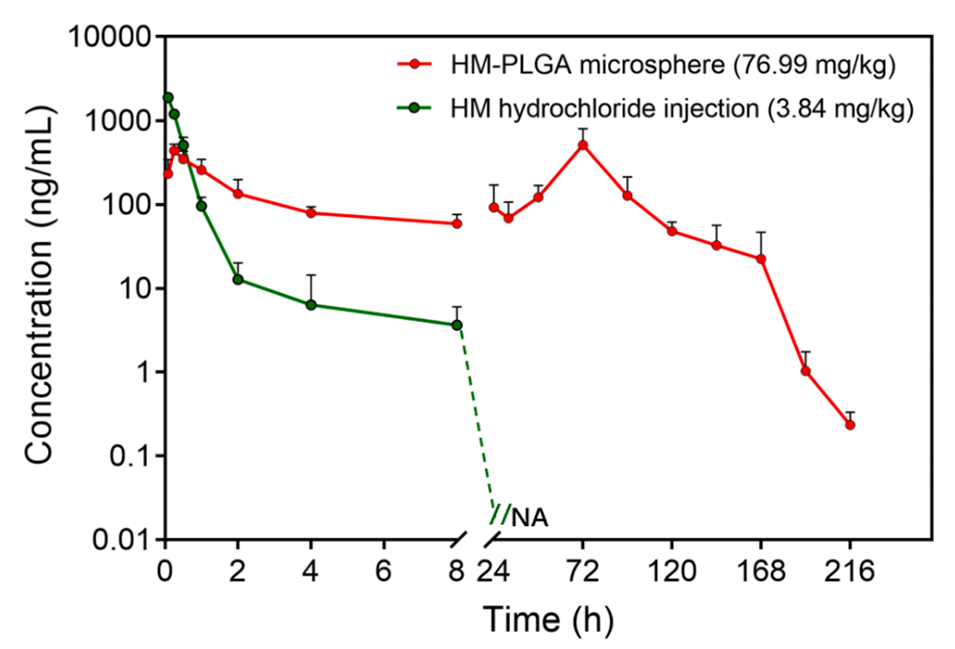
图10.小鼠单次皮下注射微球后HM的血浆浓度-时间曲线(均值±标准差,n=6)。
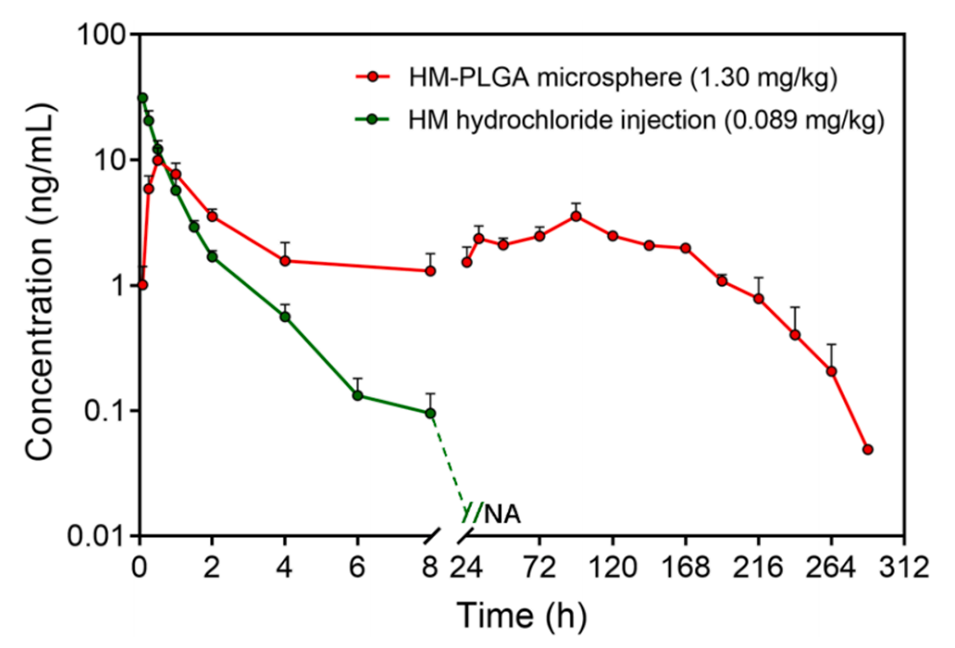
图11.比格犬单次肌内注射微球后HM的血浆浓度-时间曲线(均值±标准差,n=3)。
论文链接:https://doi.org/10.1016/j.ijpharm.2025.125459














